延胡索乙素磷脂复合物及其固体分散体、油制剂、纳米混悬剂的制备及药动学研究
2022-07-21李君霞曹亚蕊王金涛方晓东
李君霞,曹亚蕊,王金涛,方晓东
延胡索乙素磷脂复合物及其固体分散体、油制剂、纳米混悬剂的制备及药动学研究
李君霞1,曹亚蕊1,王金涛2*,方晓东3
1. 河南省胸科医院,河南 郑州 450000 2. 郑州大学材料学院,河南 郑州 450000 3. 河南大学药学院,河南 郑州 475001
制备延胡索乙素磷脂复合物(tetrahydropalmatine phospholipids complex,THP-PC)、延胡索乙素磷脂复合物固体分散体(THP-PC solid dispersion,THP-PC-SD)、延胡索乙素磷脂复合物油制剂(THP-PC oil preparation,THP-PC-OP)和延胡索乙素磷脂复合物纳米混悬剂(THP-PC nanosuspensions,THP-PC-NPs),并分别比较其在SD大鼠体内的药动学行为。溶剂挥发法分别制备THP-PC和THP-PC-SD,采用X射线粉末衍射(X-ray powder diffraction,XRPD)技术分析THP的存在状态。高压均质法制备THP-PC-NPs,测定粒径及ζ电位。以THP混悬液为参考,分别比较THP-PC、THP-PC-SD和THP-PC-NPs体外溶出情况。SD大鼠分别ig给予THP、THP-PC、THP-PC-SD、THP-PC-OP和THP-PC-NPs,HPLC法测定THP血药浓度,计算主要药动学参数。THP在THP-PC、THP-PC-SD中均以无定型状态存在。THP-PC-NPs平均粒径为(184.57±10.41)nm,ζ电位为(−31.26±1.93)mV。THP-PC、THP-PC-SD和THP-PC-NPs均在不同程度上提高了THP的溶出度。与THP-PC相比,THP-PC相对生物利用度提高至1.70倍,而THP-PC-SD、THP-PC-NPs和THP-PC-OP的相对生物利用度分别进一步提高至4.11、4.86、4.22倍。THP-PC-SD、THP-PC-NPs和THP-PC-OP均可进一步提高THP-PC的生物利用度。
延胡索乙素;磷脂复合物;固体分散体;油制剂;纳米混悬剂;溶出度;生物利用度;药动学;溶剂挥发法;X射线粉末衍射;高压均质法
延胡索乙素(tetrahydropalmatine,THP)是一种生物碱,又称四氢巴马汀,主要从罂粟科紫堇属植物延胡索W. T. Wang的干燥块茎中提取得到[1-2],在我国有近千年的入药历史。研究显示,THP具有镇静、镇痛、抗心肌缺血、抗肿瘤、抗血栓、抑制胃酸分泌、抗心律失常、心肌缺血/坏死保护等药理活性[2-4],研究开发价值较高。但THP水溶性较差[5-6],溶出度低,体内易被代谢[7],口服吸收生物利用度仅为6.59%[8],势必影响THP药效发挥及其临床应用。THP新制剂研究有自微乳[6]、纳米结构脂质载体[9]、脂质体[10]等制剂新技术的报道。
磷脂复合物(phospholipids complex,PC)是难溶性药物与磷脂在非质子溶剂中通过某种作用力(如氢键、范德华力等)结合在一起而形成的一种复合物。该复合物继承了磷脂的亲水亲油特点,使药物的水溶性和脂溶性均可达到提高[11-15],为促进吸收奠定基础。但磷脂复合物是一种黏性物质,体外溶出较慢,影响生物利用度提升幅度[16-18]。固体分散体(solid dispersion,SD)和油制剂(oil preparation,OP)在常规制剂中制备工艺相对简单可靠,故本研究将延胡索乙素磷脂复合物(THP-PC)进一步制备成延胡索乙素磷脂复合物固体分散体(THP-PC- SD)[19-20]和延胡索乙素磷脂复合物油制剂(THP- PC-OP)。纳米混悬剂(nanosuspensions,NPs)在纳米制剂中载药量较高,工艺相对简单,所以本研究进一步将THP-PC制备成延胡索乙素磷脂复合物纳米混悬剂(THP-PC-NPs)[21-22],并比较其体外溶出情况及体内口服药动学行为,为THP新制剂研发提供新策略。
1 仪器与材料
1.1 仪器
Agilent 1100型高效液相仪器,配置DAD检测器,温控进样盘,美国安捷伦公司;BP-210D型电子分析天平,赛多利斯科学仪器北京有限公司;D8型X射线粉末衍射仪,瑞士布鲁克公司;R2000型旋转蒸发仪,艾卡仪器设备公司;DZF-6020型台式真空干燥箱,郑州生化仪器有限公司;MS-1型磁力搅拌器,上海尚普仪器公司;GJB300型均质机,常州均质机械设备公司;Nano ZS90型纳米粒度仪,英国Malvern公司;RC-6D型溶出仪,天津创兴电子设备制造公司;HX-10-50D型冻干机,上海沪析冷冻干燥机设备公司;SZ-24氮气吹扫仪,上海舜制仪器公司。
1.2 材料
THP原料药,批号20180915,质量分数97.6%,西安瑞盈生物科技有限公司;THP对照品,批号110726-201812,质量分数99.8%,中国食品药品检定研究院;聚乙烯吡咯烷酮K30(PVP K30),批号201748T234,德国BASF公司;白屈菜红碱对照品,批号MUST-18252556,质量分数98.7%,成都曼斯特生物科技有限公司;大豆磷脂,型号PC98T,批号20191125,上海辅必成生物科技公司;四氢呋喃,色谱纯,批号59162526,Merck公司。
SD大鼠,清洁级,购自河南省动物实验中心,许可证编号:SCXK-2016-0001,实验室饲养至体质量为(220±20)g,进行药动学实验前禁食12 h,自由饮水。所有动物实验遵循河南省胸科医院有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 HPLC法测定THP含量
2.1.1 对照品溶液的制备 称取THP对照品20 mg置于50 mL量瓶中,加入甲醇超声溶解并定容,即得THP对照品储备液(400 µg/mL)。
2.1.2 供试品溶液的制备 取THP、THP-PC、THP- PC-SD、THP-PC-OP及THP-PC-NPs粉末适量(THP含有量均约为5 mg),置于100 mL量瓶中,加入50 mL甲醇超声溶解,放置至室温后甲醇定容,过0.45 μm微孔滤膜,精密量取1 mL置10 mL量瓶中,流动相定容即得供试品溶液。
2.1.3 色谱条件 色谱柱为Waters-C18柱(250 mm×4.6 mm,5 µm);柱温为30 ℃;流动相为甲醇-0.3%醋酸水溶液(45∶55);检测波长为281 nm;体积流量为1.0 mL/min;进样量10 µL。取磷脂、PVP K30等辅料制备空白辅料样品,另取THP-PC、THP-PC-SD、THP-PC-OP及THP-PC-NPs进样,色谱图见图1,制剂中辅料不干扰THP含量测定,理论塔板数不低于6500。
2.1.4 线性关系考察 取THP对照品适量,采用流动相配制成20、10、1、0.5、0.1、0.05 µg/mL的THP对照品溶液,分别进样。以THP质量浓度()与峰面积()作线性回归得方程=24.155 2-0.746 9,=0.999 7,结果表明THP在0.05~20 µg/mL线性关系良好。
2.1.5 精密度考察 取各样品的供试品溶液,分别连续进样6次,计算THP峰面积的RSD。结果显示,THP-PC、THP-PC-SD、THP-PC-OP、THP-PC- NPs中的THP峰面积的RSD分别为0.46%、0.92%、0.73%、0.58%,所以精密度良好。
2.1.6 稳定性考察 取各样品的供试品溶液,分别于0、3、6、9、12、18、24 h进样,HPLC测定。结果显示,THP-PC、THP-PC-SD、THP-PC-OP、THP-PC-NPs中的THP峰面积的RSD分别为1.43%、0.90%、1.13%、1.29%,结果表明各供试品溶液在24 h内稳定性良好。
2.1.7 重复性考察 取各个样品,分别平行制备6份供试品溶液,HPLC测定。结果显示,THP-PC、THP-PC-SD、THP-PC-OP、THP-PC-NPs中的THP峰面积的RSD分别为1.15%、1.39%、1.64%、1.87%,结果表明该方法重复性良好。
2.1.8 加样回收率考察 取各个样品适量(THP含有量均约为2.5 mg),分别置于9个100 mL量瓶中,分为低、中、高3组,加入样品中THP含量50%、100%、150%的THP对照品溶液,加入50 mL甲醇超声溶解,过0.45 μm微孔滤膜,精密量取1 mL置10 mL量瓶中,流动相定容。THP-PC、THP-PC- SD、THP-PC-OP及THP-PC-NPs同法操作,分别进样测定THP含量并计算加样回收率。结果显示,THP- PC、THP-PC-SD、THP-PC-OP、THP-PC-NPs的平均回收率在分别为99.04%、99.97%、100.89%、101.53%,RSD分别为1.74%、0.85%、1.18%、1.60%,结果表明本实验回收率较高。
2.2 复合率的测定
取70 mg的THP和适量磷脂置于三角烧瓶中,加入四氢呋喃40 mL的混悬液,于一定温度的水浴中磁力搅拌一定时间至澄清。45 ℃减压旋蒸10 min除去有机溶剂,即得THP-PC,该复合物为褐黄色黏稠状物质。THP不溶于石油醚,但THP-PC在石油醚中易溶。称取THP(0)制备THP-PC,加入石油醚超声20 s溶解,过0.22 μm的微孔滤膜除去游离的THP,减压旋蒸除去石油醚,加入甲醇超声20 s溶解,进样测定参加复合的THP的量(1)。计算THP与磷脂的复合率。
复合率=1/0
2.3 Box-Behnken响应面法优化THP-PC处方工艺
2.3.1 试验设计及结果 采用THP与磷脂的复合率()作为THP-PC的优化指标。前期单因素考察结果显示,当固定THP用量为70 mg时,磷脂用量(1)、制备温度(2)和制备时间(3)对THP-PC的复合率影响较大,采用Box-Behnken响应面法对磷脂用量范围为100~200 mg,制备温度为25~65 ℃,制备时间为3~6 h进行优化,各因素水平见表1。根据不同试验组合制备不同处方工艺下的THP-PC,并分别测定复合率,结果见表1。
2.3.2 二次多元回归模型的建立及显著性分析 对Box-Behnken响应面法的因变量(1、2、3)和自变量()的数据拟合,得包封率二次多元回归方程为=98.18+8.081+11.042-1.193+2.1312-1.4813-0.3523-9.3712-16.3922-0.0932,模型值<0.000 1,决定系数2=0.999 4,校正系数adj2=0.998 7,失拟度= 0.205 8>0.05,说明测得的复合率与拟合值吻合度高,未知因素对模型干扰很小,因此建立的数学模型可信度较高,可用于THP-PC处方工艺研究。方程中1、2系数绝对值相对较大,影响程度明显高于3。方差分析结果见表2,1、2、3、12、13、12和22等均具极显著差异(<0.01)。
2.3.3 效应面结果、预测及验证 三维曲面图见图2,当制备时间不变时,随着制备温度的延长或磷脂用量的增大,复合率均先增大后下降;固定制备温度不变时,随着磷脂用量的增加复合率先增加后略下降,其影响程度远大于制备时间对复合率的影响;固定磷脂用量不变时,随着制备温度的增加复合率先增加后下降,其影响程度同样远大于制备时间对复合率的影响。设置复合率最小值为55.9%,最大值为100%,得最佳处方工艺为磷脂用量1=160.09 mg,制备温度2=48.47 ℃,搅拌时间3=3.57 h,预测复合率为101.85%。为便于操作,THP-PC最佳处方调整为1=160 mg,2=48.5 ℃,3=3.5 h。按此处方工艺,平行制备3份THP-PC,测得复合率分别为99.52%、99.71%和99.38%,复合率基本接近100%。
表1 Box-Behnken试验设计因素水平及结果(n = 3)
Table 1 Factor levels and results for Box-Behnken experimental design(n = 3)
试验号X1/mgX2/℃X3/hY/%试验号X1/mgX2/℃X3/hY/%试验号X1/mgX2/℃X3/hY/% 1150 (0)45 (0)4.5 (0)98.77150454.598.213200654.593.2 215025 (−1)3 (−1)71.3815065394.314200254.567.1 3150256 (+1)69.8910045380.11515065691.4 4100 (−1)65 (+1)4.573.510150454.597.916150454.597.7 5200 (+1)45694.41110045680.517150454.598.4 620045399.912100254.555.9
表2 方差分析
Table 2 Analysis variance
来源平方和自由度均方F值P值来源平方和自由度均方F值P值 模型3 117.339346.371 369.44<0.000 1X12369.281369.281 460.00<0.000 1 X1521.641521.642 062.42<0.000 1X22131.081131.084 471.94<0.000 1 X2974.611974.613 853.31<0.000 1X320.03410.0340.130.724 3 X311.28111.2844.600.000 3残差1.7770.25 X1X218.06118.0671.41<0.000 1失拟项1.1430.382.430.205 8 X1X38.7018.7034.410.000 6纯偏差0.6340.16 X2X30.4910.491.940.206 6总离差3 119.1016
2.4 HTP-PC晶型分析
X射线粉末衍射法(XRPD)对THP-PC进行晶型分析。速度为8°/min,扫描范围(2)为3°~45°,Cu-Kα靶。取THP原料药、磷脂、THP-PC及物理混合物(比例THP-PC,仅作简单混合)适量置于玻璃槽中,玻璃片压制平整,置于X射线粉末衍射仪进行扫描,见图3。THP在6.3°、7.4°、10.9°、11.5°、12.1°、16.9°、18.0°、18.7°、20.2°、20.9°、24.1°、25.3°、29.7°及42.7°等处出现众多特征晶型峰,是一种晶型物质。在物理混合物中仍见THP的特征晶型峰,强度有所下降,但各峰的位置未发生任何变化,说明简单混合未改变THP的存在状态。但在THP-PC的XRPD图谱中,未见THP的晶型峰,说明存在形式发生了改变,转变成无定型物质,证明了THP-PC制备成功。
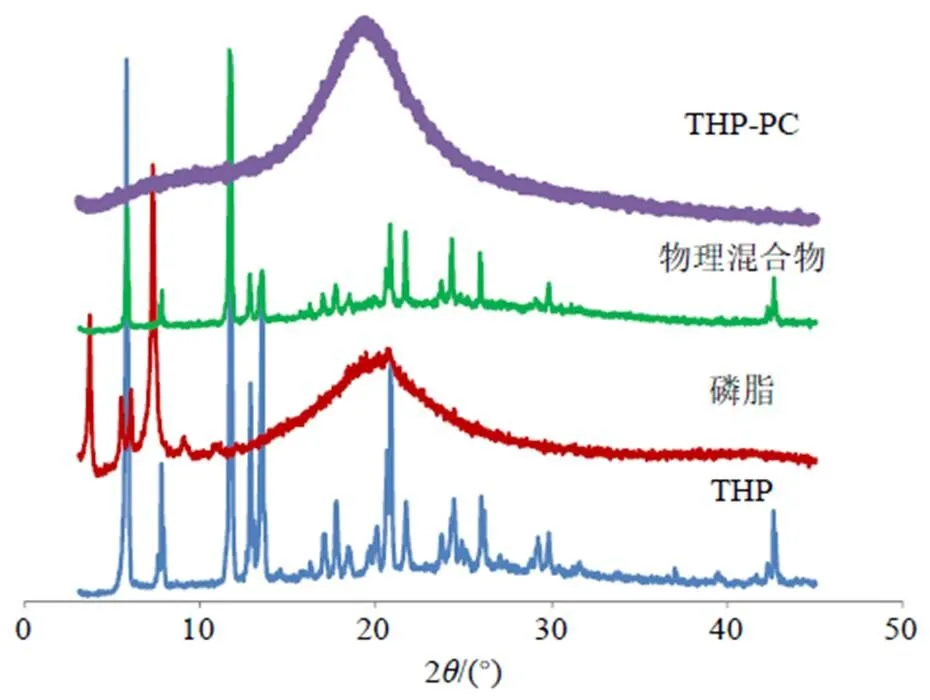
图3 THP-PC的XRPD结果
2.5 表观油水分配系数(P)的测定
分别配制pH 1.0、pH 2.5、pH 3.6、pH 4.5、pH 5.8、pH 6.8、pH 7.4、pH 8.0的水相溶液,加入正辛醇进行饱和。分别取过量THP、物理混合物(比例同THP-PC)和THP-PC加入到饱和后的不同pH值的水溶液中,于37 ℃振荡器中震荡3 d,取上层混悬液,过0.45 μm微孔滤膜,取续滤液进样测定浓度1。精密量取1 mL置于玻璃离心管中,平行8份,分别加入经不同pH值的水溶液饱和过的正辛醇5 mL,于37 ℃振荡器中震荡3 d。取下层水相过0.45 μm微孔滤膜,测得浓度2。计算,= (1-2)/2,并计算lg。结果见图4。THP在不同pH值中的lg变化较大,在酸性条件下水溶性较大,但在碱性条件下脂溶性较强,水溶性或脂溶性过大均不利于药物透膜吸收[12]。制备成THP-PC后有效调节了THP的表观油水分配系数,利于药物胃肠道吸收。而物理混合物对THP油水分配系数有一定影响,但无显著性意义。
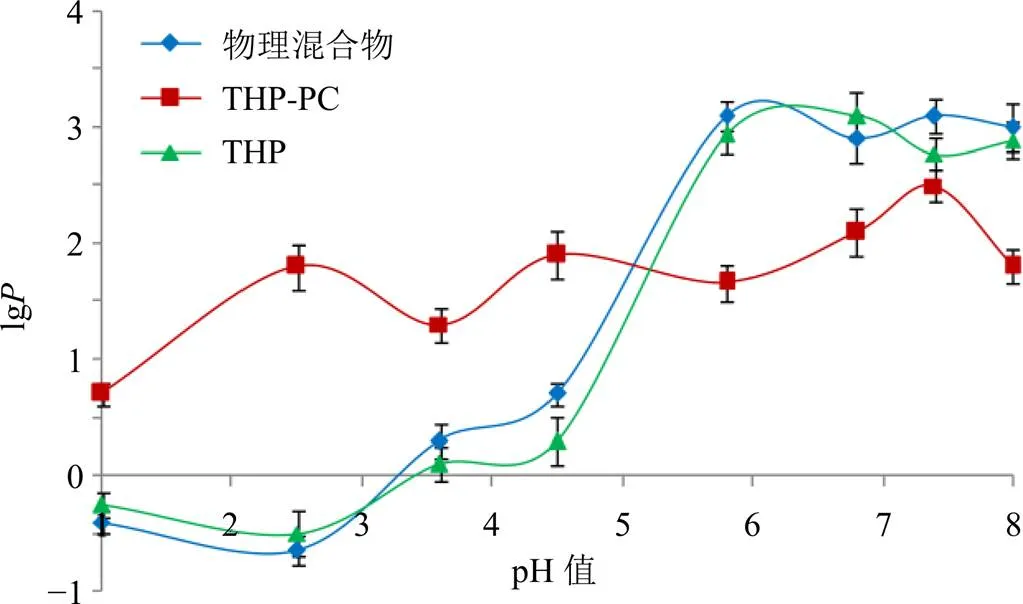
图4 表观油水分配系数结果(n = 3)
2.6 THP-PC-SD的制备及表征
磷脂复合物热稳定性不好,因此,不适合采用熔融法制备成固体分散体,故采用溶剂法将THP-PC制备成THP-PC-SD。按照质量比1∶6,分别取THP-PC和PVP K30,置于无水乙醇中,45 ℃条件下磁力搅拌3 h至溶液澄清,45 ℃下减压旋蒸除去有机溶剂,即得THP-PC-SD粉末。
2.6.1 晶型分析 取适量THP、PVP K30、物理混合物(THP、磷脂和PVP K30比例同THP-PC-SD,仅作简单混合)和THP-PC-SD,按照“2.4”项下条件进行XRPD扫描,结果见图5,在物理混合物中仍可见THP原料药在10.9°、11.5°、12.1°、16.9°、18.0°、20.2°、20.9°、24.1°、25.3°、29.7°及42.7°等处衍射峰,虽其强度下降,但各峰的位置并未发生变化,可能是由于处方中PVP K30用量较大,对衍射峰起到了掩蔽作用所致[15]。但在THP-PC-SD中THP的衍射峰全部消失,说明将THP-PC制备成THP-PC-SD后,THP仍是以无定形状态存在,同时也证明THP-PC-SD制备成功。
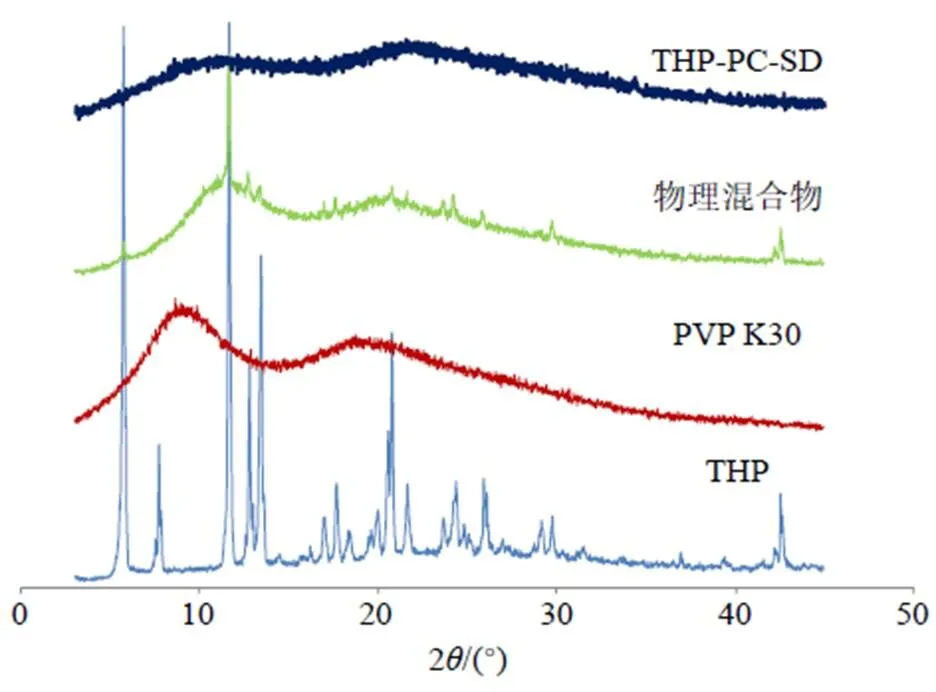
图5 THP-PC-SD的XRPD结果
2.6.2 SEM分析 THP、物理混合物(THP、磷脂和PVP K30比例同THP-PC-SD,仅作简单混合)和THP-PC-SD适量,加入无水乙醇进行分散,取2~3 d至导电胶上,烘干后喷金2 min,置于SEM下观察,结果见图6。THP原料药为柱状形态,在物理混合物中可观察到原料药附着在辅料上,存在状态并未发生改变。但在THP-PC-SD中原料药的柱状形态消失,说明其存在状态发生变化,与XRPD研究结果一致。

图6 THP (A)、物理混合物(B)和THP-PC-SD (C) 的SEM图
2.7 THP-PC-NPs及其冻干粉的制备及表征
2.7.1 THP-PC-NPs及其冻干粉的制备 高压均质法制备THP-PC-NPs。取80 mg的PVP K30溶解于100 mL蒸馏水中(温度为45 ℃),另取40 mg的THP-PC超声分散于3 mL无水乙醇,水相与有机相合并后减压旋转蒸发10 min(温度为45 ℃)。混悬液于均质压力为40 MPa条件下循环均质5次,于80 MPa条件下循环均质8次,继续于100 MPa条件下循环均质8次,即得THP-PC-NPs混悬液。加入5%甘露醇,混匀,分成若干份,于−40 ℃超低温冰箱预冻1 d,迅速置于冷冻干燥机中进行冻干,即得THP-PC-NPs冻干粉。
2.7.2 粒径和ζ电位的测定 取适量THP-PC-NPs混悬液,蒸馏水稀释50倍,置于粒度仪中测得其ζ电位为(−31.26±1.93)mV,见图7;平均粒径为(184.57±10.41)nm,见图8。取适量THP-PC-NPs冻干粉蒸馏水复溶,测得平均粒径增长至(242.90±15.63)nm,ζ电位为(−28.05±1.69)mV。
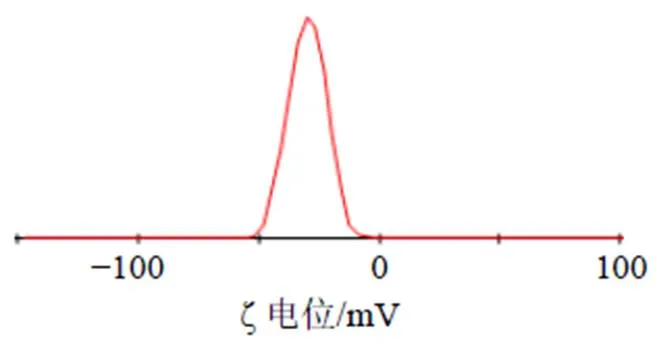
图7 THP-PC-NPs的ζ电位
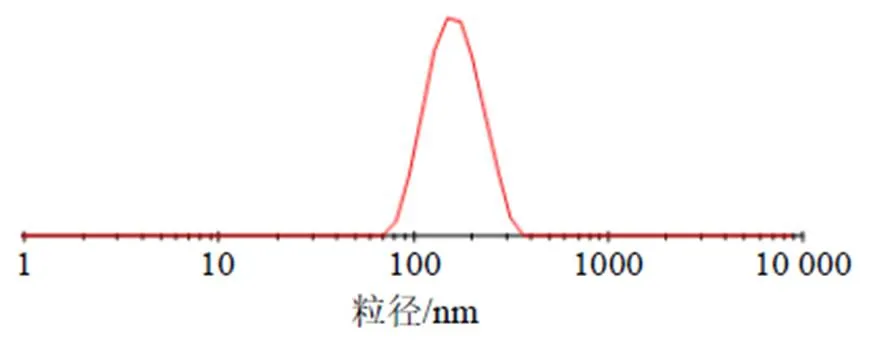
图8 THP-PC-NPs粒径分布
2.7.3 SEM观察 取THP-PC-NPs混悬液100 μL,加入蒸馏水3 mL混匀,取2~3 d滴加至导电胶上,自然晾干并喷金2 min,置于SEM下观察其微观形态,结果见图9,THP-PC-NPs呈类球形。

图9 THP-PC-NPs的SEM图
2.8 THP-PC-OP的制备
中链三酰甘油具有良好的安全性和可耐受性,广泛应用于食品及医药领域,且磷脂复合物在中链三酰甘油溶解度良好,因此,本研究采用中链三酰甘油制备THP-PC-OP。过程为取100 mg的THP- PC,超声溶于10 mL中链三酰甘油,即得THP-PC油制剂。
2.9 溶出度测定方法
取THP、THP-PC、THP-PC-SD和THP-PC-NPs冻干粉适量,使THP含量均为30 mg,采用蒸馏水制备混悬液,置于透析袋中,各样品均平行制备6份。溶出介质为900 mL蒸馏水,温度和转速分别为37 ℃和100 r/min,于0、0.25、0.5、1、2、3、4、6、8、10、12、18、24 h取样3 mL,立即补进蒸馏水3 mL。各样品经0.22 μm微孔滤膜滤过,进HPLC测定THP质量浓度,计算各时间点累积溶出率,结果见图10。THP原料药24 h累积释放率为49.18%,THP-PC在各个时间点累积释放率均高于THP原料药,24 h累积释放率为69.47%,有一定的促溶出作用。将THP-PC制备成THP-PC-SD后溶出速率明显增大,8 h的累积溶出率达到96.02%。而THP-PC-NPs在 4 h累积溶出率达到95.67%,基本释放完毕。THP-PC-OP是一种溶液制剂,故不再考察体外溶出情况。
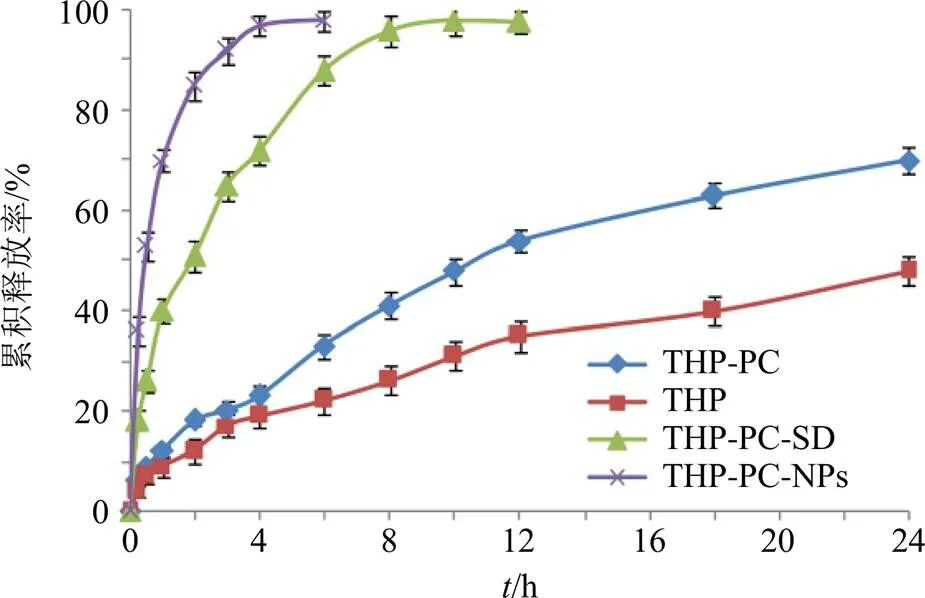
图10 不同样品的溶出曲线(, n = 6)
2.10 口服药动学比较
2.10.1 试验方案 取THP、THP-PC、THP-PC-SD、THP-PC-NPs粉末适量,加入适量0.5% CMC-Na溶液配制灌胃液,THP-PC-OP可直接灌胃给药。取SD大鼠30只,随机均分为5组,禁食12 h但可自由饮水,按大鼠体质量进行ig给药(30 mg/kg)。分别在0、0.25、0.5、0.75、1、2、3、4、6、8、10、12 h眼眶后静脉丛取血约0.3 mL,毛细玻璃管引流至肝素化的离心管中,立即于3000 r/min离心3min,分取血浆密封,−15 ℃冰箱中冷冻保存。
2.10.2 血浆样品处理过程[23]取白屈菜红碱适量,采用甲醇配制成600 ng/mL,作为内标溶液。吸取血浆样品100 μL,加入内标溶液50 μL和1 mL乙腈(含体积分数为0.05%甲酸),密封,涡旋2 min,于5000 r/min离心8 min,取有机相,40 ℃氮气吹干得残渣,加入100 μL甲醇涡旋30 s复溶,于5000 r/min离心5 min,进样测定。
2.10.3 血浆对照品标准曲线 取2.0 μg/mL的THP对照品溶液,甲醇稀释配制成质量浓度分别为1000、500、250、100、20 ng/mL,分别取100 μL,加入白屈菜红碱内标溶液50 μL,40 ℃氮气流缓慢吹干得残渣,分别加入空白血浆100 μL,涡旋混匀,即得THP血浆对照品溶液。按照“2.10.2”项下操作,进样测定。以THP质量浓度()为横坐标,THP与白屈菜红碱峰面积比()为纵坐标,得方程=0.042 6-2.450 1,=0.992 6,所以线性范围为20~2 000 ng/mL。
2.10.4 方法学考察 取空白血浆、血浆对照品和血浆样品进样,结果见图11,血浆内源性杂质不干扰THP及内标测定,因此专属性较高。取20、500、2000 ng/mL的血浆对照品溶液,连续进样6次,分别计算得THP与内标峰面积比值的RSD分别为9.97%、6.31%、9.17%,因此日内精密度良好。分别连续测定6 d,每天测定1次,分别计算得THP与内标峰面积比值的RSD分别为10.88%、7.18%、9.96%,因此日间精密度良好。取THP原料药ig给药1 h的血浆样品,分别于0、3、6、12、18、24 h进样测定THP与内标峰面积比值,计算得比值的RSD为6.49%,说明血浆样品稳定性良好。取20、500、2000 ng/mL的血浆对照品,进HPLC测定两者峰面积,计算峰面积比值,带入血浆对照品标准曲线方程计算测得浓度,并与配制质率浓度比较,计算得平均回收率为94.06%(=9),RSD值为7.93%,可见准确度较高。因此建立的色谱方法及血浆处理过程可用于血浆样品中THP的含量测定。
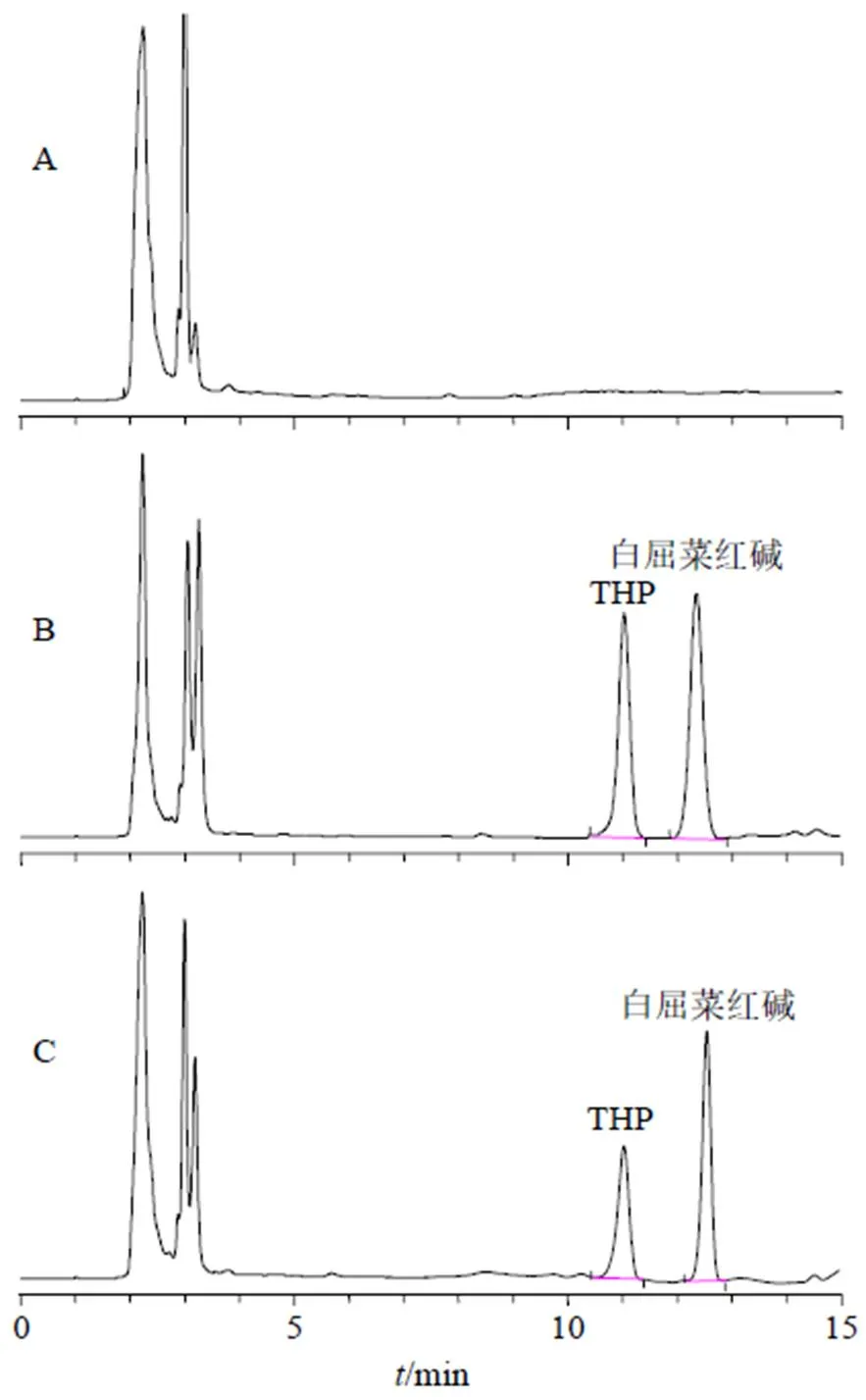
图11 空白血浆(A)、血浆对照品溶液(B) 和血浆样品(C) 的HPLC图
2.10.5 药动学结果 分别测定THP、THP-PC、THP-PC-SD、THP-PC-OP和THP-PC-NPs在各个时间点的血药浓度,药-时曲线见图12。DAS 2.0软件包拟合各组样品药动学数据,主要药动学参数结果见表3。THP-PC的max与THP原料药相比无统计学意义,但1/2、max、AUC0~t和AUC0~∞等参数有显著性改变,相对生物利用度提高至1.70倍,在一定程度上促进了THP体内吸收。THP-PC-SD、THP-PC-NPs和THP-PC-OP的max、max、AUC0~t和AUC0~∞与THP或THP-PC相比均有显著性或极显著性差异(<0.05、0.01),药动学行为发生了较大变化。与THP原料药相比,THP-PC-SD、THP-PC-NPs和THP-PC-OP相对生物利用度分别提高至4.11、4.86、4.22倍,其中THP-PC-NPs提升幅度相对最大。
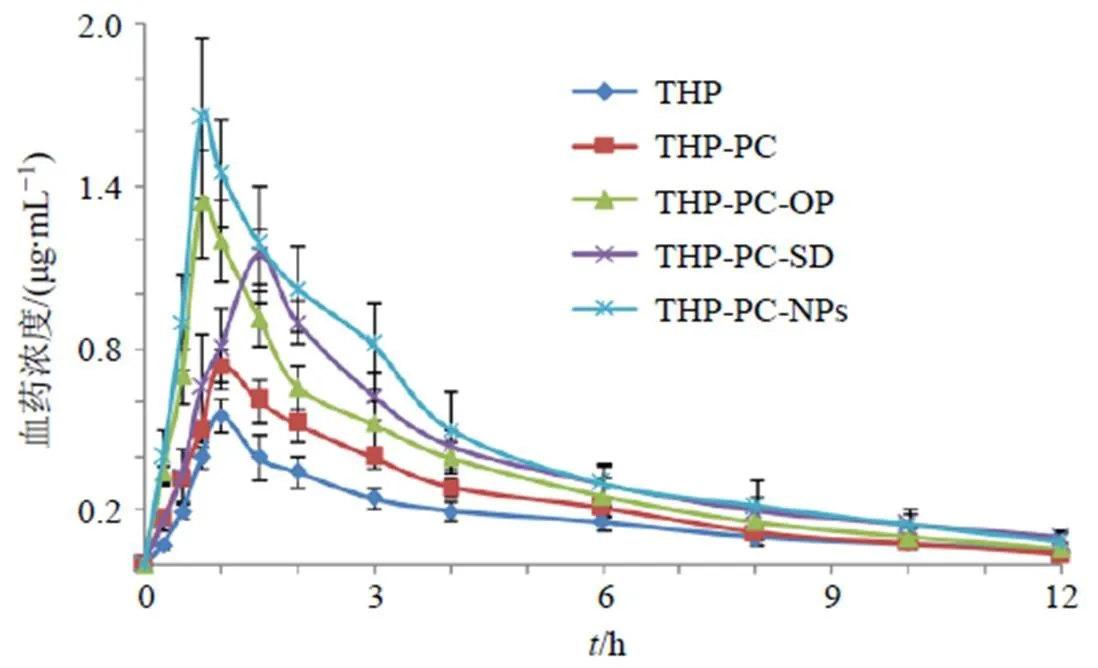
图12 药-时曲线(,n = 6)
表3 主要药动学参数(,n = 6)
Table 3 Main pharmacokinetic parameters (, n = 6)
参数单位THP原料药THP-PCTHP-PC-SDTHP-PC-NPsTHP-PC-OP tmaxh1.06±0.311.11±0.280.74±0.21*#0.70±0.23*#1.56±0.36*# t1/2h2.61±0.543.72±0.69*3.34±0.57*3.96±0.61**4.44±0.68**# Cmaxng∙mL−1557.64±61.24741.76±92.32**1 388.05±148.67**##1 704.33±253.64**##1 147.16±148.98**## AUC0~tng∙h∙mL−11 568.23±148.612 674.93±282.70**6 447.18±627.96**##7 629.81±721.16**##6 615.04±589.03**## AUC0~∞ng∙h∙mL−11 624.17±159.082 812.62±301.56**6 591.43±681.42**##7 728.64±772.08**##6 756.08±703.58**##
与THP比较:*<0.05**<0.01;与THP-PC比较:#<0.05##<0.01
*< 0.05**< 0.01THP;#< 0.05##< 0.01THP-PC
3 讨论
前期分别考察了制备溶剂(醋酸乙酯、乙醇、丙酮、四氢呋喃等)、制备温度(20~70 ℃)、磷脂用量(100~300 mg)、制备时间(2~6 h)等对THP-PC复合率的影响,发现采用四氢呋喃作为制备溶剂时复合率最高,可能是由于四氢呋喃是一种非质子溶剂,对THP及磷脂有较高的溶解度,有利于THP-PC的形成。
据文献报道[12],质子溶剂(如乙醇)会对药物与磷脂的亲电基团与供电基团之间的电子传递产生影响,因而会干扰磷脂复合物的形成,影响复合率。磷脂容易被氧化,制备温度过高或制备时间过长时均会影响磷脂的稳定性,进而也会影响复合率。药物与磷脂分子一般是按照物质的量比1∶1结合在一起,磷脂用量不足时,复合率较低,但磷脂用量过大时造成材料浪费,故需要对磷脂用量进行优化。因此,选择磷脂用量、制备温度和制备时间为主要影响因素,采用Box-Behnken响应面法优化了THP-PC处方工艺,复合率接近100%。计算结果显示,THP与磷脂的物质的量比为1∶1.04。XRPD研究显示,THP在THP-PC以无定型状态存在,利于提高体溶出度及生物利用度[24]。
THP-PC是一种黏性物质,给药不便,故本研究进一步将其制备成THP-PC-SD、THP-PC-OP及THP-PC-NPs冻干粉。体外溶出结果显示,THP-PC体外溶出较为缓慢,但THP-PC-SD和THP-PC-NPs极大促进了THP体外溶出,且给药便捷性大大提高。
口服后,THP-PC的生物利用度提高至1.70倍,可能是由于THP的溶出度得到一定程度提高、降低了胃肠道对药物代谢作用[25]、调节了油水分配系数、促进胃肠道吸收等[25-26]作用所致。但磷脂复合物黏性较大,促溶出作用有限,且部分磷脂复合物在水相环境中可能发生解离[15],因而生物利用度提高幅度受限。制备成THP-PC-SD后生物利用度提高至4.11倍,可能是由于制备成THP-PC-SD后THP仍以无定型状态存在、THP-PC的亲水性及分散性得到极大改善、加快体外溶出速率、提高了累积溶出度等[27]。THP-PC-NPs进一步把生物利用度提高至4.86倍,可能是由于THP-PC-NPs充分融合了PC和NPs制剂新技术的优势[22],增强了THP的透膜吸收能力、增加了药物与胃肠道的接触面、延长了胃肠道滞留时间、发挥纳米制剂特殊吸收机制 等[18,21],从而实现高效吸收。THP-PC-OP生物利用度提高至4.22倍,可能是由于磷脂复合物在水中容易发生解离,析出原形药物,失去促吸收作用,当以油制剂形式给药后使THP-PC与水相隔离,增加了THP-PC稳定性;THP-PC-OP口服后在胃肠道蠕动作用下可能会形成微乳、胶束等[28-30],从而使生物利用度远高于THP-PC。因此,THP-PC-SD、THP-PC-NPs和THP-PC-OP均可进一步促进THP-PC口服吸收,本研究为THP制剂研发提供了有价值的参考资料。
利益冲突 所有作者均声明不存在利益冲突
[1] 董庆海, 吴福林, 王涵, 等. 延胡索药学研究进展 [J]. 中国野生植物资源, 2019, 38(1): 48-53.
[2] 唐逸丰. 延胡索化学成分与药理作用研究概况 [J]. 中医临床研究, 2018, 10(23): 144-146.
[3] 王安铸, 马晓昌. 延胡索乙素的研究进展 [J]. 中华中医药杂志, 2020, 35(4): 1927-1929.
[4] 于定荣, 翁小刚, 王本晓, 等. 延胡索、白芷炮制配伍对元胡止痛方中延胡索乙素、欧前胡素含量以及镇痛作用的影响 [J]. 中草药, 2021, 52(8): 2306-2312.
[5] 吴芸, 陈志鹏, 肖璐, 等. 延胡索乙素平衡溶解度及表观油水分配系数的测定 [J]. 南京中医药大学学报, 2012, 28(2): 178-180.
[6] Tung N T, Tran C S, Pham T M,. Development of solidified self-microemulsifying drug delivery systems containing l-tetrahydropalmatine: Design of experiment approach and bioavailability comparison [J]., 2018, 537(1/2): 9-21.
[7] 费雅蓉, 徐畅, 周丹婷, 等. 延胡索乙素醇质体的制备及其离体皮肤渗透特性研究 [J]. 中草药, 2019, 50(5): 1088-1094.
[8] 刘雪赟. 延胡索乙素大鼠体内药动学研究 [J]. 南京中医药大学学报, 2012, 28(6): 555-557.
[9] 李阳杰, 周敬. 延胡索乙素纳米结构脂质载体的制备及其药动学行为 [J]. 中成药, 2019, 41(12): 2990-2993.
[10] 刘建明, 王芳, 叶颍俊, 等. 延胡索乙素多囊脂质体的制备及其大鼠体内药代动力学分析 [J]. 中国实验方剂学杂志, 2014, 20(19): 124-127.
[11] Zhao Y Q, Wang L P, Ma C,. Preparation and characterization of tetrandrine-phospholipid complex loaded lipid nanocapsules as potential oral carriers [J]., 2013, 8: 4169-4181.
[12] 李强强, 王凯, 薛晓锋, 等. 黄酮类化合物磷脂复合物的制备与功能活性研究进展 [J]. 中国现代应用药学, 2018, 35(1): 132-137.
[13] 黄珊, 翟秉涛, 杨洁, 等. 根皮素磷脂复合物的制备、表征及体内外溶出行为评价 [J]. 中草药, 2021, 52(18): 5543-5551.
[14] 宋婷, 宋丹, 管海燕, 等. 松萝酸磷脂复合物在大鼠体内的药动学及组织分布研究 [J]. 中草药, 2018, 49(6): 1358-1364.
[15] 张留超, 刘勇华. 鞣花酸磷脂复合物的制备及其口服生物利用度研究 [J]. 中成药, 2021, 43(7): 1685-1690.
[16] 陈晓敏, 曹伶俐, 崔伟峰. 鼠李素磷脂复合物的处方工艺优化、表征及体外溶出度考察 [J]. 中国医院药学杂志, 2022, 42(4): 399-403.
[17] 邓向涛, 郝海军, 陈晓峰, 等. 木犀草素2种固体分散体制备、表征和大鼠体内药动学行为研究 [J]. 中草药, 2018, 49(24): 5787-5793.
[18] 刘会珍, 董丹丹, 范明松. 不同厚朴酚制剂的制备、表征及其在SD大鼠体内药动学行为比较 [J]. 中草药, 2020, 51(17): 4442-4448.
[19] 庞榕, 李开言, 王聪颖. 白杨素磷脂复合物固体分散体的制备及其体内药动学研究 [J]. 中成药, 2021, 43(10): 2611-2615.
[20] 孟令玮, 王玉丽, 高春生, 等. 基于药物-磷脂复合物的纳米释药系统研究进展 [J]. 国际药学研究杂志, 2017, 44(1): 40-46.
[21] Khosh manzar M, Mohammadi M, Hamishehkar H,. Nanophytosome as a promising carrier for improving cumin essential oil properties [J]., 2021, 42: 101079.
[22] Chi C, Zhang C S, Liu Y,. Phytosome- nanosuspensions for silybin-phospholipid complex with increased bioavailability and hepatoprotection efficacy [J]., 2020, 144: 105212.
[23] 赵宏兴, 王鑫, 刘有平, 等. LC-MS/MS法研究加味左金丸在大鼠体内的药动学 [J]. 沈阳药科大学学报, 2021, 38(7): 668-674.
[24] 施秦, 蔡挺. 无定形态药物结晶行为的研究进展 [J]. 中国药科大学学报, 2017, 48(6): 654-662.
[25] Li F, Yang X L, Yang Y N,. Phospholipid complex as an approach for bioavailability enhancement of echinacoside [J]., 2015, 41(11): 1777-1784.
[26] Wang W P, Zhang W S, Jiang Y X,. Preparation of ursolic acid-phospholipid complex by solvent-assisted grinding method to improve dissolution and oral bioavailability [J]., 2020, 25(1): 68-75.
[27] 张铁山, 尚曙玉, 王聪颖, 等. 2种斯皮诺素固体分散体的制备及其体内药动学行为 [J]. 中成药, 2019, 41(9): 2025-2029.
[28] 王震芳, 张智强, 葛振华. 蛇床子素3种制剂的制备、表征及药动学比较研究 [J]. 中草药, 2019, 50(15): 3615-3621.
[29] 尚曙玉, 张铁山, 郝海军, 等. 冬凌草甲素磷脂复合物不同制剂在SD大鼠体内生物利用度的比较 [J]. 中药材, 2019, 42(4): 871-874.
[30] 郜娜, 范明松, 杨庆宇, 等. 二氢杨梅素磷脂复合物纳米结构脂质载体的制备、表征及药动学研究 [J]. 中草药, 2019, 50(17): 4060-4067.
Preparation and pharmacokinetics of tetrahydropalmatine phospholipid complex, and its solid dispersion, oil preparation and nanosuspension
LI Jun-xia1, CAO Ya-rui1, WANG Jin-tao2, FANG Xiao-dong3
1. Henan Provincial Chest Hospital, Zhengzhou 450000, China 2. School of Materials, Zhengzhou University, Zhengzhou 450000, China 3. School of Pharmacy, Henan University, Zhengzhou 475001, China
To prepare tetrahydropalmatine phospholipids complex (THP-PC), THP-PC solid dispersion (THP-PC-SD), THP-PC oil preparation (THP-PC-OP), and tetrahydropalmatine phospholipids complex nanosuspensions (THP-PC-NPs), and then compare their pharmacokinetics behavior in SD rats.THP-PC and THP-PC-SD were prepared by solvent volatilization. X-ray power diffraction (XRPD) was employed to study the presence of THP. THP-PC-NPs were prepared by high pressure homogenization method, particle size and ζ potential were also determined. Dissolutionof THP-PC, THP-PC-SD and THP-PC-NPs were compared to THP suspension. SD rats in each group were administered intragastrically with THP, THP-PC, THP-PC-SD, THP-PC-OP and THP-PC-NPs, respectively. Plasma concentration of THP was determined by HPLC, and the main pharmacokinetic parameters were calculated.The results of XRPD indicated that THP was changed into an amorphous state in THP-PC and THP-PC-SD. Particle size and ζ potential of THP-PC-NPs were (184.57 ± 10.41) nm and (−31.26 ± 1.93) mV, respectively. The dissolution of THP was improved by THP-PC, THP-PC-SD and THP-PC-NPs in different degrees. Compared with raw medicine, relative bioavailability of THP-PC was increased to 1.70 times. The relative bioavailability of THP-PC-SD, THP-PC-OP and THP-PC-NPs were enhanced to 4.11, 4.86 and 4.22 times, respectively.THP-PC-SD, THP-PC-OP and THP-PC-NPs could enhance the oral bioavailability of THP-PC in further.
tetrahydropalmatine; phospholipids complex; solid dispersion; oil preparation; nanosuspensions; dissolution rate; bioavailability; pharmacokinetics; solvent volatilization; X-ray power diffraction; high pressure homogenization
R283.6
A
0253 - 2670(2022)14 - 4307 - 10
10.7501/j.issn.0253-2670.2022.14.010
2022-01-25
2018年度河南省科技攻关计划项目(2018020561)
李君霞(1975—),本科,副主任药师,研究方向为医院临床药学。Tel: (0371)65662768 E-mail: lijunxia_henan@126.com
王金涛(1969—),博士,副研究员,研究方向为中药新型给药系统。Tel: (0371)67766820 E-mail: jtwangphd@163.com
[责任编辑 郑礼胜]
