HMGB1下调的作用:通过抑制神经元细胞自噬和凋亡减轻大鼠脑出血后的神经元损伤
2022-07-18苗树船杨中鑫李宗喜范英俊黄可阳黄庆喜
脑出血为神经外科急症,其特点是高死亡率和高发病率。虽然近年来在脑出血的诊断和外科手术治疗等方面取得了很大的进步,但是其预后仍较差,其致死率在过去的20年里没有明显降低。因此,了解脑出血的潜在作用机制和识别新的治疗靶点来提高脑出血患者生存率刻不容缓。脑出血后的脑损伤机制与神经炎症反应、细胞凋亡激活和氧化应激密切有关,这些会导致不可逆的神经元死亡。近年来,对脑出血模型的研究表明,自噬途径在脑出血后损伤中也起着重要作用,自噬的调节可能成为脑出血治疗的新靶点。高迁移率族蛋白1(HMGB1)是损伤相关分子模式的一部分,其广泛表达于大多数真核细胞,包括神经细胞。研究表明,HMGB1与细胞自噬、凋亡有关。缺血肝研究证实,抑制HMGBI释放可同时抑制细胞凋亡和自噬。HMGB1也能通过与Beclin 1相互作用以增强自噬,导致急性胰腺炎恶化。然而,HMGB1与脑出血后神经元自噬和凋亡相关的机制目前仍没有相关报道。本研究探讨了HMGB1对脑出血大鼠纹状体神经元细胞自噬和凋亡的作用机制。
开展示范区及周边的农作物病虫监测与统一防治、土壤环境监测工作,制定合理使用农药、化肥制度,加强技术指导和培训。
1 材料和方法
1.1 动物
SPF级Wistar大鼠(四川成都达硕生物有限公司),20 只,体质量250~300 g,动物许可证号SYXK(川)2019-189。所有实验程序均经伦理委员会批准,并参照《实验动物护理和使用指南》执行。
1.2 试剂与仪器
RIPA 裂解缓冲液、Bradford 蛋白浓度测定试剂盒、胶原酶Ⅳ、RapidStep™ECL 试剂(中国成都里来生物科技有限公司);Anti-Beclin 1 antibody(1∶1000)、Anti-Bcl-2 antibody(中国成都睿琪生物科技有限公司,1∶1000);Anti-HMGB1 antibody(1∶2000)、Anti-Bax antibody(1∶2000)、Anti-Cleaved Caspase-3 antibody(中国成都旭海润东生物科技有限公司,1∶5000);Anti-LC3-I/II Antibody(1∶1000)、HMGB1酶联免疫ELISA试剂盒(中国成都妍恩生物科技有限公司)。
1.3 方法
1.3.1 造模 根据文献[12],建立胶原酶Ⅳ诱导的脑出血大鼠模型。用1%戊巴比妥钠(60 mg/kg)腹腔注射麻醉大鼠,将其置于俯卧位,固定头部。根据无菌操作的原理,沿经度切开皮肤,露出颅骨,钝性剥离骨膜,暴露前囟,选择前囟前0.2 mm,矢状缝右3.0 mm,颅骨下纹状体处6.0 mm为注射点。用牙科钻穿透该部位的颅骨,30号针头顺着颅骨孔进入纹状体部位约6 mm,将0.2 U/mL胶原酶Ⅳ用微量注射泵以0.5 μL/min的速度给药,注射时间为4 min,注射完毕后,留针2 min防止药物沿针道逆流,退针后用骨蜡封闭颅骨钻孔,缝合皮肤。20只大鼠作为研究对象,腹腔注射20 g/L的戊巴比妥麻醉大鼠后处死,取纹状体组织和血肿周围脑组织样本保存于-80 ℃以待后续实验。根据Zea Longa评分法对造模进行评估,1~3分为造模成功,选取造模成功的大鼠进行后续实验。
1.4.3 Western blot检测血肿周围脑组织神经元细胞自噬和凋亡相关蛋白表达 给药干预15 d后,处死大鼠,取血肿周围脑组织样本,低温快速研磨成匀浆,通过使用RIPA裂解缓冲液提取蛋白,并通过Bradford蛋白浓度测定试剂盒进行定量检测。提取的蛋白通过SDSPAGE电泳分离,然后转移到聚偏二氟乙烯膜(PVDF)膜上,再用Tris-buffer稀释的5%的脱脂奶粉封闭2 h,随后,滴加50 μL的一抗,4 ℃孵育过夜,PBS洗膜,滴加二抗山羊抗兔IgG(HRP)抗体,室温下与膜孵育1 h。最后,采用RapidStep™ECL试剂显影目的条带。β-肌动蛋白被用作内参。采用image J软件计算各组灰度值。
1.3.2 分组 实验将20只Wistar大鼠随机分为4组,假手术组(Sham 组)、脑出血组、HMGB1 中和抗体治疗(anti-HMGB1)组、control IgG组,5只/组。
1.3.3 给药 Sham组颅内注射2µL生理盐水,术后尾静脉注射PBS,6 h后再次注入等量PBS;脑出血组颅内注射0.2 U/mL胶原酶Ⅳ,术后尾静脉注射PBS,6 h后再次注入等量PBS;anti-HMGB1组颅内注射0.2 U/mL胶原酶Ⅳ,术后尾静脉注射1 mg/kg anti-HMGB1单克隆抗体,6 h后再次注入等量抗体;control IgG组颅内注射0.2 U/mL胶原酶Ⅳ,尾静脉注射1 mg/kg anti-IgG单克隆抗体,6 h后再次注入等量抗体。
2016年,Kosynkin等[9]研发了一种可应用于高温、高盐度储层的纳米粒子示踪剂。该技术的应用证明了纳米粒子在示踪地层情况方面具有重要的作用,为油田示踪剂的研发提供了新的思路。
1.4 检测指标
选取我院心脏外科2016年6月~2017年6月留置尿管7天以内的患者100例。其中男55例,女45例,年龄21~60岁,先心病30例,瓣膜病40例,冠心病30例,采用随机分原则分为观察组与对照组,各50例。两组患者在一般临床资料比较均无明显差异;差异无统计学意义(P>0.05)。见表1。
Western blot 检测脑出血大鼠血肿周围脑组织HMGB1蛋白表达情况,结果显示(图1A),与Sham组相比,脑出血组中HMGB1 蛋白表达增加(<0.001)。给予anti-HMGB1单克隆抗体后,HMGB1蛋白表达减少(<0.01)。Control IgG组中HMGB1蛋白表达情况与脑出血组一致。ELISA 检测脑出血大鼠血清HMGB1含量变化,结果显示(图1B),与Sham组相比,脑出血组中HMGB1 含量增加(<0.001)。给予anti-HMGB1 单克隆抗体后,HMGB1 含量减少(<0.01)。Control IgG组中HMGB1水平变化与脑出血组一致。免疫组化脑出血大鼠纹状体中HMGB1阳性表达,结果显示(图1C),与Sham组相比,脑出血组中HMGB1阳性表达增加(<0.001)。给予anti-HMGB1单克隆抗体后,HMGB1阳性表达减少(<0.05)。Control IgG组中HMGB1阳性表达情况与脑出血组一致。
脑出血损伤后1、3、5、7 d和15 d,mNSS评分结果显示,与Sham组相比,脑出血组mNSS评分增加,神经功能下降(<0.001,表1)。给予anti-HMGB1单克隆抗体后5 d,mNSS评分下降,大鼠神经功能损伤缓解(<0.05),到15 d后mNSS评分下降至4.21±2.01。对照control IgG组中大鼠神经功能损伤变化与脑出血组一致。
用外圆内方来概括全新路虎发现非常恰当,而圆与方抛开形似外更有哲学层面的意义。圆更符合这个时代人们对于传统汽车外形的共同认知,方则体现着路虎并不愿彻底向时代让步从而忘却经典本真。从哲学层面的意义来理解,全新路虎发现并没有失去人们曾经喜欢的那种类似工具车的硬派与酷,如今的它只是将曾经外露的性格藏在了车内。
1.4.4 ELISA 检测血清HMGB1 含量 给药干预15 d后,取血清,在3000,4 ℃下离心4 min,采用酶联免疫吸附测定法分析HMGB1含量。
1.4.5 免疫组化检测纹状体组织中HMGB1阳性表达给药干预15 d后,处死大鼠,解剖取纹状体,在10%多聚甲醛中固定24 h,石蜡包埋,切片后进行免疫组化染色分析。纹状体组织在5 μm处连续切片,脱蜡水化,抗原修复,内源性过氧化氢酶阻断,非特异性抗原(山羊血清)封闭,吸去封闭液,与anti-HMGB1抗体(1∶1000)在4 ℃下孵育过夜。然后用含有1%BSA 的PBS缓冲液清洗切片,并与二抗(HRP标记的山羊抗鼠IgG抗体)在37 ℃孵育30 min,含有1%BSA 的PBS缓冲液清洗切片,滴加2%DAB溶液显色5 min,流水冲洗。再用苏木精对细胞核进行复染,流水冲洗,返蓝处理10 min,流水冲洗,梯度乙醇脱水,二甲苯透明处理,滴加树脂封片,室温风干。免疫染色结果由两名对实验不知情的独立研究人员进行评估。从每张载玻片中随机选择五个区域,并在400倍放大镜下评估HMGB1阳性表达。
1.5 统计学处理
实验数据用SPSS 17.0 统计软件和GraphPad Prism 5软件进行统计分析。所有的数据都以均数±标准差表示。多组间的比较采用单因素方差分析(Oneway ANOVA);方差齐时,多重比较采用LSD-检验;方差不齐时,多重比较采用Dunnett's-检验。<0.05为差异有统计学意义。
1.4.1 脑出血大鼠神经功能损伤评价 脑出血损伤后1、3、5、7 d和15 d,采用改良神经损害程度评分(mNSS)用于评估神经功能和损伤程度。mNSS评分是对动物的运动,感觉和反射能力的全面评估,包括运动、感觉、反射、平衡共4部分外加肌张力检查。mNSS总分0~18分,主要包括运动测试6分,感觉测试2分,衡量平衡测试6分,反射缺失和异常运动4分,能够正常完成任务不计分,不能完成累计积分,0分为正常,1~6分为轻度损伤,7~12分为中度损伤,13~18分为重度损伤。
2 结果
2.1 脑出血大鼠mNSS神经功能评分
1.4.2 TUNNEL法检测纹状体神经元凋亡 给药干预15 d后,处死大鼠,解剖取纹状体,制作成石蜡切片,再将脱蜡、水化、Proteinase K工作液处理。洗片,将TUNNEL反应混合液滴于玻片上孵育后洗片,加DAPI,脱水、透明、封片,采用imageJ软件计算各组凋亡细胞率。
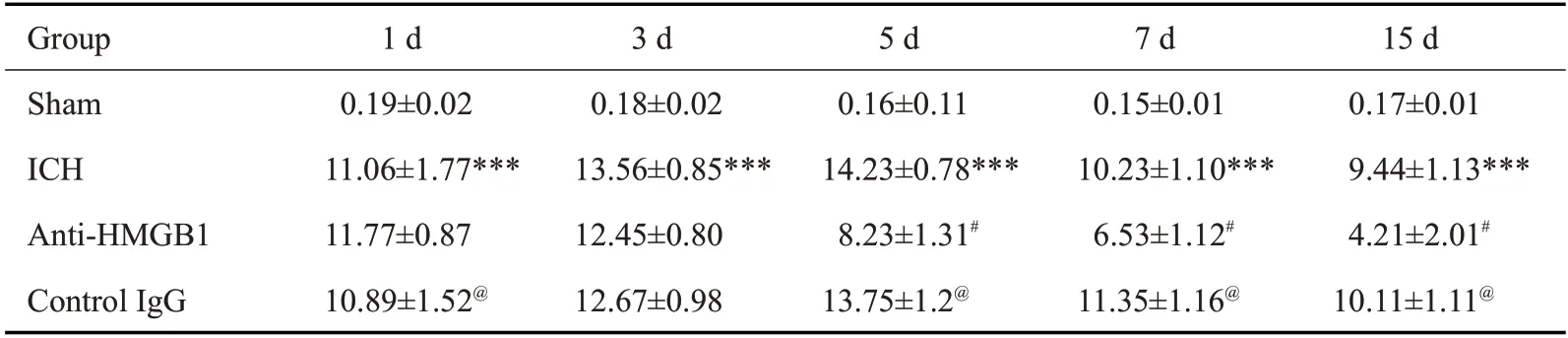
2.2 检测脑出血大鼠HMGB1的水平变化和蛋白表达情况
无论是自然环境还是人工干预,前期都必须对使用场地的水文地质条件、水动力流动信息、污染羽范围及去除目标进行精准探测,确保PRB能够发挥最大经济效益.
3.1.2 配合施用生物肥料。生物肥料又称生物菌肥,是人们利用土壤中有益微生物制成。其性质与其它肥料不同,本身不含有大量元素,主要以微生物生命活动的产物来改善植物营养条件,抑制某种病害发生,发挥土壤潜在肥力的作用,从而获得农作物的增产效果。
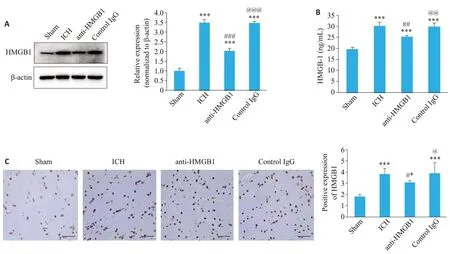
2.3 HMGB1对脑出血大鼠纹状体神经元凋亡的影响
TUNEL染色检测纹状体神经元凋亡情况结果显示(图2),与Sham组相比,脑出血组大鼠纹状体神经元凋亡率增加(<0.001)。给予anti-HMGB1单克隆抗体后,大鼠纹状体神经元凋亡率减少(<0.001)。对照control IgG组中大鼠纹状体神经元凋亡变化与脑出血组一致。
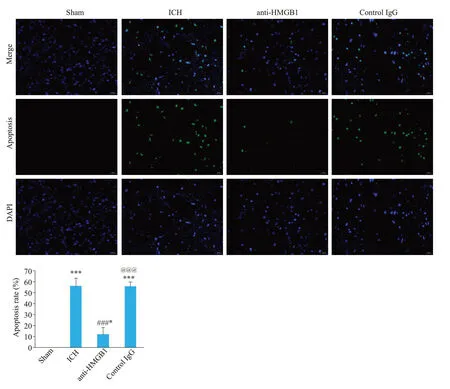
2.4 HMGB1对脑出血大鼠血肿周围脑组织神经元细胞自噬蛋白表达的影响
通过Western blot 方法检测Beclin1、LC3-II 和LC3-I的表达,结果显示(图3),与Sham组相比,脑出血组Beclin-1和LC3-II的表达增加,而LC3-I的表达减少(<0.001)。给予anti-HMGB1单克隆抗体后,Beclin-1(<0.001)和LC3-II(<0.01)的表达减少,而LC3-I的表达增加(<0.01)。Control IgG 组中自噬相关蛋白Beclin1、LC3-II和LC3-I的表达变化与脑出血组一致。
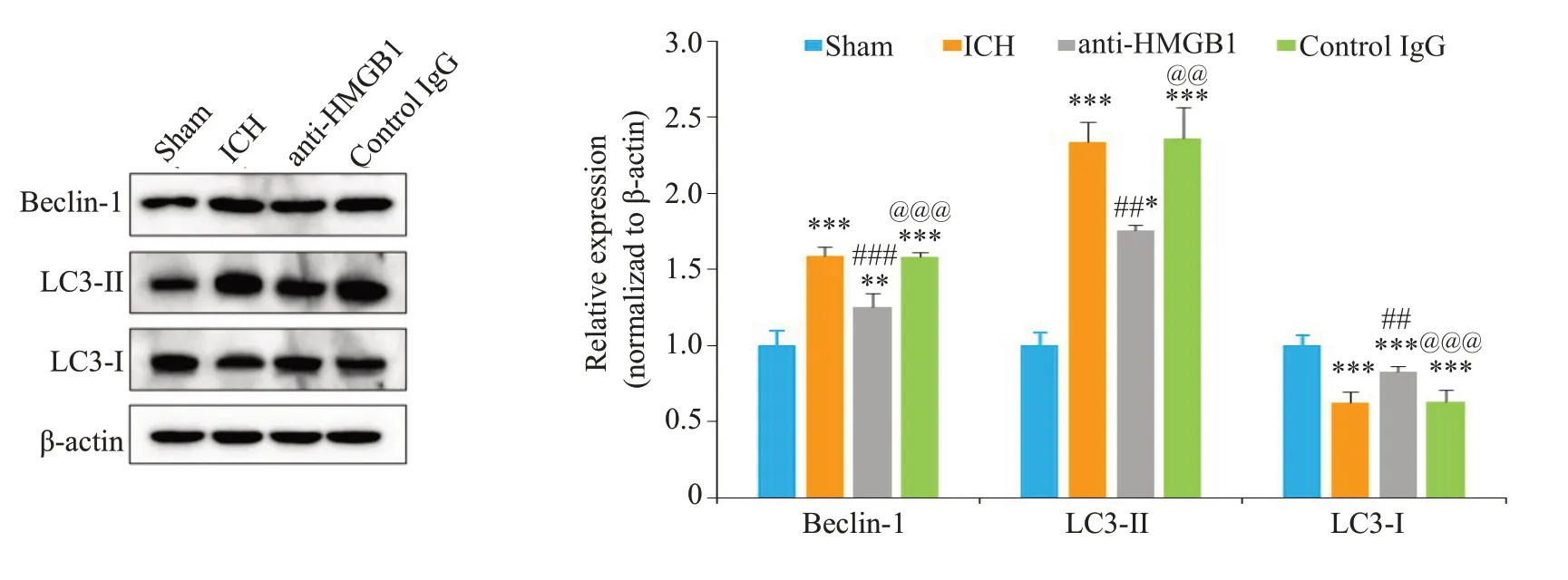
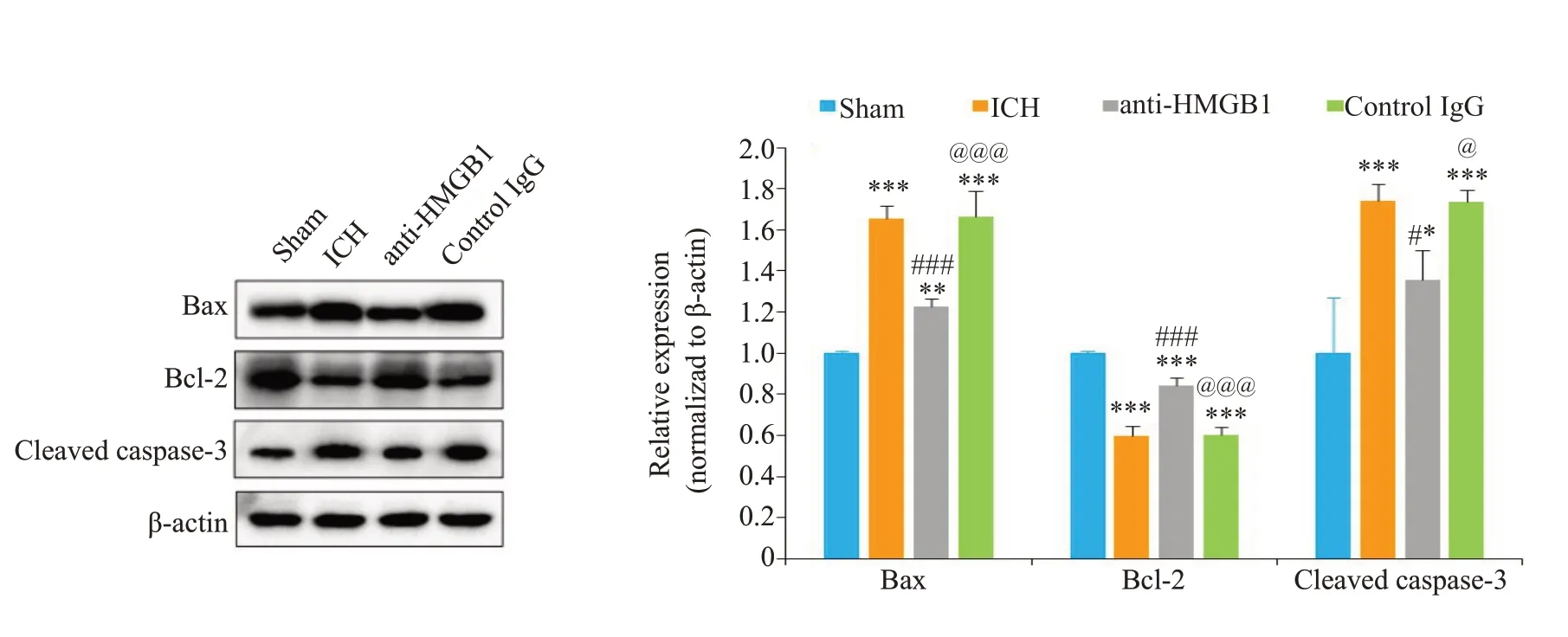
2.5 HMGB1对脑出血大鼠血肿周围脑组织神经元细胞凋亡相关蛋白表达的影响
Western blot方法检测Bax和cleaved caspase-3和Bcl-2的表达结果显示(图4),与Sham组相比,脑出血组中促凋亡基因Bax和cleaved caspase-3的表达水平增加(<0.01),而抗凋亡基因Bcl-2 的表达水平减少(<0.001)。给予anti-HMGB1单克隆抗体后,Bax(<0.001)和cleaved caspase-3(<0.05)的表达减少,而Bcl-2的的表达增加(<0.001)。对照control IgG组中凋亡相关蛋白Bcl-2、Bax和cleaved caspase-3表达变化与脑出血组一致。
3 讨论
随着对脑出血损伤机制研究的深入,提高神经细胞存活率、保持神经细胞功能成为探究脑出血治疗方案的重要突破点。向纹状体内注射凝血酶可诱导神经元急性坏死和凋亡。本研究通过注射胶原酶Ⅳ诱导脑出血大鼠模型后,大鼠神经功能减弱,mNSS评分增加,神经元凋亡蛋白和自噬蛋白表达增加,但是在脑出血期间给予anti-HMGB1后,脑出血炎性反应和神经元凋亡和自噬被抑制,最终缓解脑损伤。
HMGB1是神经血管单位内的一种早期促炎细胞因子,在包括神经元和小胶质细胞在内的各种细胞中表达。脑出血后血肿周围神经细胞受损,HMGB1可由坏死或凋亡细胞被动释放,也可由免疫或非免疫细胞主动分泌,成为重要的损伤相关分子模式。研究显示,脑出血患者血清HMGB1水平显著高于正常对照者,同时在脑出血小鼠模型亦观察到同样的结果,即血肿周围组织HMGB1水平显著升高,并于出血后72 h达峰值,出血后5 d表达水平逐渐下降。本研究也发现脑出血组大鼠HMGB1水平和蛋白表达和阳性表达水平显著高于Sham组,说明有大量细胞坏死或凋亡。在脑出血晚期,HMGB1有利于神经血管再生和组织重塑,进而促进神经功能恢复。HMGB1中和抗体已被证明可改善缺血性脑损伤。有学者利用脑出血小鼠模型进行的研究显示,给予anti-HMGBI 抗体干预可抑制HMGB1进入血肿周围区细胞外间隙,通过保护血脑屏障完整性,降低血清HMGB1水平,减轻脑水肿抑制小胶质细胞活化,从而改善预后。本研究也证明了给予anti-HMGB1单克隆抗体后,HMGB1水平和蛋白表达明显降低,神经功能损伤显著改善,细胞凋亡情况减少,脑出血损伤有所缓解。
自噬是维持细胞内环境稳定的重要细胞内自我降解过程。目前已经明确自噬在实验性脑出血、缺血性卒中、蛛网膜下腔出血的神经元胶质细胞中被激活。有研究利用透射电镜在线粒体内观察到大量双层膜的自噬小体结构,证实了在脑出血发生后自噬的激活。本研究发现,脑出血大鼠血肿周围脑组织中自噬相关蛋白Beclin-1和LC3-II的表达显著增加,而LC3-I的表达减少,表明自噬的激活。自噬与细胞凋亡之间存在着复杂的关系。一些研究表明,自噬和凋亡是相互拮抗的,自噬的激活减少了与凋亡相关的细胞死亡,但也其他研究表明,自噬导致细胞凋亡并加重细胞死亡。有学者发现在脑出血后,凝血酶能促进LC3-I向LC3-Ⅱ转换,并推测凝血酶可能参与脑出血后的自噬过程;同时也发现在体外培养的星形胶质细胞中,给予自噬抑制剂3-MA加剧了细胞死亡。有研究在胶原酶IV诱导的脑出血小鼠模型中发现给与自噬的抑制剂3-MA或激活剂雷帕霉素后,抑制自噬减轻了脑出血引起的脑损伤,而上调自噬加重了脑出血后的脑损伤程度,并且自噬可以通过激活细胞凋亡通路调节脑出血引起的神经细胞损伤。研究发现伴随着脑损伤的加重,神经元凋亡的增多,Bax呈过表达状态,而Bcl-2的表达被抑制。而本研究发现,脑出血大鼠血肿周围脑组织中凋亡相关蛋白Bax和cleaved caspase-3的表达水平明显增加,Bcl-2的表达水平明显减少,表明脑出血后自噬促进凋亡的发生。此外,有研究指出HMGB1能够通过调节细胞自噬的发生,从而影响细胞的凋亡过程。细胞浆内的HMGB1 主要是通过与自噬因子Beclin1 结合,推动Beclin1与凋亡抑制因子Bcl-2的分离而促进Beclin1和Ⅲ型磷酸肌醇3激酶/Vsp34结合,从而激活自噬。另外还有研究表明HMGB1可激活信号通路MAPK还促使Bcl-2发生磷酸化,使得Bcl-2与Beclin1发生分离,调节自噬的发生。此外,HMGB1还通过影响Bcl-2和Bcl 2的相互作用,促进上皮细胞的自噬作用,抑制1,3-β-葡聚糖诱导的小鼠肺部炎症反应。在本研究中,给予anti-HMGB1 干预,显著减少Beclin1、LC3-II、Bax 和cleaved caspase-3的表达和显著增加LC3-I和Bcl-2的表达,这表明anti-HMGB1可以抑制脑出血大鼠血肿周围脑组织神经元细胞自噬和凋亡过程。
综上所述,HMGB1可能通过调节脑神经细胞自噬途径调控脑出血后神经元的凋亡过程,从而发挥组织损伤和修复的双重调节作用,因此HMGB1可能是脑出血后神经损伤的一个重要治疗靶点。
