血管抑制素-2通过调控上皮细胞间质化促进宫颈癌细胞的增殖和转移
2022-07-18俞彩仙江晓霞伍小柳张红平
宫颈癌是全球女性发病率和死亡率第4位的恶性肿瘤,严重威胁女性生命和健康。研究证实,腹膜后淋巴结转移是宫颈癌患者最重要的独立预后因素,淋巴结转移的患者5年生存率明显降低,但目前缺乏淋巴结转移的有效分子治疗手段和敏感特异的分子标志物,无法为患者选择个体化的治疗方案,导致同时接受根治性手术和放疗的不良反应叠加。
本课题组前期研究发现,脂筏蛋白flotillin-1参与宫颈癌淋巴结转移的调控,其机制可能与上皮细胞间质化(EMT)过程有关,但其下游关键的中介分子尚不明确。我们通过在外源性过表达和干扰内源性flotillin-1表达的宫颈癌细胞株中运用RNA-seq 分析改变flotillin-1表达水平后宫颈癌细胞中的差异表达基因,发现血管抑制素-2(VASH2)的表达与flotillin-1 呈正相关。VASH2是血管抑制素家族蛋白成员,通过与血管内皮生长因子(VEGF)家族蛋白相互作用,参与新生血管形成和EMT途径的调控。研究表明,VASH2与多种人类肿瘤的增殖、转移和侵袭相关。VASH2能通过激活TGF-β信号通路,参与EMT过程的调控进而增强卵巢癌和乳腺癌细胞的迁移和侵袭能力,但其在宫颈癌中的作用和分子机制尚未见报道。
因此,本研究通过公共数据库挖掘分析差异表达基,发现VASH2在有淋巴结转移的宫颈癌组织中呈显著高表达,结合其与flotillin-1表达水平的相关性,推测其可能在作为flotillin-1蛋白的关键下游靶分子,在宫颈癌的淋巴结转移中发挥作用。本研究进一步检测了VASH2在宫颈癌细胞和组织中的表达情况,并通过体外实验检测了VASH2对宫颈癌细胞增殖、迁移、侵袭和淋巴管形成能力的影响,最后初步探索了其可能的分子机制,为证实VASH2可能作为宫颈癌淋巴结转移的潜在分子治疗靶点和诊断分子标志物提供了初步依据。
“茶产品分析与检验”是一门技术性、应用性、实践性较强的综合课程。通过学习该课程,学生可以逐步获得独立进行茶产品理化检验、有害物分析的工作能力,养成严谨求实的科学态度,同时提高获取信息、团结协作、语言表达、开拓创新等综合素质。作为地方高校,教学中始终坚持以应用能力为导向,灵活运用多种教学方法和教学手段,强化教学效果。
回眸2013年,青龙管业在国家政策的大力支持下,在水利发展的大好机遇中,锲而不舍,奋发图强,特别是在举世闻名的南水北调工程中一丝不苟地践行着建设者的使命与责任,获得了承建方的一致认可与嘉奖。
1 材料和方法
1.1 组织标本和细胞
于2020年10~12月从昆明医科大学第三附属医院采集宫颈癌组织标本。本研究经昆明医科大学第三附属医院伦理委员会批准,所有患者在采集标本前均已签署知情同意书。采集标本前患者未接受过化疗、放疗或免疫治疗。将手术中获得的新鲜组织标本切块后分别立即在-80 ℃中冷冻,用于随后的蛋白质提取;在-80 ℃RNAlater液中冻存,用于后续提取RNA;在福尔马林中固定,用于石蜡包埋。人宫颈正常上皮细胞(HcerEpic)(通泰生物科技有限公司);人宫颈癌细胞(C-33A、HeLa、SiHa、Ca Ski、MS751)(武汉普诺赛Procell生命科技有限公司);人淋巴管内皮细胞(HLEC)(北纳生物科技有限公司),由昆明医科大学附属第三医院实验室保存培养。
1.2 主要试剂与仪器
1.3.5 RT-qPCR检测各组细胞和组织中的mRNA表达水平 Trizol 试剂法分别提取各组细胞和宫颈癌组织的总RNA,取1 μg RNA逆转录成cDNA,运用RT-qPCR检测VASH2、TGF-β和GAPDH的mRNA表达水平,以GAPDH为内参。按照试剂盒说明书进行反转录和扩增实验。使用2法对目标mRNA的表达水平进行测定,ΔΔCt=(Ct,目标-Ct,内参照)干预组(-Ct,目标-Ct,内参照)对照组。引物序列(表1),研究中各细胞系干扰序列(表2)。
墙体的切屑过程中,如果墙体的深度小于二十米抗压能力在1MPa时,依据二期槽的要求切割一期槽时要在二期槽内部做好锯齿连接的工作;根据具体墙体深度、槽部的斜率计划合理的切削长度。墙体深度如果突破了40米,一般就会采用到接头管的方法。在发生意外断裂事故之前,做好缝隙之间的连接工作。用冲击钻采用回转的形式使得槽孔周边的槽桩联系在一起,增强其连接性。
1.3 方法
1.3.1 公共数据库挖掘 首先利用外源性过表达和抑制内源性flotillin-1 表达的宫颈癌SiHa 和HeLa 细胞的RNA-seq测序结果分析得到的差异基因,通过GEO2R工具验证这些差异基因在GEO 数据库中的数据集GSE26511(包含N+和N0的宫颈癌组织样本)的差异表达情况,筛选条件:<0.05,|log fold-change(FC)| >1。对TCGA数据中的宫颈癌患者数据,根据是否发生淋巴结转移进行分组,验证RNA-seq测序的差异基因在两组间的表达情况,筛选条件:<0.05,|log fold-change(FC)|>1。最终得到flotillin-1下游可能参与调控宫颈癌淋巴结转移的基因VASH2。
1.3.2 细胞培养 正常宫颈上皮细胞HcerEpic和宫颈癌细胞SiHa、HeLa用DMEM高糖培养基(含10%FBS、1% 氨苄青霉素、卡那链霉素),MS751 和C-33A 用MEM培养基(含10%FBS、1%氨苄青霉素、卡那链霉素),Ca ski和HLEC细胞用1640培养基(含15%FBS、1%氨苄青霉素、卡那链霉素)在37 ℃、50 mL/L CO的孵箱中静置培养。当细胞长满细胞培养瓶的85%~90%,用胰酶消化传代。
1.3.7 免疫组织化学(IHC)检测组织中VASH2的蛋白表达水平 石蜡包埋的宫颈癌组织切片常规脱蜡,逐层乙醇和蒸馏水水化,柠檬酸盐缓冲液(pH=6.0)处理后微波修复抗原,5%羊血清25 ℃1 h封闭处理,一抗4 ℃孵育过夜(15 h),二抗和二氨基联苯胺(DAB)显色,苏木素复染,脱水、封片。晾干的切片置于光镜(×200)下观察。免疫反应(IRS)评分:由2位病理学专家评分;染色强度0~3分:依次为阴性、浅黄色、浅褐色、深褐色;阳性范围0~4分:依次为0~25%、26%~50%、51%~75%、76%~100%。免疫反应评分=染色强度评分×阳性范围。
1.3.4 慢病毒转染及分组 将处于对数生长期的HeLa细胞用0.25%胰酶消化并分别接种至6孔板内(5×10/孔),当细胞贴壁后更换为含5 μg/mL VASH2过表达慢病毒载体或过表达慢病毒空载体病毒的无双抗完全培养基感染48 h,感染后细胞融合度达到85%左右,进行传代处理,传代后加入嘌呤霉素持续作用,筛选3代后收集细胞,分组为:HeLa-VASH2 和HeLa-VASH2-vector。用同样的方法在Ca ski 和MS751 细胞中分别转染VASH2 干扰慢病毒载体和干扰慢病毒空载体,其中VASH2干扰慢病毒载体分别构建3条,待细胞转染传代后收集细胞进行PCR 验证,筛选其中干扰效果最佳的2条慢病毒载体,分组为:Ca ski-VASH2RNAi#1、Ca ski-VASH2RNAi#2、Ca ski-VASH2RNAi-vector 以及 MS751-VASH2RNAi#1、MS751-VASH2RNAi#2、MS751-VASH2RNAi-vector。
我国金融行业发展速度日益加快,通过我国严格的相关法律法规规定,银行理财业务开展也逐渐丰富,但我国理财市场仍处于初级发展阶段,随着市场规模的不断扩大,竞争日益激烈,产品创新层出不穷。同时国民的理财意识也逐渐加强,需要多结构、多类型、低风险产品投入市场,全面推动银行理财业务的创新发展。
无水乙醇(广州金华大化学试剂有限公司);PBS缓冲液粉末、柠檬酸盐修复液(北京中杉金桥公司);DMEM高糖培养基(Gibco),MEM培养基(Gibco);胎牛血清及青霉素、链霉素(Gibco);RNA-seq(广州基迪奥);VASH2RNAi慢病毒载体(中国锐博),VASH2过表达慢病毒载体(吉满生物);FastKing RT Kit(With gDNase)cDNA第一链合成试剂盒(KR116,FastKing);BCA蛋白浓度测定试剂盒(碧云天);兔抗人VASH2抗体(Abcam),兔抗人E-cadherin、N-cadherin、Vimentin、VEGF-C(Abcam);二抗(山羊抗兔IgG/HRP 标记,山羊抗鼠IgG/HRP 标记)(Abcam);ECL发光液(Biosharp);CCK-8 试剂盒(同仁化学公司);划痕插件(IBIDI 80466);基质胶(Corning),Transwell试剂盒(Corning)。
小伊发觉到自己的双重人格时,正骑着已经被禁止的无牌照摩托车穿越在寂静的市中心,播放出的聒噪摇滚乐引来了巡逻民警,小伊熟练地把速度换到最高档位,享受着摆脱追逐的快感,转弯的瞬间离心力在地上蹭出一条划痕,眼角根据角度的变换在无意中瞥到了什么建筑,他还没有明白对这栋建筑的熟悉感来自哪里,大脑就已经传来阵痛,愈演愈烈,在从摩托车飞出的瞬间,他恍惚想起这似乎是个学校,桌椅已经老旧,上面写满了少男少女的笔迹。摔在地上的那一刻,小伊感到似乎有什么重要的东西从他身体里流出。
1.3.11 淋巴管形成实验 Matrigel在4 ℃隔天融化,枪头、Transwell小室、24孔板提前置于4 ℃预冷。4 ℃预冷96孔板,加入50 μL/孔基质胶,培养箱内放置30 min使其凝固。0.25%胰酶消化收集HLEC细胞,使用各组细胞培养基分别调整悬液浓度为2.5×10/mL,往含有Matrigel的孔中加入100 μL的细胞悬液,培养箱内培养4 h后倒置显微镜下观察管腔形成情况拍照,随机挑选显微镜摄片中3个同等大小视野对淋巴管形成数量计数并求算术和。
1.3.3 RNA-seq测序 将外源性过表达和抑制内源性flotillin-1表达的宫颈癌SiHa和HeLa细胞进行RNAseq 测序。样品提取总RNA 后,去除其中的核糖体RNA,以最大限度地保留所有codingRNA和ncRNA。得到的RNA 随机打断成为短片段,再以片断化后的RNA为模板,用六碱基随机引物合成cDNA第一链;接着加入缓冲液、dNTPs(dUTP代替dTTP)、RNase H和DNA polymerase I 合成cDNA 第二链,经过QiaQuick PCR试剂盒纯化并加EB缓冲液洗脱经末端修复、加碱基A,加测序接头,然后通过UNG酶降解第二条链。用琼脂糖凝胶电泳进行片段大小选择,进行PCR扩增。最后建好的测序文库用Illumina HiSeq4000进行测序。
视域整合度表示剔除拓扑学意义上的影响因素之后,从全系统任意位置能够看到某一元素所需转折的数值,整合度数值越高,颜色越深,越容易吸引空间中人的注视.其衡量了所研究空间吸引到达交通的潜力,显示出此空间对于其他空间在视线方面聚集或离散的程度.具体来说,在视域分析中,整合度越高(分析图颜色越深)表示在整体空间中的任意位置经过较少的转折点就可以看到此区域,从而区域内的视线聚集性越高;而颜色越浅,区域内的视线聚集性越低.
1.3.8 CCK-8增殖实验 将各组细胞接种至96孔板中,约3000/孔,培养0、24、48、72、96 h 后,加入CCK-8 试剂,每组设定3个复孔,混匀后放培养箱继续培养,2 h后酶标仪检测450 nm处各孔细胞光密度,绘制生长曲线,计算细胞活力=(-)/(-)×100%。
1.3.9 划痕愈合实验 用0.25%胰酶消化各组细胞,以2000/孔接种至Ibidi 划痕插件内,当细胞融合度达到95%时移除插件,培养基洗3次,加入500 μL/孔基础培养基后于0、12、24 h时间点各组细胞相同位置拍照,每组设定3个复孔。使用imagine J Pro软件分析0、12、24 h各组细胞之间迁移的面积,计算细胞迁移百分率=0 h平均面积-24 h平均面积/0 h平均面积×100%。
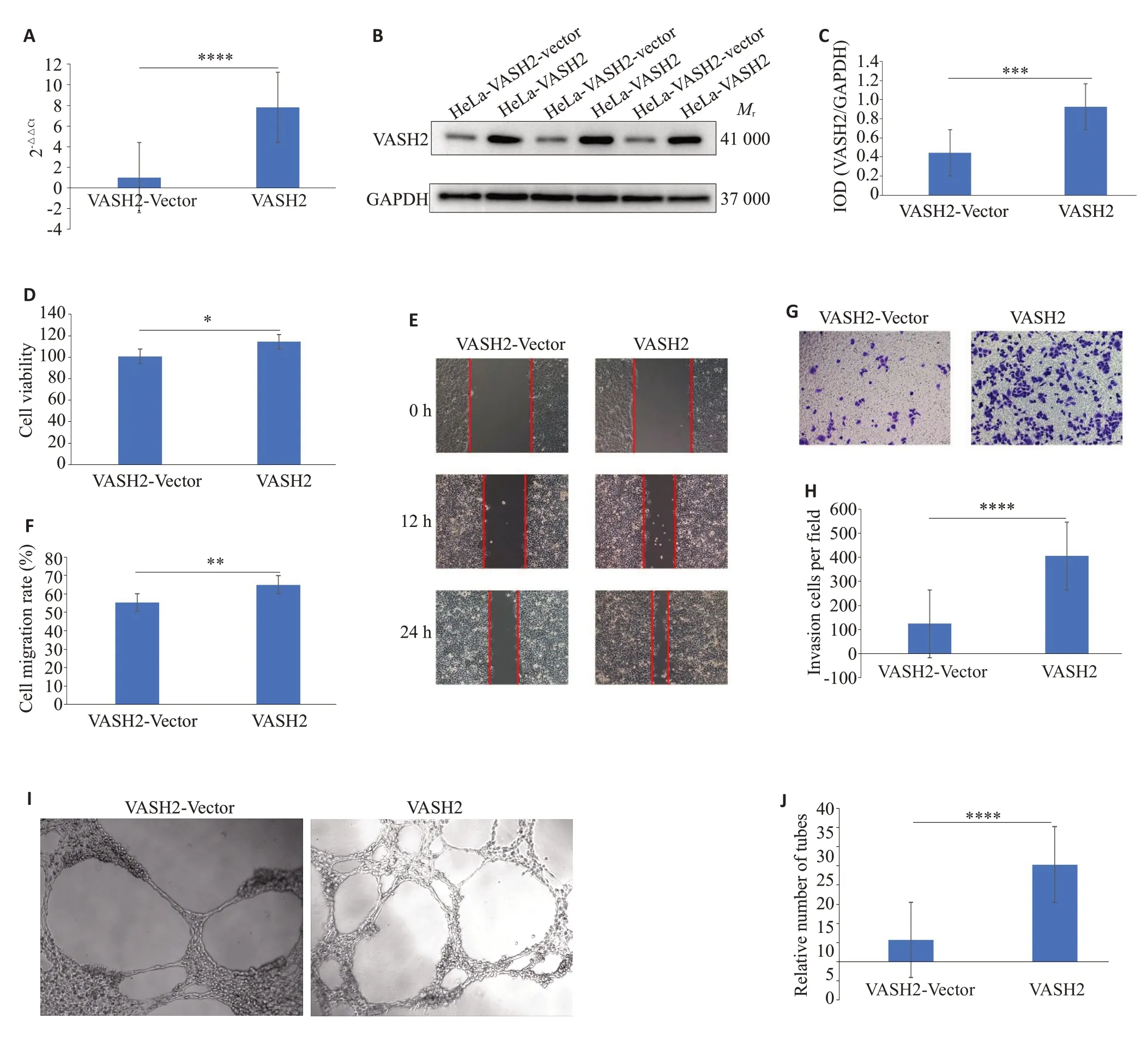
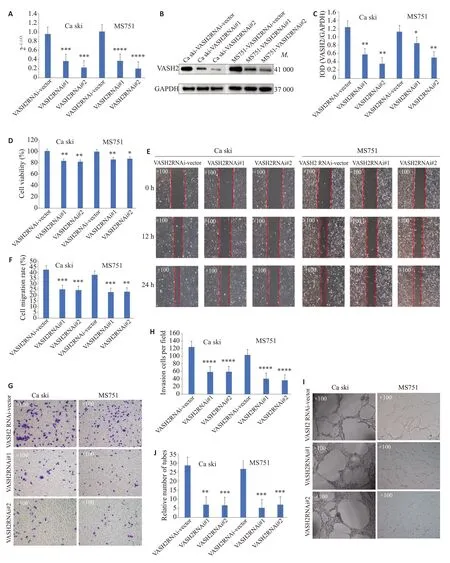
根据上述VASH2在宫颈癌细胞中的表达情况,我们通过慢病毒稳定表达载体构建了外源性过表达VASH2 的HeLa细胞(HeLa-VASH2)和过表达空白载体的对照细胞(HeLa-VASH2-vector,图3A~C),以及抑制内源性VASH2 表达的Ca ski、MS751 细胞(Ca Ski-VASH2RNAi#1、Ca Ski-VASH2RNAi#2;MS751-VASH2RNAi#1、MS751-VASH2RNAi#2)和相应的对照细胞(Ca Ski-VASH2RNAi-vector、MS751-VASH2RNAi-vector,图4A~C)。
1.3.6 Western blot检测各组细胞和组织中的蛋白表达水平 收集各组细胞和宫颈癌组织标本提取细胞总蛋白质,BCA法检测蛋白质浓度,取相应量的蛋白质用10%的SDS-PAGE上样缓冲液调至蛋白浓度为1 mg/mL,并变性,采用SDS聚丙烯酰胺凝胶电泳法将蛋白条带完全跑开,恒流(210 mA)转移分离后的蛋白质至PVDF膜上。5%的BSA37 ℃封闭2 h后,分别加入一抗4 ℃孵育过夜(VASH2/E-cadherin/N-cadherin/Vimentin/VEGF-C,1∶1000 稀释)。TBST 溶液洗去游离抗体,分别加入HRP标记的山羊抗兔IgG(1∶5000 稀释)或HRP标记的山羊抗小鼠IgG(1∶5000 稀释),37 ℃孵育1 h,1×TBST洗膜10 min×3后用ECL化学发光液显色。
1.4 统计学处理
采用SPSS 20.0统计软件和GraphPad prism7统计软件进行数据分析,所有数据经正态性检验。数据用均数±标准差表示,独立两组间比较采用非配对双尾检验,组间两两比较采用方差分析,以<0.05为差异有统计学意义。
2 结果
2.1 VASH2 在宫颈癌细胞中的表达与flotillin-1 呈正相关
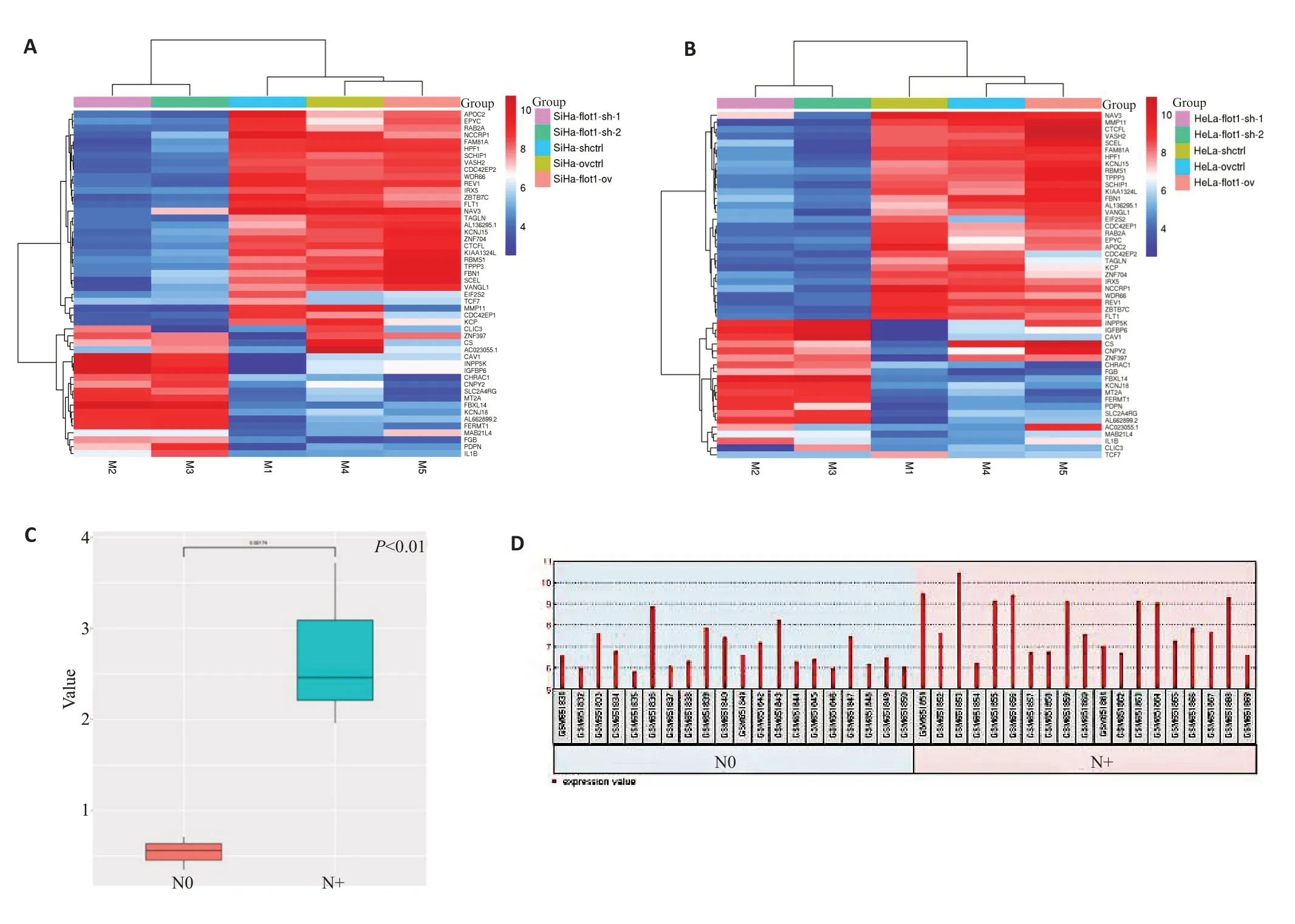
本研究在外源性过表达和抑制内源性flotillin-1表达的SiHa和HeLa细胞中进行RNA-seq测序,结果显示flotillin-1能够调控一系列下游基因的表达(图1A、B),结合flotillin-1下游调控基因在TCGA及GEO数据库中宫颈癌淋巴结转移和宫颈癌淋巴结未转移标本中的表达情况,发现基因VASH2受flotillin-1显著正调控,且在TCGA及GEO数据库中发现,相对于无淋巴结转移的宫颈癌组织,其在有淋巴结转移的宫颈癌组织中表达明显上调(图1C、D)。
2.2 VASH2在宫颈癌细胞和有淋巴结转移的宫颈癌组织中表达显著上调
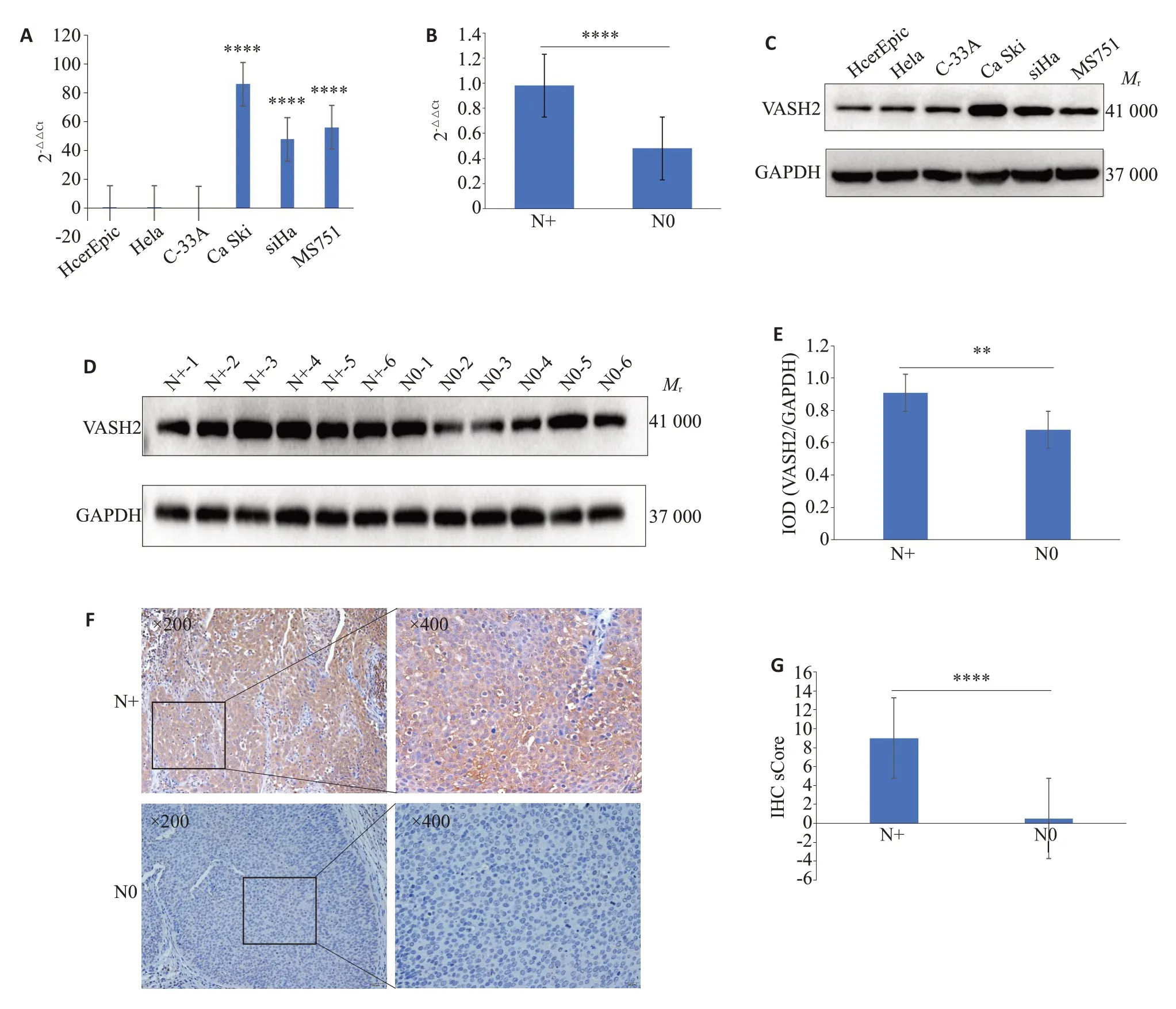
运用RT-qPCR、Western blotting和免疫组织化学(IHC)检测VASH2的mRNA和蛋白表达水平,结果显示:相对于正常宫颈上皮HcerEpic细胞,VASH2在宫颈癌细胞Ca ski、SiHa和MS751中的表达上调(<0.05,图2A、C),而相对于无淋巴结转移的宫颈癌组织,VASH2在有淋巴结转移的宫颈癌组织中的表达也上调(<0.05,图2B、D~G)。
2.3 VASH2在体外促进宫颈癌细胞的增殖、迁移、侵袭和淋巴管形成
1.3.10 Transwell侵袭实验 Matrigel在4 ℃隔天融化,枪头、Transwell 小室、24 孔板提前置于4 ℃预冷。取50 μL 融化好的Matrigel 加入到Transwell 小室中,使Matrigel 均匀铺在Transwell 膜上,37 ℃干胶30 min。0.25%胰酶消化收集各组细胞,计数,将细胞浓度调整为1×10/mL,接种100 μL细胞悬液至Transwell-matrigel小室内,3孔/组重复,培养箱内培养24 h。随后取出小室移入加有1 mL 4%多甲固定液的孔内,小心吸干上室液体,往上室小心滴加200 μL 4%多聚甲醛固定液,室温固定30 min;吸取固定液,擦去Matrigel胶,把小室放入加有500 μL结晶紫染色液的孔中,室温染色15 min。染色后PBS清洗3次,于显微镜下观察拍照,使用imagine J Pro软件分析各组穿越Transwell膜的细胞数目。
在上述细胞中通过CCK-8实验显示,相对于对照细胞,外源性过表达VASH2 的HeLa细胞增殖能力增强(<0.05,图3D),而抑制内源性VASH2 表达的Ca Ski 和MS751 细胞增殖能力则明显减弱(<0.01,图4D)。划痕愈合实验和Transwell侵袭实验显示,相对于对照细胞,外源性过表达VASH2后HeLa细胞的迁移(<0.01,图3E、F)和侵袭能力(<0.001,图3G、H)增强,而在抑制内源性VASH2表达后,Ca Ski和MS751细胞的迁移(<0.001,图4E、F)和侵袭能力(<0.001,图4G、H)减弱。淋巴管形成实验显示,相对于对照细胞,过表达VASH2后HeLa细胞形成新生淋巴管腔的数量明显增加,长度明显增长(<0.01,图3I、J),而抑制内源性VASH2表达后,Ca Ski和MS751细胞形成新生淋巴管腔的数量明显减少,长度明显变短(<0.001,图4I、J)。
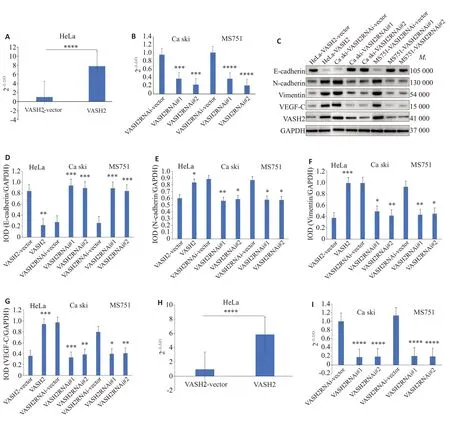
2.4 VASH2可能通过调控EMT途径促进宫颈癌细胞的转移
本研究先构建了外源性过表达VASH2 的HeLa细胞和其对照细胞以及抑制内源性VASH2 表达的Ca ski、MS751细胞和其对照细胞(<0.01,图5A、B),再通过Western blot检测EMT途径关键分子的蛋白表达水平(图5C),结果显示:外源性过表达VASH2后,上皮细胞的表面标记E-cadherin的表达下调(<0.01,图5C、D),而间质细胞的表面标记N-cadherin和Vimentin的表达上调(<0.05,图5C、E、F),同时调控新生血管形成的关键分子VEGF-C的表达也上调(<0.001,图5C、G)。抑制内源性VASH2表达后,E-cadherin的表达明显恢复(<0.001,图5C、D),N-cadherin、Vimentin和VEGF-C的表达下调(<0.05,图5C、E~G)。为进一步探寻其可能的分子机制,通过RT-qPCR检测以上细胞模型中调控转化生长因子β(TGF-β)的mRNA表达情况,发现外源性过表达VASH2后,TGF-β的表达上调(<0.0001,图5H),而抑制内源性VASH2表达后,TGF-β的表达下调(<0.0001,图5I)。
我很愧疚,像是无意中看见了别人的隐秘日记,想放下,却被内心的魔鬼驱使着要看下去,直到被主人发现,才惊慌失措。
3 讨论
flotillin-1是脂筏的重要组成部分,其参与多种细胞生物学功能,包括细胞粘附、肌动蛋白细胞骨架重组、内吞、吞噬和细胞信号转导等,研究发现其在肿瘤的发生发展中也发挥着重要作用。我们前期研究发现flotillin-1与宫颈癌淋巴结转移密切相关,在进一步研究其分子机制时,通过干扰和过表达flotillin-1进行RNAseq测序寻找其下游调控基因,发现促进新生血管形成的基因VASH2的表达与flotillin-1呈现正相关,进而推测flotillin-1可能是通过VASH2调控宫颈癌的淋巴结转移。本研究通过细胞和组织标本检测、建立过表达和抑制内源性VASH2表达的宫颈癌细胞模型及一些列体外实验,初步证实了VASH2在可能通过调控EMT促进宫颈癌细胞在体外的增殖和转移。
新生血管形成被认为是由血管生成刺激因子和血管生成抑制因子之间的局部平衡所调节的,而肿瘤的发生和发展离不开新生血管的形成。研究表明,VASH2与新生血管形成和肿瘤增殖、转移密切相关;VASH2还可以通过调控内皮细胞迁移促进新生血管形成进而影响浆液性卵巢癌的生长和腹腔播散。本研究通过RT-qPCR、Western blot和IHC检测VASH2的在宫颈癌细胞和不同淋巴结转移状态的宫颈癌组织中的表达水平,发现VASH2在宫颈癌细胞HeLa、Ca ski和MS751中的表达水平显著高于宫颈正常上皮细胞,特别是在宫颈癌肠转移来源细胞Ca ski和淋巴结转移来源细胞MS751中呈异常高表达;VASH2在有淋巴结转移的宫颈癌组织中其mRNA和蛋白表达水平均显著高于无淋巴结转移的宫颈癌组织,提示其可能与宫颈癌的淋巴结转移密切相关。本研究进而构建了外源性过表达和抑制内源性VASH2表达的宫颈癌细胞模型,通过CCK-8实验证实VASH2能在体外促进宫颈癌细胞的增殖。而研究显示VASH2具有微管羧肽酶活性,参与形成细胞内微管,微管作为细胞骨架的重要部分是细胞有丝分裂过程中必不可少的,这也可能是VASH2能促进宫颈癌细胞增殖的原因。我们进而通过划痕愈合、Transwell侵袭和淋巴管形成实验证实VASH2能在体外促进宫颈癌细胞的迁移、侵袭和淋巴管形成。
研究证实,VASH2能对微管蛋白进行许多翻译后修饰以产生异质微管,这些修饰包括去除和连接β-微管蛋白的C末端酪氨酸等;同时VASH2具有微管羧肽酶活性,能通过改变细胞骨架参与EMT途径。EMT途径是多种肿瘤如乳腺癌、胃癌、肺癌转移过程中的关键步骤。本研究发现外源性过表达VASH2后EMT途径的关键分子E-cadherin蛋白表达水平明显降低,而Ncadherin和Vimentin的蛋白表达水平则明显升高;在抑制内源性VASH2表达后,这些分子的表达水平则呈现相反的趋势。E-cadherin作为上皮细胞的表面标志物,通过其细胞内外粘附功能,维持细胞间连接及上皮细胞的诸多功能;N-cadherin作为间质细胞的表面标志物,能促进肿瘤细胞的转移;Vimentin又作为上皮细胞向间质细胞转化的表面标志物,与VASH2的表达呈正相关,进一步证实了VASH2能在体外诱导宫颈癌细胞发生EMT过程。EMT途径受到多种信号转导通路的调控。有研究表明,VASH2 可以通过TGF-β、Hedgehog 等信号转导通路诱导EMT 途径,而后者在宫颈癌的淋巴结转移过程中发挥着重要的作用。本研究发现TGF-β通路中总TGF-β的mRNA表达水平在宫颈癌细胞中受到VASH2 的调控,同时VASH2 也能促进VEGF 家族关键分子VEGF-C 的表达,提示VASH2可能通过TGF-β通路调控EMT过程从而促进宫颈癌细胞的增殖、侵袭、迁移和转移。
综上所述,本研究发现flotillin-1 下游靶基因VASH2在转移宫颈癌细胞和有淋巴结转移的癌组织中呈异常高表达,并能在体外促进宫颈癌细胞的增殖、迁移、侵袭和淋巴管形成,其机制可能与TGF-β通路调控的EMT途径有关,可能作为flotillin-1促进宫颈癌淋巴结的下游途径,同时本研究为证实VASH2可能作为宫颈癌淋巴结转移的潜在分子治疗靶点和诊断分子标志物提供了初步依据。
