基于ISSR分子标记的黄花倒水莲遗传多样性分析
2022-07-16苏秀丽梁惠凌刘宝玉黄夕洋唐辉
苏秀丽 梁惠凌 刘宝玉 黄夕洋 唐辉





摘要: 旨在揭示黃花倒水莲资源的遗传多样性,分析其遗传差异,为黄花倒水莲的良种选育提供理论基础。以荷包山桂花居群为外类群,利用简单重复序列间扩增(Inter simple sequence repeat, ISSR)分子标记对来源于10个地区的黄花倒水莲自然居群进行遗传多样性和亲缘关系分析。结果显示,用11条引物共扩增得到132条条带,其中91条为多态性条带(PPB),多态性条带比例为68.94%。在物种水平上,黄花倒水莲10个居群的Nei’s基因多样性指数( H )、Shannon多样性指数( I )分别为0.163 7 、0.250 1 ,表现出较高的遗传多样性,而在居群水平上, H 、 I 的均值分别为0.063 4 、0.098 8 ,表现出偏低的遗传多样性。Nei’s遗传多样性和分子方差分析(AMOVA)结果表明,黄花倒水莲的遗传变异主要发生在居群间,遗传分化程度较高(基因分化系数= 0.610 9 ,基因流= 0.318 5 )。遗传一致度及聚类分析结果显示,黄花倒水莲各居群间的亲缘关系较近(遗传距离为0.032~ 0.182),与荷包山桂花居群的亲缘关系较远(遗传距离为0.428~ 0.536),在遗传一致度为0.630处可以将黄花倒水莲与荷包山桂花区分开,在遗传一致度为0.867处可以将10个黄花倒水莲居群分为3类。由于黄花倒水莲居群水平上的遗传多样性水平较低,今后应对黄花倒水莲野生资源进行合理利用与保护。
关键词: 黄花倒水莲; 简单重复序列间扩增(ISSR)分子标记; 遗传多样性分析; 遗传分化
中图分类号: S567.23+9 文献标识码: A 文章编号: 1000-4440(2022)03-0605-06
Genetic diversity analysis of Polygala fallax based on ISSR molecular markers
SU Xiu-li 1,2,3 , LIANG Hui-ling 1,2 , LIU Bao-yu 1,2 , HUANG Xi-yang 1,2 , TANG Hui 1,2
(1.Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin 541006, China; 2.Guangxi Key Laboratory of Functional Phytochemicals Research and Utilization, Guilin 541006, China; 3.Key Laboratory of Ecology of Rare and Endangered Species and Environmental Protection, Ministry of Education, Guangxi Normal University, Guilin 541006, China)
Abstract: The aim of this study is to reveal the genetic diversity of Polygala fallax Hemsl germplasm resources, and analyze their genetic differences, so as to provide theoretical basis for the selection and breeding of Polygala fallax Hemsl germplasm resources. Taking Polygala arillata Buch as the outer group, the inter-simple sequence repeat (ISSR) molecular markers were used to explore the genetic diversity and genetic relationship of natural populations of Polygala fallax Hemsl from ten regions. The results showed that a total of 132 bands were amplified with 11 primers, including 91 polymorphic bands (PPB), and the proportion of PPB was 68.94%. At the species level, Nei’s gene diversity index ( H ) and Shannon’s diversity index ( I ) were 0.163 7 and 0.250 1 , respectively, showing high genetic diversity. At the population level, the mean values of H and I were 0.063 4 and 0.098 8 , respectively, showing low genetic diversity. The results of Nei’s genetic diversity and molecular variance analysis (AMOVA) showed that the genetic variation was mainly distributed among populations, with a large level of genetic differentiation (gene differentiation coefficient was0.610 9 , gene flow was 0.318 5 ). The genetic identity and clustering results indicated that the genetic relationship between the populations of Polygala fallax Hemsl was relatively close (genetic distance was 0.032- 0.182), and the genetic relationship with Polygala arillata Buch was relatively far (genetic distance was 0.428- 0.536). At the level of genetic identity of 0.630, Polygala fallax Hemsl and Polygala arillata Buch (YN) could be separated. Ten populations of Polygala fallax Hemsl could be divided into three types at 0.867. In view of the relatively low level of genetic diversity in the population of Polygala fallax Hemsl, the wild resources should be rationally utilized and protected in the future.
Key words: Polygala fallax Hemsl; inter-simple sequence repeat (ISSR) molecular markers; genetic diversity; genetic differentiation
黄花倒水莲( Polygala fallax Hemsl)别称黄花远志,是远志属( Polygala )的多年生植物,同时还是中国的特有物种,主要分布于中国南部地区,常见于海拔360~1 650 m的山坡林木下或者沟谷丛林边 [1] 。黄花倒水莲还是一些少数民族的常用药材,又称为结端旁 [2-3] ,其性平、味甘,通常可以用来补气血、祛湿、强筋骨等 [4-5] ,还具有调脂、抗凝血、抗衰老、保肝等作用 [6-7] ,在民间有悠久的药用历史。荷包山桂花( Polygala arillata Buch)与黄花倒水莲同为远志属荷包山桂花组植物,云南当地人將其称为鸡根,其花、叶片、果实形态及功用都与黄花倒水莲极为相似,因此民间常有人将这2种植物混淆 [3] 。
近年来,由于黄花倒水莲具有药食两用特性而逐渐为大众熟知,导致其野生资源逐渐减少,而荒地开采等活动对黄花倒水莲所在的原始生态环境造成一定影响,原始生态环境的改变可能会使物种的遗传多样性程度降低。分子标记克服了随机扩增多态性DNA(RAPD)等分子标记的缺点,已被成功应用于远志 [8] 、西伯利亚远志 [9] 的遗传多样性分析中。目前尚未见有关黄花倒水莲遗传多样性的研究报道,因此本研究利用简单重复序列间扩增(ISSR)技术,以荷包山桂花作为外类群,对来自10个地区的黄花倒水莲居群进行遗传背景差异分析,旨在从分子水平揭示不同地区野生黄花倒水莲的亲缘关系,为黄花倒水莲的资源保护和之后的合理应用提供可靠依据。
1 材料与方法
1.1 试验材料
供试植物来源见表1,共有166份样品,其中黃花倒水莲来自10个野生居群,荷包山桂花来自云南栽培居群。选取生长健康的植株并采集其幼嫩叶片,置于硅胶袋中干燥后保存备用。
1.2 方法
1.2.1 基因组DNA的提取及检测 用十六烷基三甲基溴化铵(CTAB)法 [10] 提取植物干燥叶片总DNA,用Thermo Nano Drop TM /ND-2000C检测其浓度,用1%琼脂糖凝胶电泳检测DNA的纯度,并稀释至50 ng/μl 后于-20 ℃ 保存。
1.2.2 PCR扩增 PCR扩增反应在Bio-Rad PCR仪上进行,20 μl反应体系包括50 ng DNA模板、10 μl 2× Master Mix、10 μmol/L ISSR引物,用ddH2 O补足体积。PCR扩增程序具体如下:94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火35 s,72 ℃延伸1 min,45个循环;72 ℃再延伸10 min。将扩增产物通过1.5%琼脂糖凝胶电泳进行分离,于140 V电泳50 min后经溴化乙锭(EB)染色,再置于UVP EC 310紫外凝胶成像仪中拍照保存后进行条带统计与分析。
1.3 数据统计与分析
根据PCR扩增产物在凝胶电泳中移动速度的差异,对不同电泳条带采用0/1赋值法构建表型数据矩阵,统计各引物总条带数、多态性条带数,计算多态性条带(PPB)比例。用Popgen32 [11] 软件计算如下遗传参数:等位基因数( N a )、多态性位点(PPL)比例、有效等位基因数( N e )、Nei’s基因多样性指数( H )、居群总遗传多样性指数( H t )、Shannon 多样性指数( I )、居群内遗传多样性指数( H s )、基因流( N m )和基因分化系数( G st )。用GenAlEx 6.5软件计算遗传一致度、遗传距离,进行分子方差分析(AMOVA),用NTSYSpc软件构建非加权组平均法(Unweighted pair-group method with arithmetic means, UPGMA)聚类图 [12-13] 。
2 结果与分析
2.1 引物的多态性分析
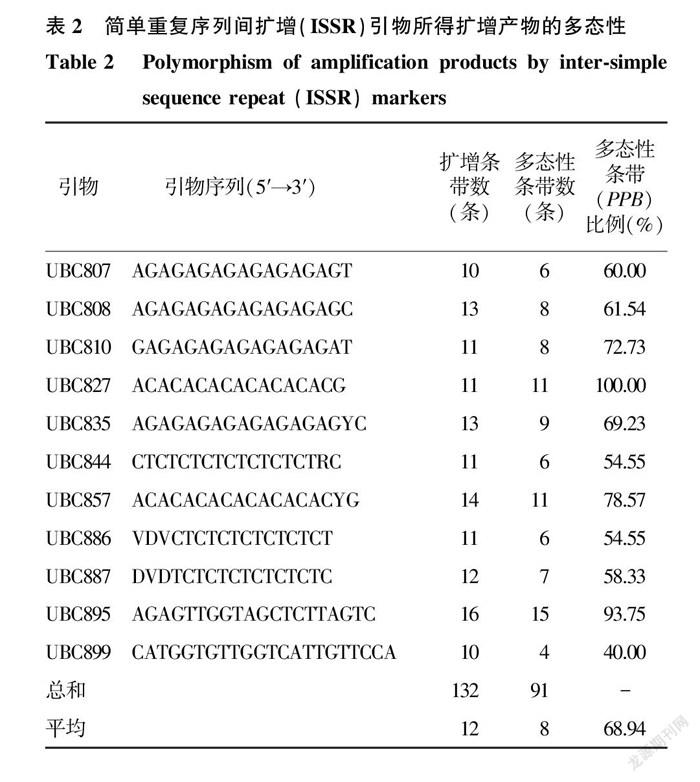
根据电泳结果,从50条引物中挑选出11条条带较清晰、可重复的引物,其扩增结果见表2。用筛选出的引物对166个DNA样本进行PCR,共获得132条清晰可见的条带,其中91条条带具有多态性,平均多态性条带(PPB)比例为68.94%,每条引物平均扩增出的条带数为12条,多态性条带数为4~ 15条。除了引物UBC899的多态性条带比例为40.00%外,其他引物均具有较高的多态性条带比例,为54.55%~ 100.00%,图1为用引物UBC808扩增到的电泳条带。
2.2 遗传多样性分析
如表3所示,在物种水平上,黄花倒水莲10个居群的等位基因数( N a )为1.590 9 ,有效等位基因数( N e )为1.278 9 ,多态性位点(PPL)比例为59.09%,Nei’s基因多样性指数( H )为0.163 7 ,Shannon多样性指数( I )为0.250 1 。
由表3还可以看出,在居群水平上,等位基因数( N a )为1.113 6~ 1.325 8 ,均值为1.225 8 ;有效等位基因数( N e )为1.055 3~ 1.140 6 ,均值为1.101 6 ; 多态性位点(PPL)比例为11.36%~ 32.58%,均值为22.58%;Nei’s基因多样性指数( H )为0.033 9~ 0.084 4 ,均值为0.063 4 ;Shannon多样性指数( I )为0.052 2~ 0.132 9 ,均值为0.098 8 。在10个黄花倒水莲居群中,湖南居群(HN)的变异程度最大(等位基因数为1.325 8 ,有效等位基因数为1.125 3 ,Nei’s基因多样性指数为0.082 8 ,Shannon多样性指数为0.132 9 ,多态性位点比例为32.58%),靖西居群(JX)的变异程度最小(等位基因数为1.113 6 ,有效等位基因数为1.055 3 ,Nei’s基因多样性指数为0.033 9 ,Shannon多样性指数为0.052 2 ,多态性位点比例为11.36%)。
2.3 居群遗传分化分析
根据Popgen32的计算结果,黄花倒水莲居群总遗传多样性指数( H t )= 0.162 8 (标准偏差为0.037 6 ),居群内遗传多样性指数( H s )= 0.063 3 (标准偏差为0.006 4 ),基因分化系数( G st )= 0.610 9 ,基因流( N m )=0.318 5 ,说明有61.09%的遗传变异出现在居群间,有38.91%的遗传变异出现在居群内。分子方差分析(AMOVA)结果与上述Popgen计算结果一致。总遗传变异结果显示,有56%的变异发生在居群之间,44%的变异发生在居群内部,这与Nei’s基因多样性结果一致,表明各居群间表现出较高的遗传分化水平。
2.4 亲缘关系及聚类结果分析
如表4所示,11个居群的遗传一致度为0.585~ 0.968,均值为0.836;遗传距离为0.032~ 0.536,均值为0.187。黃花倒水莲居群的遗传一致度为0.833~ 0.968,均值为0.882;遗传距离为0.032~ 0.182,均值为0.126。黄花倒水莲居群中灌阳居群(GY)与恭城居群(GC)间具有最高的遗传一致度(0.968),且遗传距离最小(0.032),而灵川居群(LC)与靖西居群(JX)具有最低的遗传一致度(0.833),遗传距离最大(0.182)。荷包山桂花与黄花倒水莲居群间的遗传一致度为0.585~ 0.652,均值为0.630,遗传距离为0.428~ 0.536,均值为0.462,表明黄花倒水莲、荷包山桂花2个物种之间在遗传上有明显差异。
用NTSYSpc软件基于遗传一致度构建UPGMA聚类图。由图2可以看出,在遗传一致度为0.630处可以将黄花倒水莲居群与荷包山桂花居群(YN)区分开。在黄花倒水莲居群中,恭城居群(GC)与灌阳居群(GY)最先聚在一起,具有最高的遗传一致度;此外,具有较高遗传一致度的还有蒙山居群(MS)与靖西居群(JX)。在遗传一致度为0.867处可将10个地理来源不同的黄花倒水莲居群分为3个类群,第Ⅰ类群是柳州融水居群(RS)和广东罗定居群(GD);第Ⅱ类群包括5个地方的居群,分别为桂林荔浦居群(LP)、崇左天等居群(TD)、百色靖西居群(JX)、梧州蒙山居群(MS)以及湖南永州居群(HN);第Ⅲ类群包括灵川居群(LC)、桂林恭城居群(GC)及桂林灌阳居群(GY)。广西桂林地区的居群大部分聚集在第Ⅲ类群,只有桂林荔浦居群(LP)聚集在第Ⅱ类群,与其他来自桂林的居群间的距离较远。
3 讨 论
遗传多样性是物种对环境适应度的反映,遗传多样性程度越高,代表物种在复杂环境中生存的概率就越大 [14] 。分布范围广的物种通常趋向于具有较高的遗传多样性,分布范围窄的物种则具有较低的遗传多样性 [15] 。一般可用Nei’s基因多样性指数、Shannon多样性指数来评价物种的遗传多样性水平 [16-17] 。本研究利用11条引物对10个黄花倒水莲自然居群、1个荷包山桂花居群的共166个个体进行PCR扩增,共得到132条电泳条带,其中多态性条带有91条,多态性条带占比为68.94%。通过对遗传多样性指数进行计算发现,黄花倒水莲10个居群的Nei’s基因多样性指数的平均值为0.063 4 ,远低于同属植物西伯利亚远志( H = 0.265 6 ) [9] 和Nybom [18] 统计的种群遗传多样性平均值(0.22),表明黄花倒水莲居群间的遗传多样性水平较低。但在物种水平上,黄花倒水莲还保持着较高的遗传多样性( H= 0.163 7 , I= 0.250 1 ),在居群水平上的遗传多样性低而在物种水平上的遗传多样性高的现象也出现在悬钩子属植物中 [13,19] 。由此可以推测,黄花倒水莲的祖先具有较为丰富的遗传多样性,但是随着人类活动愈加频繁,如经常采挖黄花倒水莲、开荒修路等,其种群个体数量、分布范围逐渐下降,使得物种保留着较高的遗传多样性,而居群间则保留着较低的遗传多样性。
Nei’s遗传多样性分析结果( G st = 0.610 9 )表明,黄花倒水莲有61.09%的遗传变异存在于居群间,有38.91%的遗传变异则在居群内部发生,该结果要高于Nybom [18] 统计得出的基于简单重复序列标记(ISSR分子标记)的遗传分化水平( G st = 0.34),同时也高于基于山西西伯利亚远志研究得出的遗传分化水平( G st = 0.526 0 ) [9] ,说明黄花倒水莲的遗传变异主要来自居群间,且遗传分化水平高。研究发现,基因流对种群遗传变异及居群分化的发生具有重要意义,当 N m > 1时,可以抑制各物种遗传漂变和居群间分化的作用,当 N m < 1时,则容易引起各物种遗传漂变和居群间的遗传分化 [20-21] 。而在本研究中,黄花倒水莲居群的 N m = 0.318 5< 1.000 0 ,表明在黄花倒水莲居群间出现了明显的遗传分化,这可能与黄花倒水莲的繁殖方式、生活环境有关。野外调查发现,黄花倒水莲有种子繁殖、根蘖繁殖2种方式,种子成熟后掉落在亲本植株周围,但周围环境较为潮湿,种子极易发霉,大大影响了种子质量,因此其种子繁殖能力较低 [22-23] 。黄花倒水莲生长的区域较为狭窄,主要生长在沟谷丛林边且分布较为零散,因此其后代向外扩散的能力有限。此外,当地居民过度采挖黄花倒水莲野生资源,造成其生境破碎,居群的规模逐渐缩小 [24] ,在上述综合影响下形成了居群间基因流减弱的现象。
综上所述,黄花倒水莲野生居群在居群水平上表现出偏低的遗传多样性,因此在对其合理利用的同时也要进行保护,首先要重点保护的是黄花倒水莲种质的遗传多样性。本研究结果表明,湖南永州居群(HN)、桂林灵川居群(LC)、桂林恭城居群(GC)、梧州蒙山居群(MS)4个居群具有相对较高的Nei’s遗传多样性,因此应将这4个居群优先保护,同时也要保护其他居群的遗传多样性。
参考文献:
[1] 王子威,何中声,刘金福. 黄花倒水莲栽培及利用研究综述[J]. 中国野生植物资源, 2016, 35(4): 48-52.
[2] 陈秀香,梁定仁,黄宝山,等. 广西靖西县传统药市壮药调查初报[J]. 中国中药杂志, 1992(1): 6-7,62.
[3] 戴 斌,丘翠嫦,周丽娜,等. 瑶药“结端旁”(黄花参)的生药学研究[J]. 中国民族医药杂志, 1996(2): 33-34.
[4] 曹后康,韦日明,张可锋,等. 黄花倒水莲多糖对四氯化碳致急性肝损伤小鼠的保护作用[J]. 中药材, 2018, 41(1): 203-206.
[5] 张嫦丽,张可锋,许有瑞,等. 黄花倒水莲的化学成分与药理活性研究进展[J]. 中国药房, 2017, 28(19): 2724-2728.
[6] 陈家宝,潘为高,罗 彭,等. 黄花倒水莲的研究进展[J]. 亚太传统医药, 2018, 14(5): 86-89.
[7] 许立拔,龙 莉,谢凤凤,等. 黄花倒水莲药理研究进展[J]. 壮瑶药研究, 2019(1): 77-82,106.
[8] 李 佳,房敏峰,周天华,等. 主产区远志种质资源遗传多样性的ISSR分析[J]. 中草药, 2010, 41(11): 1881-1885.
[9] 刘 超,秦金山,韩文兰,等. 山西省西伯利亚远志种质资源的ISSR分析[J]. 热带农业科学, 2015, 35(4): 45-50.
[10] 杨栋林,陈治秀,罗慧蓉,等. 广西10个地理居群海菜花遗传多样性的ISSR分析[J]. 分子植物育种, 2021:1-19. https://kns-cnki-net.webvpn.gxnu.edu.cn/kcms/detail/46.1068.s.20210223.1030.008.html.
[11] 张建波,鄢家俊,白史且,等. 基于ISSR标记的野生斑茅居群遗传结构研究[J]. 中国草地学报, 2017, 39(3): 23-30.
[12] 覃信梅,蒋水元,韩 愈,等. 不同特异种质罗汉果的遗传差异及杂交优势预测[J]. 江苏农业学报, 2018, 34(2): 425-431.
[13] 陈宗游,黄夕洋,唐 辉,等. 广西甜茶种质资源遗传多样性的ISSR分析[J]. 园艺学报, 2017, 44(1): 161-169.
[14] 张向前,李予霞,祝建波,等. 古尔班通古特沙漠荒漠肉苁蓉遗传多样性分析[J]. 基因组学与应用生物学, 2019, 38(8): 3675-3680.
[15] 王祎玲,赵桂仿. 七筋菇自然居群的遗传结构分析[J]. 云南植物研究, 2007,29(3): 293-299.
[16] 王晓彤,罗 点,陈 高,等. 对叶百部遗传多样性的ISSR分析[J]. 中草药, 2017, 48(19): 4051-4056.
[17] 张 盾,任梦云,张银东,等. 基于ISSR分子标记的野生山莨菪遗传多样性研究[J]. 中草药, 2018, 49(1): 219-226.
[18] NYBOM H. Comparison of different nuclear DNA markers for estimating intraspecific genetic diversity in plants[J]. Molecular Ecology, 2004, 13(5): 1143-1155.
[19] 和志娇,和加卫,程在全,等. 三叶悬钩子自然居群遗传多样性的ISSR分析[J]. 园艺学报, 2012, 39(11): 2142-2150.
[20] COSTANTINO R F. The genetical structure of populations and developmental time[J]. Genetics, 1968,60(2): 409-418.
[21] WRIGHT S. The genetical structure of populations[J]. Annals of Eugenics,1951, 15(4): 323-354.
[22] 李 斌,费希同,唐军荣,等. ‘黄花倒水莲’离体快繁技术研究[J]. 甘肃农业大学学报, 2016, 51(4): 37-42.
[23] 史艳财,邹 蓉,韦记青,等. 黄花倒水莲种子萌发特性研究[J]. 北方园艺, 2013(19): 159-161.
[24] VOLIS S. Securing a future for China’s plant biodiversity through an integrated conservation approach[J]. Plant Diversity, 2018, 40(3): 91-105.
(責任编辑:徐 艳)
收稿日期:2021-10-13
基金项目:广西科技重大专项(桂科AA18118015);桂林市重大专项(20190101);桂林市科学研究与技术开发计划项目(20190208-3);广西植物功能物质研究与利用重点实验室项目(ZRJJ2018-7、ZRJJ2020-5)
作者简介:苏秀丽(1996-),女,广西贵港人,硕士研究生,研究方向为生物化学与分子生物学。(E-mail)1808891670@qq.com
通讯作者:黄夕洋,(E-mail)57643787@qq.com;唐 辉,(E-mail)913529761@qq.com
