软枣猕猴桃性别相关的SRAP分子标记
2017-02-15李旭吴松权姜明亮朴一龙
李旭+吴松权+姜明亮+朴一龙

摘要:以软枣猕猴桃成龄雌株、雄株叶片为试验材料,利用SRAP分子标记手段及SPSS软件对统计数据进行聚类分析,结果表明,从初筛的80对引物中筛选出15对可稳定扩增出多态性条带的引物组合,19个雌、雄植株共得到77个条带,多态性条带为72个,多态率达到93.50%;雌株多态性比率为68.8%,雄株多态性比率为87.0%;me2-em1、me6-em6、me7-em5、me7-em7这4对引物的扩增结果表现出雌雄株间的多态性比率具有明显差异;供试的19个植株经聚类分析分成2组,2组中均有70%以上表现出相同的性别。基于性别相关的SRAP可以有效分辨出软枣猕猴桃雌株、雄株。
关键词:软枣猕猴桃;雌雄异株;性别鉴定;SRAP;分子标记
中图分类号: Q943文献标志码:
文章编号:1002-1302(2016)08-0069-03
软枣猕猴桃[Actinidia arguta (Seib.et Zucc.)Plangch.ex Miq.]是猕猴桃科猕猴桃属中水平和垂直分布最广泛的多年生落叶藤本果树之一[1],我国南北各地、朝鲜、日本、俄罗斯均有分布,以我国东三省资源最为丰富,其中,小兴安岭和长白山山区较为多见,是珍贵的抗寒果树资源。软枣猕猴桃果实富含维生素C、酚类物质、类胡萝卜素及多种矿质元素,具有一定的药用价值。目前,软枣猕猴桃作为第3代猕猴桃,受到世界各国的广泛关注,其产业开发正蓬勃发展。但是,软枣猕猴桃为雌雄异株植物,以雌株产果实,雌株的经济价值明显高于雄株,而软枣猕猕猴桃实生苗需要5~7年才能结果,童期漫长,且实生繁殖后代出现雌雄比约为1 ∶[KG-*3]4的性别分离[2],不利于生产需要。雌雄异株和幼苗期雌雄无法辨别给软枣猕猴桃种质资源的改良和育种带来巨大困难,因此,软枣猕猴桃的性别鉴定在生产和遗传育种方面有着重要的意义。
分子标记技术具有简单快捷等优点,逐渐成为植物辅助育种的重要手段。DNA 分子标记技术被应用于植物的性别鉴定,提高了植物性别鉴定的准确性和实用性。Michelmore等提出的群体分离分析法(BSA)是一种有效的定位基因方法[3],并据此得到了一些雌雄异株的植物性别连锁DNA标记;Mulcahy等在Silene latifolia中用60条随机引物筛选到4条与性别连锁的RAPD标记[4];Hormaza等通过700条引物的筛选,在Pistacia vera中找到1条单独性别连锁的RAPD标记[5]。相关序列扩增多态性(SRAP)是Li等发展的新型分子标记[6],该标记通过独特的引物设计对可读框(open reading frames,ORFs)进行特异性扩增,具有简便、稳定、产率高、标记分布均匀、多态性强、目的片段便于克隆等特点,已被广泛应用于图谱构建、比较基因组学、基因克隆和亲缘关系等研究[7-10],而在性别决定方面仅应用于少数几种植物中[11-14]。利用SRAP 分子标记技术对软枣猕猴桃性别的相关特异片段研究未见报道。
本研究利用SRAP分子标记技术对软枣猕猴桃的雌、雄基因组DNA差异进行研究,以期为软枣猕猴桃幼苗期性别鉴定、软枣猕猴桃性别相关基因的克隆提供科学依据。同时,SRAP体系的建立为利用SRAP分子标记技术对软枣猕猴桃进行相关研究提供了一定的理论基础。
1材料与方法
1.1试验材料
试验材料于2014年8月取自延边大学野生浆果资源圃(枫林),选取生长势一致、无病虫害的6年生野生软枣猕猴桃雌株、雄株,分别取其成熟叶片,用冰盒保存,迅速带回实验室,液氮速冻。雄株取10个样品,记为X1~X10;雌株取9个样品,记为C1~C9。所用SRAP引物(表1),均由上海生工生物工程技术服务有限公司合成。
采用改良的CTAB法提取软枣猕猴桃各株基因组DNA,用紫外分光光度计分别测定DNA 在波长为260、280 nm处的D值,检测其纯度及浓度;用1.4%琼脂糖凝胶电泳检测DNA的大小和完整性;稀释成浓度為50 ng/μL的工作液,分装,超低温冰箱保存,备用。
1.2软枣猕猴桃的SRAP扩增
SRAP扩增条件在参照邓传良等反应体系[14]的基础上进行优化,确定软枣猕猴桃的SRAP-PCR反应体系(20 μL)为:400 ng基因组DNA,2 μmol/L的正向、反向引物1.0 μL,10×buffer 2.0 μL,2.5 mmol/L dNTP Mixture 0.4 μL,1.25 U/μL Taq酶0.3 μL。PCR扩增反应程序:94 ℃预变性5 min;94 ℃变性1 min,37 ℃复性1 min,72 ℃延伸90 s,15个循环;94 ℃变性1 min,52 ℃复性1 min,72 ℃延伸90 s,35个循环;72 ℃延伸7 min,4 ℃保存。将上下游引物进行自由组合,从80对引物组合的扩增图谱中筛选出带型清晰、雌雄基因组具有明显差异、重复性好且多态性高的引物组合。08%琼脂糖凝胶电泳检测PCR扩增结果,用500万像素数码相机拍照。
1.3数据处理及分析
将清晰可辨的DNA条带进行统计,弱带中稳定的条带予以保留,不稳定的条带忽略不计,计算雌、雄性别特异的条带数,样品间同一迁移位置上的电泳条带记为1,无则记为0。利用SPSS 19.0软件进行欧氏距离平方法聚类分析,按照Ward method离差平方建立聚类分析树状图。
2结果与分析
2.1软枣猕猴桃基因组的SRAP扩增
以构建的软枣猕猴桃雌、雄基因池DNA为模板,从初筛的80对引物中筛选出15对可以稳定扩增出多态性条带的引物组合。由图1、表2可见,多态性位点的分子量主要分布在300~1 000 bp之间,19个雌、雄植株共得到77个条带,多态性条带为72个,多态率达到93.50%;每对引物平均扩增出5.13个条带,多态性条带数为4.80个;雌株多态性比率为68.8%,雄株多态性比率为87.0%;me2-em1、me6-em6、me7-em5、me7-em7这4对引物的扩增结果表现出雌雄株间的多态性比率差异明显;没有出现与性别相关的特异条带,但软枣猕猴桃雌、雄株基因组具有较为明显的差异性。
2.2软枣猕猴桃雌株、雄株聚类分析
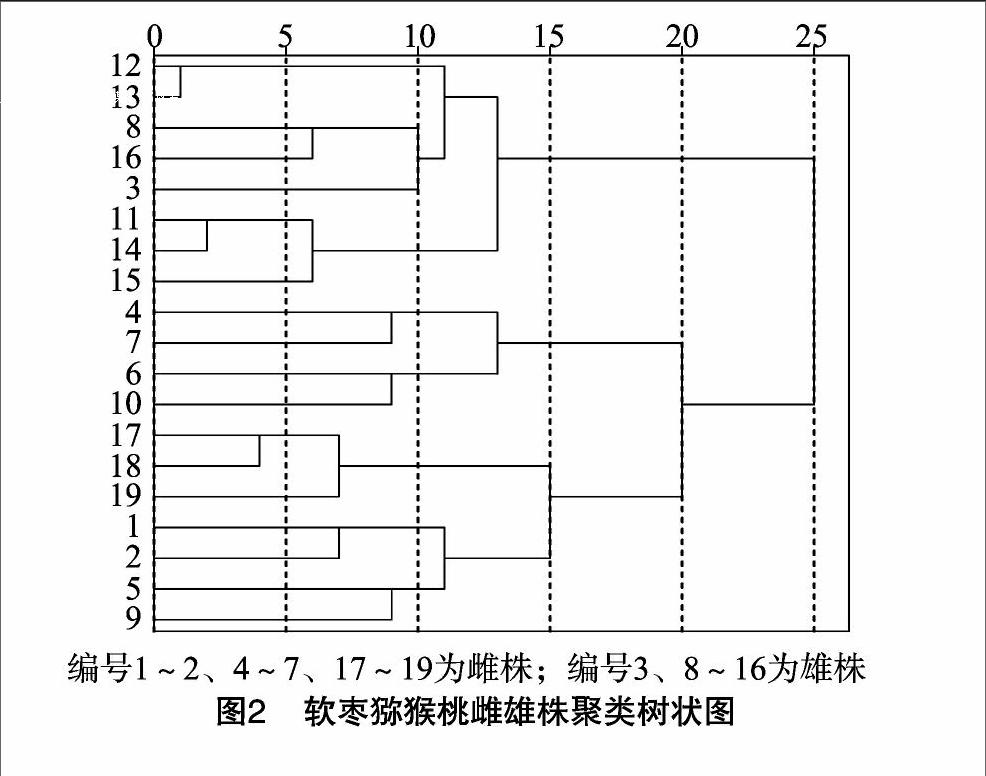
由图2可见,供试的19个植株共分成2大组,组Ⅰ包括8个植株,其中含有2个雄株,编号为3、8,雌株占比为7143%,组Ⅱ包括11个植株,其中含有3个雌株,编号为 17~19,雄株占比为72.73%,2组中均有70%以上表现出相同的性别。猕猴桃为功能性雌雄异株植物,自20世纪70年代发现能结果的雄株以来,经研究发现,猕猴桃在性别表达上几乎呈现连续变异,至少有6种不同的性别表现型[1],软枣猕猴桃性别变异可能是造成约30%分辨不清的原因。基于性别相关的SRAP可以有效分辨软枣猕猴桃的雌株、雄株。
3结论与讨论
SRAP 分子标记技术是对开放阅读框进行的特异扩增,利用该技术对基因组扩增所获取的特异片段直接代表了基因的表达状况,有利于对基因的表达及功能研究[15-18]。吴文珊等将SRAP分子标记应用于薜荔(Ficus pumila Linn.)早期性别鉴定,得到1条雌性多态性片段[19]。郑翠芳等利用SRAP 分子标记技术建立了爱玉子(Ficus awkeotsang Makino.)性别相关的DNA指纹数据库,并获得爱玉子的2个雄性特异片段[11]。Zhou等利用SRAP分子标记技术获得野牛草(Buchloe dactyloides)的1个雌性特异片段[13]。邓传良等利用SRAP分子标记技术获得菠菜(Spinacia oleracea L.)和萚草[Humulus scandens (Lour.) Merr.]性别相关的特异条带[12,14]。
本研究从80对SRAP 引物中筛选出15对多态性较强的引物,利用琼脂糖凝胶电泳分离条带,从19个供试材料中共得到77个条带,多态性条带为72个,多态率达到93.50%;每对引物平均扩增出的条带数为5.13个,多态性条带数为480个;雌株多态性比率为68.80%,雄株多态性比率为8700%;me2-em1、me6-em6、me7-em5、me7-em7这4对引物的扩增结果表现出雌株、雄株间的多态性比率差异明显。软枣猕猴桃性染色体的发育机制与菠菜类似[20],但并没有出现如菠菜那样的特异条带[14],这说明软枣猕猴桃雌株、雄株的基因组具有较为明显的差异性。软枣猕猴桃雌株、雄株聚类分析将供试的19个植株分成2大组,组Ⅰ雌株占比为7143%,组Ⅱ雄株占比为72.73%,2组中均有70%以上表现出相同的性别。目前,在葡萄上已经证实,性别决定基因可能与易受环境影响的一些基因发生互作[21]。因此,本研究软枣猕猴桃存在30%性别分辨不清的原因很可能是由软枣猕猴桃性别变异造成的,基于性别相关的SRAP可以有效分辨软枣猕猴桃雌株、雄株,虽不能达到100%的分辨,但这完全可以符合现阶段软枣猕猴桃性别鉴定工作的需要。
参考文献:
[1]黄宏文. 猕猴桃属分类、资源、驯化、栽培[M]. 北京:科学出版社,2013.
[2]Khukhunaishvili R G,Dzhokhadze D I. Electrophoretic study of the proteins from Actinidia leaves and sex identification[J]. Applied Biochemistry and Microbiology,2006,42(1):117-120.
[3]Michelmore R W,Paran I,Kesseli R V. Identification of markers linked to disease-resistance genes by bulked segregant analysis:a rapid method to detect markers in specific genomic regions by using segregating populations[J]. Proceedings of the National Academy of Sciences of the United States of America,1991,88(21):9828-9832.
[4]Mulcahy D L,Weeden N F,Kesseli R,et al. DNA probes for the Y-chromosome of Silene latifolia,a dioecious angiosperm[J]. Sexual Plant Reproduction,1992,5(1):86-88.
[5]Hormaza J I,Dollo L,Polito V S. Identification of a RAPD marker linked to sex determination in Pistacia vera using bulked segregant analysis[J]. Theoretical and Applied Genetics,1994,89(1):9-13.
[6]Li G,Quiros C F. Sequence-related amplified polymorphism (SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J]. Theoretical and Applied Genetics,2001,103(2/3):455-461.
[7]陳晖,陈美霞,陶爱芬,等. 长果种黄麻SRAP标记遗传连锁图谱的构建及3个质量性状基因定位[J]. 中国农业科学,2011,44(12):2422-2430.
[8]Li G,Gao M,Yang B,et al. Gene for gene alignment between the Brassica and Arabidopsis genomes by direct transcriptome mapping[J]. Theoretical and Applied Genetics,2003,107(1):168-180.
[9]刘雅辉. 23个小麦抗叶锈病近等基因系的SRAP多态性分析及Lr19的SRAP标记[D]. 保定:河北农业大学,2007.[ZK)]
[10]李梅,侯喜林,郝日明. 基于SRAP分子标记的桂花品种亲缘关系研究[J]. 园艺学报,2009,36(11):1667-1675.
[11]郑翠芳,朱晓东,方丽娜,等. 爱玉子性别与品系的SRAP分析[J]. 热带作物學报,2009,30(12):1740-1745.
[12]邓传良,任映雪,张卫丽,等. 葎草性别相关SRAP分子标记的鉴定[J]. 植物研究,2014,34(6):798-802.
[13]Zhou Y J,Wang X G,Zhang X Q. Development and application of a SRAP marker for the identification of sex in Buchloe dactyloides[J]. Euphytica,2011,181(2):261-266.
[14]邓传良,曹莹,任映雪,等. 菠菜性别相关SRAP分子标记的筛选及分析[J]. 基因组学与应用生物学,2013,32(4):516-521.
[15]李媛媛,沈金雄,王同华,等. 利用SRAP、SSR和AFLP标记构建甘蓝型油菜遗传连锁图谱[J]. 中国农业科学,2007,40(6):1118-1126.
[16]刘雅辉,王秀萍,鲁雪林,等. 棉花耐盐相关序列扩增多态性(SRAP)分子标记筛选[J]. 江苏农业学报,2015,31(3):484-488.
[17]刘雅辉,王秀萍,鲁雪林,等. 26份棉花耐盐相关种质资源遗传多样性SRAP分析[J]. 江苏农业学报,2014,30(1):219-221.
[18]荆赞革,裴徐梨,唐征,等. 青花菜早中熟种质资源遗传多样性SRAP标记分析[J]. 江苏农业科学,2014,42(1):41-43.
[19]吴文珊,朱晓东,陈友铃. 与薜荔性别相关的SRAP分子标记[J]. 应用与环境生物学报,2008,14(5):688-691.
[20]Janick J. Inheritance of sex in tetraploid spinach[J]. Am Soc Hort Sci,1955,66:361-363.
[21]Moore J N. Cytokinin-induced sex conversion in male clones of Vitis species[J]. Am Soc Sci,1970,95:387-393.
