灰飞虱脂肪酶LsLPS的原核表达及Ni-NTA纯化
2022-07-16王利华张玉郑州廷曹越纪锐方继朝
王利华 张玉 郑州廷 曹越 纪锐 方继朝




摘要: 灰飞虱是危害中国水稻的3种主要稻飞虱之一。脂肪酶是脂肪代谢的关键酶,在昆虫发育、繁殖等生理活动中具有重要作用。为了深入研究脂肪酶( LsLPS )在灰飞虱生长发育中的功能,本研究克隆了 LsLPS 基因ORF序列,并进行了原核表达和His标签融合蛋白的纯化。结果显示,灰飞虱 LsLPS 开放阅读框长1 293 bp,可翻译成430个氨基酸,含有信号肽序列和PF00151结构域。 LsLPS 连接到原核表达载体pET28a(+)-SUMO、pCold I后在表达菌株BL21(DE3)中主要以包涵体形式表达,连接到pET43.1a(+)后可在表达菌株BL21(DE3)中可溶性表达。采用pH 8.0、含20 mmol/L 咪唑的磷酸缓冲液作为平衡液,Ni-NTA纯化LsLPS-pET43.1a(+)融合蛋白的纯度和产量相对较高。
关键词: 灰飞虱; 脂肪酶; LsLPS 基因; 原核表达; Ni-NTA纯化
中图分类号: S435.112+.3 文献标识码: A 文章编号: 1000-4440(2022)03-0611-06
Prokaryotic expression and Ni-NTA purification of lipase LsLPS from Laodelphax striatellus
WANG Li-hua 1,2 , ZHANG Yu 1,2 , ZHENG Zhou-ting2, CAO Yue2, JI Rui2, FANG Ji-chao2
(1.College of Plant Protection, Nanjing Agricultural University, Nanjing 210095, China; 2.Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract: Small brown planthopper (SBPH), Laodelphax striatellus , is one of the three main rice planthoppers damaging rice in China. Lipase is the key enzyme in fat metabolism and plays an important role in insect development, reproduction and other physiological activities. In order to investigate the function of lipase in the growth and development of SBPH, the ORF sequence of LsLPS gene was cloned, and the fusion protein with a His-tag was purified. The results showed that the open reading frame of LsLPS was 1 293 bp in length and could be translated into 430 amino acids, containing signal peptide sequence and PF00151 domain. LsLPS fusion proteins expressed using prokaryotic expression vectors pET28a(+)-SUMO and pCold I were mainly in the form of inclusion bodies in the expression strain BL21(DE3). After connecting LsLPS with pET43.1a(+) vector, the obtained proteins were expressed in soluble forms in BL21(DE3). The purity and yield of the fusion protein purified by Ni-NTA were relatively higher using phosphate buffer (pH 8.0) containing 20 mmol/L imidazole as equilibrium solution.
Key words: Laodelphax striatellus ; lipase; LsLPS gene; prokaryotic expression; Ni-NTA
灰飛虱( Laodelphax striatellus )属于半翅目飞虱科害虫,通过直接刺吸韧皮部或者传播病毒病危害禾本科作物,是江淮稻区重要水稻害虫之一。脂肪酶可将甘油三酯水解成甘油和脂肪酸,是生物脂肪水解的关键酶。在昆虫中,还存在许多催化中心基序变异的脂肪酶,不具备水解脂肪的能力,但可在繁殖等其他生理过程中起作用,如某些双翅目昆虫中的中性脂肪酶、鳞翅目昆虫的酸性脂肪酶,可充当卵黄蛋白 [1] 。
原核表达是研究基因离体功能的重要前提和手段。目前用于原核表达的质粒主要有pET、pGEX、pCold等系列质粒。这些质粒含有不同的启动子和融合表达标签,可适应不同蛋白质表达的需求。如pET系列载体,含有 T7强转录子,具有基础表达水平低、诱导表达水平较高等优点,在昆虫外源基因原核表达中被广泛应用 [2-7] 。
His标签是蛋白质原核表达常用的融合表达标签之一,具有促进目标蛋白质表达、对目标蛋白质理化性质和晶体结构影响小、纯化操作简便等优点,在生物蛋白质功能研究中被广泛使用 [8-12] 。His标签融合蛋白的纯化常采用Ni-NTA琼脂糖纯化树脂,其His标签可与Ni 2+ 螯合,从而使融合蛋白结合到纯化介质上。纯化缓冲液可能影响His标签融合蛋白的可溶性、稳定性、与基质的竞争性结合等 [13-16] ,从而影响Ni-NTA纯化效率。本研究通过筛选不同原核表达载体,实现了灰飞虱脂肪酶 LsLPS 的可溶性表达,在此基础上,比较了不同化学组成、pH或咪唑浓度缓冲液纯化的His标签融合蛋白的纯度和产量,其研究结果不仅可为 LsLPS 的功能研究奠定基础,也可为His标签融合蛋白的纯化提供参考。
1 材料与方法
1.1 灰飞虱脂肪酶 LsLPS 基因序列分析
灰飞虱脂肪酶 LsLPS 基因序列从转录组数据库中获得,其ORF序列经RT-PCR克隆测序验证。采用在线生物学软件Computer PI/Mw计算LsLPS蛋白的理论相对分子质量和等电点;采用SignalP-5.0 Server预测潜在的信号肽剪切位点及其位置;采用TMHMM Server v. 2.0预测跨膜螺旋区域;采用Pfam分析蛋白质家族;采用ScanProsite预测是否存在丝氨酸活性位点。
1.2 灰飞虱脂肪酶 LsLPS 原核表达
设计含同源臂的引物进行RT-PCR(引物序列见表1),扩增 LsLPS ORF序列,然后连接到空白载体pET22b(+)、pET28a(+)、pET28a(+)-SUMO、pCold I、pET43.1a(+),转化DH5 α 。挑单克隆测序,将测序正确的序列转化表达菌株BL21(DE3)。扩大培养后取1 ml菌液加入终浓度10%的甘油保存,其余菌液加入终浓度为0.5 mmol/L 的IPTG诱导目标蛋白质表达,收集菌体,超声破碎后采用12% SDS-PAGE检测表达情况。对检测有可溶性表达的菌株,取100 μl甘油保存的表达菌株,加入20 ml LB培养基中过夜培养,然后按照1%的比例转入新鲜的培养基中,恒温摇床培养,培养至 OD 600 约为0.6时,加入终浓度为0.5 mmol/L 的IPTG,37 ℃诱导4 h。离心收集菌体后,采用30 ml缓冲液重悬菌体,充分混匀后,平均分为6份,10 000 r/min 离心5 min,重新收集菌体,-80 ℃ 贮存用于Ni-NTA纯化。
1.3 蛋白质SDS-PAGE凝胶电泳
SDS-PAGE凝胶电泳采用碧云天生物技术公司SDS-PAGE凝胶快速配制试剂盒。上层胶浓度为5%,下层胶浓度为12%。待凝胶凝固后将6 μl样品加入凝胶孔中,80 V电泳20 min,然后120 V电泳约60 min,至溴酚蓝指示带迁移至凝胶近底部位置。凝胶染色采用R250染色液。
1.4 融合蛋白Ni-NTA纯化
分别采用Tris-HCl缓冲液(含20 mmol/L 咪唑,pH 8.0)、磷酸缓冲液(分别含0 mmol/L 、20 mmol/L 、50 mmol/L 咪唑,pH 8.0;或者含20 mmol/L 咪唑,pH分别为7.5或8.5)重悬-80 ℃ 贮存的菌体,超声破碎后,4 ℃ 12 000 r/min离心20 min,将上清液转移至新离心管中,相同条件,再离心1次。取上清液,加入平衡好的层析柱中进行Ni-NTA纯化,具体步骤参考TransGen试剂盒说明书。待上清液流出后,用10倍柱体积平衡液洗涤层析柱,直到洗出液达到 OD 280 基线值。然后依次采用50 mmol/L 、100 mmol/L 、200 mmol/L 、300 mmol/L 咪唑溶液进行梯度洗脱,收集洗脱液,利用Bradford快速检测洗脱液中蛋白质的浓度;收集洗脱液,用Bradford试剂检测,保留有明显蓝色的洗脱液。过夜后透析,即得纯化的融合蛋白溶液。
1.5 融合蛋白纯度和浓度测定
融合蛋白纯度根据SDS-PAGE凝胶电泳条带灰度值计算。采用ImageJ扫描电泳条带,以目标条带灰度值除以所有条带灰度值总和得到目标蛋白质的纯度 [17] 。融合蛋白质浓度测定采用碧云天BCA试剂盒,具体步骤参考试剂盒说明书。融合蛋白产量= 纯化蛋白总产量× 融合蛋白纯度;纯化蛋白总产量=纯化蛋白浓度×纯化蛋白总体积。
2 结果与分析
2.1 灰飞虱脂肪酶 LsLPS 基因序列特征
灰飞虱脂肪酶 LsLPS 基因开放阅读框长1 293 bp,可翻译成430个氨基酸(图1)。理论相对分子质量为47 900 ,等电点为5.47。含有信号肽序列和PF00151结构域,属于胰脂肪酶家族,与豌豆蚜( Acyrthosiphon pisum )、桃蚜( Myzus persicae )脂肪酶 H 的氨基酸序列具有58%的一致性,但无脂肪酶的丝氨酸活性中心PS00120。其氨基酸序列第238位和243位氨基酸为苯丙氨酸,而丝氨酸活性中心在第238位对应位置的氨基酸为亮氨酸、异亮氨酸或缬氨酸,第243位对应位置的氨基酸为组氨酸、酪氨酸、色氨酸或缬氨酸(图1)。
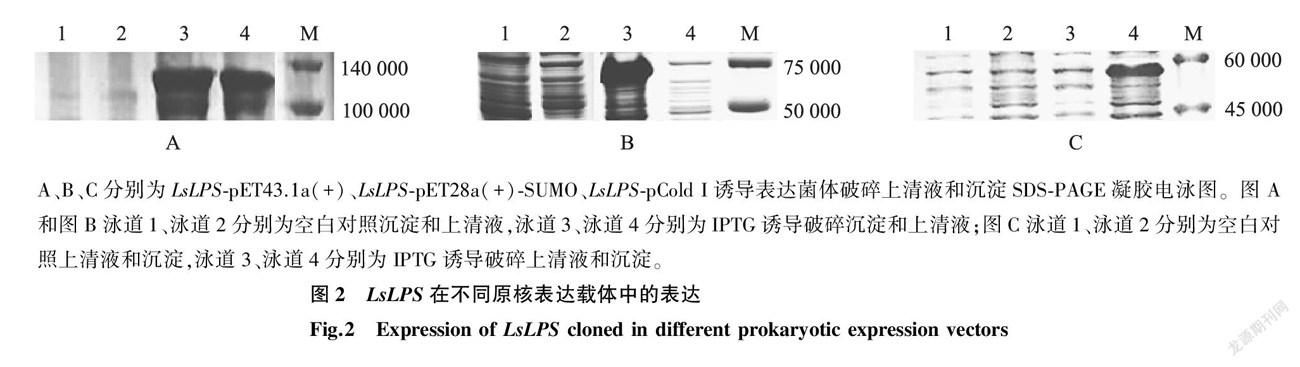
2.2 灰飞虱脂肪酶 LsLPS 在不同载体中的原核表达
灰飞虱脂肪酶 LsLPS 在5个原核表达载体pET28a(+)、pET22b(+)、pET28a(+)-SUMO、pCold I 、pET43.1a(+)中的表达情况如图2所示。 LsLPS -pET28a(+)-SUMO、 LsLPS -pCold I表达的融合蛋白存在于重组大肠杆菌包涵体中, LsLPS -pET43.1a(+)表達的融合蛋白存在于菌体破碎的上清液和包涵体中, LsLPS -pET22b(+)、 LsLPS -pET28a(+)在重组大肠杆菌中无明显表达。
2.3 LsLPS-pET43.1a(+)融合蛋白Ni-NTA纯化产量和纯度比较
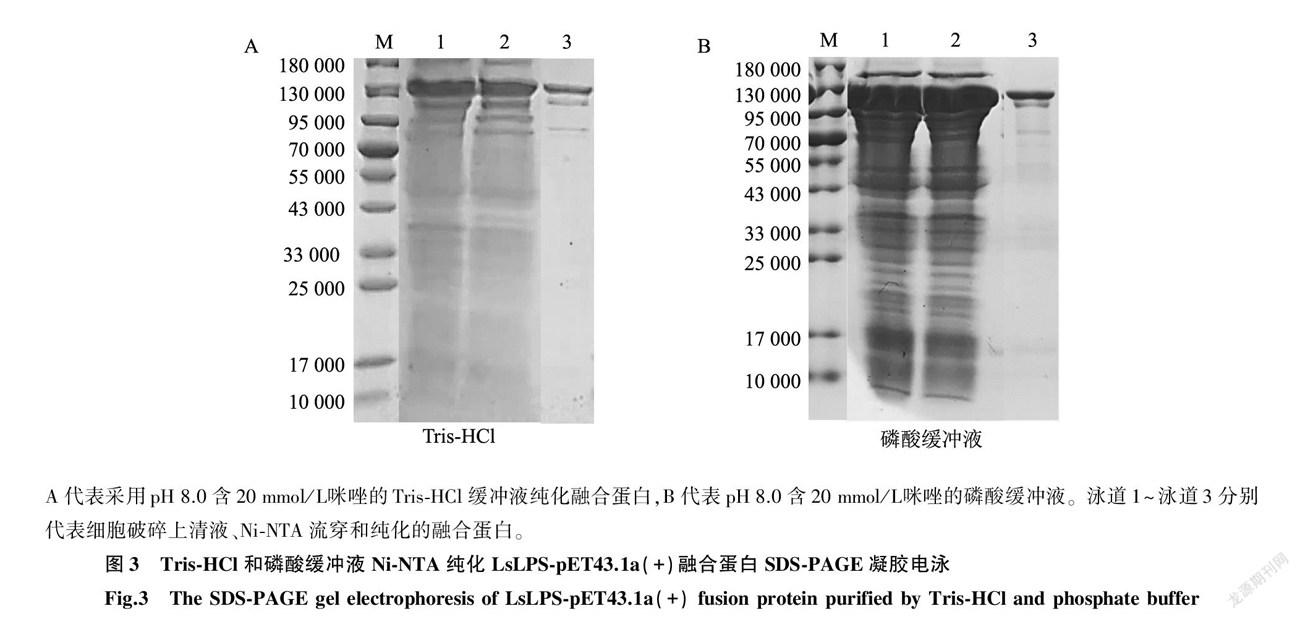
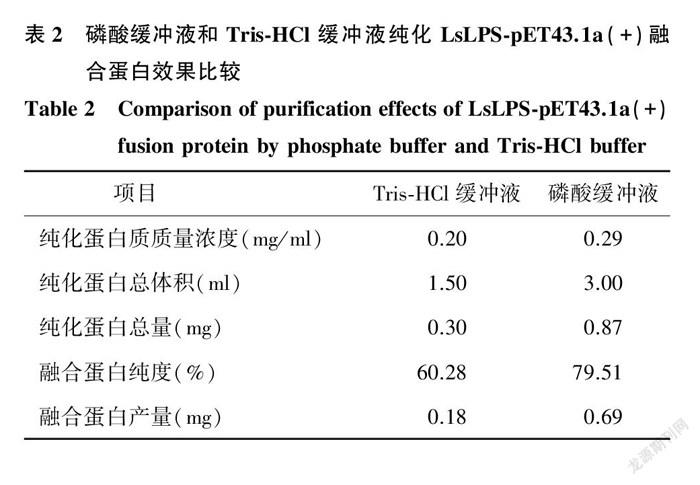
2.3.1 Tris-HCl缓冲液和磷酸缓冲液纯化效果比较 采用Tris-HCl或磷酸缓冲液纯化LsLPS-pET43.1a(+)融合蛋白时,均可纯化到目标蛋白质(图3),但这2种缓冲液获得的融合蛋白产量和纯度存在较大的差异(表2)。
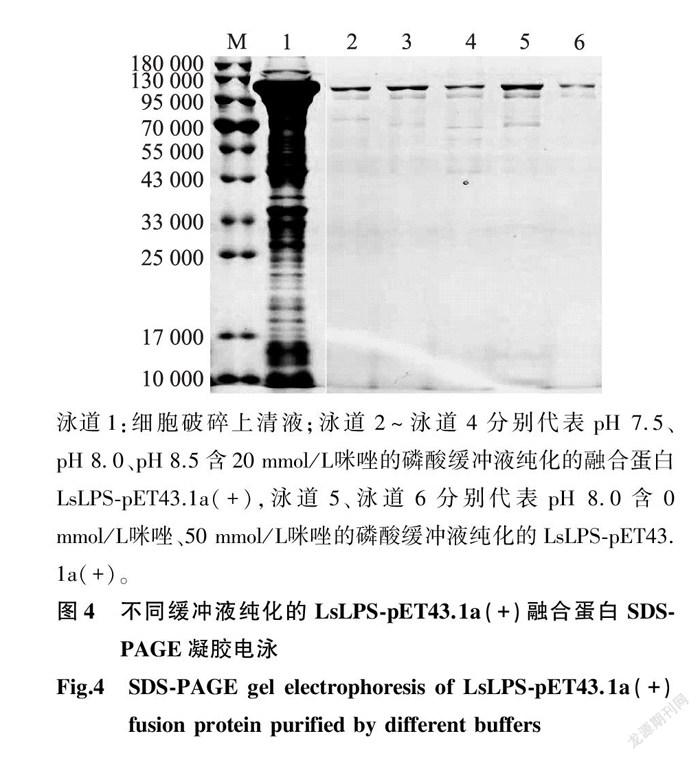
2.3.2 不同pH值磷酸缓冲液纯化LsLPS-pET43.1a(+)融合蛋白效果比较 不同pH值磷酸缓冲液纯化LsLPS-pET43.1a(+)融合蛋白的产量和纯度不同(表3、图4)。当缓冲液pH值为8.0时,融合蛋白的产量和纯度都相对较高。
2.3.3 含不同浓度咪唑的磷酸缓冲平衡液纯化LsLPS-pET43.1a(+)融合蛋白效果比较 平衡液采用含不同浓度咪唑的磷酸缓冲液时,LsLPS-pET43.1a(+)融合蛋白的纯化效果也不同(表4、图4)。含20 mmol/L 咪唑的磷酸缓冲液作为平衡液时,融合蛋白产量分别为含0 mmol/L 和50 mmol/L 咪唑的磷酸缓冲液的1.3倍和7.0倍。但融合蛋白的纯度以含50 mmol/L 咪唑的磷酸缓冲液最高,其次为含20 mmol/L ,含0 mmol/L 咪唑的磷酸缓冲液获得的融合蛋白纯度最低。
4 讨 论
脂肪酶是脂肪水解的关键酶,在微生物、植物、动物中普遍存在。中性脂肪酶具有PF00151保守结构域,在其 N 端一般含有信号肽序列,是昆虫最大的2个脂肪酶家族之一,在脂质消化、储存、繁殖、免疫应答等多种生理活动中起重要作用 [1] 。昆虫约10%的中性脂肪酶缺少催化活性中心基序,不能水解脂肪,但可作为雌虫卵黄蛋白、雄虫副腺蛋白等行使功能 [1,18] 。灰飞虱脂肪酶 LsLPS 含有PF00151结构域, N 端具有信号肽序列、但无催化中心基序,推测该脂肪酶极有可能无水解脂肪的活性,而是在其他生理活动中起作用。
灰飞虱 LsLPS 在大肠杆菌中的表达受表达载体融合表达标签、启动子等影响,大肠杆菌转录延长的抗终止因子(NusA)等标签促进 LsLPS 的表达。外源基因原核表达常因表达宿主缺乏合适的转录、翻译后加工机制,使其表达产物不能正确折叠和修饰,难以获得大量可溶性蛋白质。添加恰当的融合表达标签是提高外源基因可溶性表达的有效策略 [19-21] 。目前常用的融合标签有His标签、硫氧还蛋白质(Trx)、麦芽糖结合蛋白质(MBP)、谷胱甘肽- S 转移酶( GST )、链球菌 G 蛋白质 B1 结构域、小泛素相关修饰蛋白质(SUMO)以及NusA等 [22] 。仅有His标签的质粒pET22b(+) 、pET28a(+)不能实现 LsLPS 的原核表达,但 LsLPS 与NusA标签融合后可实现可溶性表达,与SUMO标签融合后主要以包涵体的形式表达。启动子、翻译增强元件等对 LsLPS 的原核表达也有一定的影响。pCold I载体采用冷休克启动子,含有翻译增强元件(TEE), LsLPS 连接到该载体后也能以包涵体的形式表达。
灰飞虱 LsLPS 融合蛋白的Ni-NTA纯化产量和纯度受缓冲液影响。金属螯合亲和层析中蛋白质和金属离子间的结合强度受金属离子类型、亲和氨基酸残基数量及暴露程度、缓冲液离子类型、pH值大小等因素的影响 [23-26] 。Ni-NTA是纯化His标签融合蛋白的常用方法,其纯化效率受缓冲液化学组成、咪唑浓度、pH值等因素影响。咪唑是His标签融合蛋白竞争性结合剂,可与Ni 2+ 结合,平衡液中低浓度的咪唑可以减少杂蛋白的非特异性吸附,但咪唑浓度过高,可能影响目标蛋白的吸附,从而降低纯化效率 [15,27] 。pH值可能影响蛋白质的溶解性或蛋白质-金属配基的结合 [28-31] ,从而影响Ni-NTA的纯化效率。灰飞虱LsLPS融合蛋白Ni-NTA纯化在采用pH 8.0、含20 mmol/L 咪唑的磷酸缓冲液时目的蛋白质产量和纯度较高,可能与该配方缓冲液咪唑浓度、pH适中有关,这一结果可为下一步 LsLPS 的离体功能研究奠定基础,也可为其他重组蛋白质的Ni-NTA纯化提供参考。
参考文献:
[1] HORNE I, HARITOS V S, OAKESHOTT J G. Comparative and functional genomics of lipases in holometabolous insects [J]. Insect Biochemistry & Molecular Biology, 2009, 39(8): 547-567.
[2] 陈 昊,罗巧玉,马秋雨,等. 松墨天牛漆酶基因MaLac1的克隆,原核表达及表达谱分析[J]. 昆虫学报, 2020,63(4): 381-389.
[3] 杨 安,梅国红,张 浩,等. 淡足侧沟茧蜂气味结合蛋白质MpOBP8的基因克隆及原核表达分析[J]. 应用昆虫学报, 2019, 56(2): 273-282.
[4] 王婷婷,索 倩,孙晓燕,等. 棉铃虫激活增强子结合蛋白质AP-4基因的原核表达、多克隆抗体制备、表达谱分析及功能鉴定[J]. 昆虫学报, 2019, 62(9): 1028-1037.
[5] 魏原杰,王亚美,黄丽娜,等. 棉蚜 P450 CYP6CY3 的克隆,原核表达及多克隆抗体的制备[J]. 中国农业科学, 2017, 50(7): 1351-1360.
[6] 谢红艳,鲁 长,黄春燕,等. 烟粉虱MED隐种气味结合蛋白质基因BtabOBP2和BtabOBP4的cDNA克隆及原核表达[J]. 环境昆虫学报, 2017, 39(4):752-761.
[7] 徐秋芳,陳晴晴,倪海平,等. 灰飞虱原肌球蛋白质的基因克隆、原核表达及多克隆抗体制备[J]. 中国农业科学, 2014, 47(19):3791-3798.
[8] BEN-MAHMOUD S, RAMOS J E, SHATTERS R G J, et al. Cloning and characterization of a basic cysteine-like protease (cathepsin L1) expressed in the gut of larval Diaprepes abbreviatus L. (Coleoptera: Curculionidae) [J]. Journal of Insect Physiology, 2015, 72: 1-13.
[9] PEI Z, BIAN L, ZHANG H, et al. Cloning, expression, and purification of a new antibacterial substance gene from larvae of Musca domestica (Diptera: Muscidae) [J]. Journal of Insect Science, 2014, 14(1): 253.
[10] ACTON T B, XIAO R, ANDERSON S, et al. Preparation of protein samples for NMR structure, function, and small-molecule screening studies [J]. Methods In Enzymology,2011, 493:21-60.
[11] BLOCK H, MAERTENS B, SPRIESTERSBACH A, et al. Immobilized-metal affinity chromatography (IMAC) [J].Methods in Enzymology,2009, 463: 439-73.
[12] CARSON M, JOHNSON D H, MCDONALD H, et al. His-tag impact on structure [J]. Acta Crystallographica Section D: Biological Crystallography, 2007, 63(3): 295-301.
[13] XU W, CAO H, REN G, et al. An AIL/IL-based liquid/liquid extraction system for the purification of His-tagged proteins [J]. Applied Microbiology and Biotechnology, 2014, 98(12): 5665-5675.
[14] WEI T, KAEWTATHIP S, SHING K. Buffer effect on protein adsorption at liquid/solid interface [J]. Journal of Physical Chemistry C, 2009, 113(6): 2053-2062.
[15] HAMILTON S, ODILI J, PACIFICO M D, et al. Effect of imidazole on the solubility of a his-tagged antibody fragment [J]. Hybrid Hybridomics, 2003, 22(6): 347-355.
[16] LAN Q, BASSI A S, ZHU J X, et al. A modified langmuir model for the prediction of the effects of ionic strength on the equilibrium characteristics of protein adsorption onto ion exchange/affinity adsorbents [J]. Chemical Engineering Journal, 2001, 81(1-3):179-186.
[17] GALLAGHER S R. Digital image processing and analysis with imageJ [J]. Current Protocols Essential Laboratory Techniques, 2014, 9(1): 1-29.
[18] HENS K, LEMEY P, MACOURS N, et al. Cyclorraphan yolk proteins and lepidopteran minor yolk proteins originate from two unrelated lipase families [J]. Insect Molecular Biology, 2004, 13(6): 615-623.
[19] KI M R, PACK S P. Fusion tags to enhance heterologous protein expression [J]. Applied Microbiology and Biotechnology, 2020, 104(6): 2411-2425.
[20] LIU Z, HUANG D, FU X, et al. Comparison of three commonly used fusion tags for the expression of nanobodies in the cytoplasm of Escherichia coli [J]. Biotechnology & Biotechnological Equipment, 2018, 16: 1-8.
[21] BANEYX F. Recombinant protein expression in Escherichia coli [J]. Current Opinion in Biotechnology, 1999, 10(5): 411.
[22] 陈爱春,彭 伟,汪生鹏. 亲和标签在重组蛋白质表达与纯化中的应用[J]. 中国生物工程杂志, 2012, 32(12): 93-103.
[23] PATHANGE L P, BEVAN D R, LARSON T J, et al. Correlation between protein binding strength on immobilized metal affinity chromatography and the histidine-related protein surface structure [J]. Analytical Chemistry, 2006, 78: 4443-4449
[24] JOHNSON R D, TODD R J, ARNOLD F H. Multipoint binding in metal-affinity chromatography II. Effect of pH and imidazole on chromatographic retention of engineered histidine-containing cytochromes c [J]. Journal of Chromatography A, 1996, 725: 225-235.
[25] YIP T T, HUTCHENS T W. Immobilized metal ion affinity chromatography [J]. Molecular Biotechnology, 1994, 1(2): 151-164.
[26] HEMDAN E S, ZHAO Y J, SULKOWSKI E, et al. Surface topography of histidine residues: a facile probe by immobilized metal ion affinity chromatography [J].Proceedings of the National Academy of Sciences of the United States of America,1989, 86(6): 1811-1815.
[27] LEE J J, BRULEY D F, KANG K A . Manipulation of the affinity between protein and metal ions by imidazole and pH for metal affinity purification of protein C from Cohn fraction IV-1.[J]. Advances in Experimental Medicine & Biology, 2008, 614(614):93-100.
[28] 楊 健,富天昕,张 舒,等. pH值对米糠清蛋白质和球蛋白质的结构、溶解性及表面疏水性的影响[J].食品科学, 2020, 41(18): 51-57.
[29] ZIDANI S, FAHLOUL D, BACHA A. Effects of pH, NaCl, ethanol, and drying methods on the solubility of Saccharomyces cerevisiae proteins[J]. CyTA - Journal of Food, 2012, 10(1): 42-47.
[30] FRANCO L F M, FILHO P D A P. On the solubility of proteins as a function of pH: mathematical development and application [J]. Fluid Phase Equilibria, 2011, 306(2): 242-250.
[31] 宗绪岩,王世富,李 丽. pH及阳离子浓度对柞蚕蛹蛋白质溶解性的影响[J].蚕业科学, 2005(4): 494-496.
(责任编辑:陈海霞)
收稿日期:2021-11-30
基金项目:江苏省农业科技自主创新基金项目[CX(20)1004];国家自然科学基金项目(31572004);江苏省自然科学基金项目(BK20170072)
作者简介:王利华(1979-),女,四川仁寿人,博士,研究员,主要从事水稻害虫发生规律及防治技术研究。张玉为共同第一作者。
通讯作者:方继朝,(E-mail) fangjc126@126.com;纪 锐,(E-mail)411526774@qq.com
