高脂饮食和酒精依赖对大鼠记忆及前额叶TGF-β/Smad通路的影响
2022-07-15江清梅尹昌浩朱晓峰
江清梅,尹昌浩,朱晓峰
(1.牡丹江医学院;2.牡丹江医学院附属红旗医院神经内三科;3.黑龙江省缺血性脑卒中防治重点实验室,黑龙江 牡丹江 157011)
酒精及高脂饮食的过度食用通常始于青春期,已经成为一个重要的全球健康问题,其相关的并发症逐渐备受大众关注[1]。青少年酒精暴露会导致大脑结构和功能的改变,从而导致行为改变,如焦虑增加、酗酒倾向或认知缺陷[2]。约30%~80%酒精依赖的患者有认知障碍[3]。在大量的动物研究中发现,慢性酒精摄入、高脂饮食造成显著的学习记忆损伤、感觉运动障碍和神经炎症增加[4]。在一项针对酒精依赖患者执行认知任务的功能磁共振成像研究中,该类患者表现出认知网络(PFC、纹状体、小脑)的激活较低[5],说明酒精相关认知障碍与PFC存在重要的联系,但这种联系的具体机制仍不明确。
TGF-β(转化生长因子β)是一个多效性超家族,有三种亚型(TGF-β1、TGF-β2和TGF-β3),参与发育、疾病和组织修复关键步骤的调节。最近的发现表明,患有痴呆的患者的大脑中TGF-β1的含量异常增加,在这些患者的大脑中,神经胶质细胞产生的细胞因子、趋化因子和自由基可能会促进炎症、氧化状态和TGF-β1的慢性过度分泌,从而促进微血管变性[6-7]。本实验目的在于通过建立高脂饮食及酒精依赖大鼠模型,观察大鼠学习记忆能力的变化情况,通过检测PFC中TGF-β1、Smad3、Smad4表达情况探讨其发病机制。
1 材料和方法
1.1 动物分组及造模8周龄(200±20)g雄性SD大鼠24只[由牡丹江医学院比较医学中心提供,动物许可证号为SYXK(黑)2019-006],室温(20±2)℃,光照/黑暗比例12 h∶12 h。经过适应性喂养一周后,按随机区组法将大鼠分为对照组(control,n=8)、酒精组(alcohol,n=8)、酒精+高脂饮食组(alcohol+HFD,n=8)。对照组、酒精组给予正常饲料,酒精+高脂组给予高脂高糖饮食(66.5%基础饲料+10%猪油+20%蔗糖+2.5%胆固醇+1%胆盐),因高脂高糖饲料相对硬度不够,故两天更换一次粮食并给予大鼠磨牙棒;各组均采用单瓶自由饮方式摄入液体,对照组饮用无菌水,酒精组、酒精+高脂饮食组第1周饮用3%的酒精,之后逐渐增加酒精浓度,即每周增加3%,直至第4周增加至12%[8]。
1.2 主要试剂及仪器高脂高糖饲料(小黍有泰生物科技有限公司,北京),伊红染色液(索莱宝G1100),苏木素染色液(索莱宝G1140),β-Actin(Cell Signaling#8457T),P-Smad3一抗(Cell Signaling#9520),SMAD4一抗(Cell Signaling#46535),辣根过氧化物酶标记山羊抗兔IgG(碧云天A0208),Morris水迷宫(成都泰盟软件有限公司),正置显微镜(德国徕卡公司),超灵敏多功能成像仪(美国GE公司)。
1.3 Morris水迷宫实验在造模28 d后,各组大鼠进行为期7 d的Morris水迷宫(直径120 cm,高50 cm)实验,包括:(1)定位航行训练:训练历时6 d,每天上午、下午各一次。实验员将大鼠从水迷宫任意象限面朝池壁入水,大鼠由入水至站立平台(不可见)的时间为潜伏期,限时60 s,电脑通过监视系统追踪大鼠位置记录游行路线,当大鼠发现平台后,让其在平台上站立15 s。若未找到平台,实验员则引导大鼠至平台停留15 s,熟悉周围环境。每只大鼠实验后均用毛巾擦拭或吹风机给予暖风处理,防治动物感冒等不良事件。(2)空间探索试验:第7天撤掉水下平台,取随机一点投大鼠入水,通过监控记录大鼠60 s内第一次到达原平台位置的时间及穿越平台的次数。
1.4 解剖大鼠PFC组织各组大鼠完成Morris水迷宫实验后,腹腔注射10%水合氯醛(0.35 mL/100g)进行麻醉,取PFC,每组各取2只大鼠的PFC由4%多聚甲醛进行固定,其余PFC由-80 ℃冰箱进行保存,完成后续实验。
1.5 显微镜观察大鼠PFC神经元结构4%多聚甲醛固定72 h后经梯度酒精脱水、石蜡包埋、切片进行HE染色,在显微镜下拍照记录各组大鼠PFC神经元结构。
1.6 ELISA检测各组大鼠PFC组织中TGF-β1含量从-80 ℃冰箱取出各组PFC组织,由预冷的PBS清洗,称取15 mg,按照1∶9的重量体积比量取含有蛋白酶抑制剂的PBS,于冰上充分研磨,离心,取上清,在TGF-β1包被的微孔中加入标准品、样本、HRP标记的检测抗体,经过37 ℃温育及洗板、显色,用酶标仪在450 nm波长下测定吸光度(OD值),计算样品浓度。
1.7 蛋白质免疫印迹法检测PFC中P-Smad3、Smad4的表达用预冷的PBS清洗各组PFC20 mg,按照1:10的比例加入含有蛋白酶、磷酸酶抑制剂的裂解液,离心、取上清,用BCA蛋白浓度测定试剂盒检测各组织蛋白浓度,用蛋白上样缓冲液将各组蛋白浓度配平后煮沸变性,进行电泳,转膜,牛奶封闭1 h,用P-Smad3一抗(1∶1000)、Smad4一抗(1∶1000)和抗β-actin抗体(1∶1000)孵育过夜。洗膜后用辣根过氧化物酶标记山羊抗兔IgG(1∶1000)孵育1 h,洗膜后涂加显色剂、曝光。
1.8 统计学分析使用SPSS 24.0软件对实验数据进行统计分析,其图像分析测量软件为 Image J,计量数据表示为“均数±标准差”。多组比较采用单因素方差分析(ANOVA)后进行LSD-t检验。以P<0.05具有统计学意义。
2 结果
2.1 高脂饮食、酒精依赖对大鼠学习记忆能力的影响在定位航行训练中,每组潜伏期逐渐缩短,但每天酒精组、酒精+高脂组大鼠的潜伏期较对照组均延长,在第6天时与对照组潜伏期相比,酒精组(P=0.034)、酒精+高脂组(P=0.022)差异具有统计学意义(表1)。空间探索试验中,记录到对照组经过平台次数为(6.00±0.91)次,酒精组经过平台(4.25±0.53)次,酒精+高脂组大鼠经过(3.60±0.46)次;结果显示,与对照组相比,酒精+高脂组大鼠穿越平台次数显著减少,差异具有统计学意义(P=0.018),表明酒精、酒精+高脂对大鼠学习记忆能力造成了损害作用。
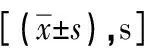
表1 各组大鼠定位航行训练潜伏期
2.2 显微镜观察大鼠PFC神经元结构HE染色观察各组PFC结果显示,对照组锥体细胞数量多,排列整齐紧密,细胞结构正常,核圆且大;酒精组锥体细胞数量有所减少,部分神经细胞出现深染,结构不规则,胞核染色不清晰;酒精+高脂组锥体细胞数量明显减少且形态不规则,神经元细胞深染较多,说明酒精及高脂饮食对大鼠PFC神经元细胞造成了严重损伤(图1)。
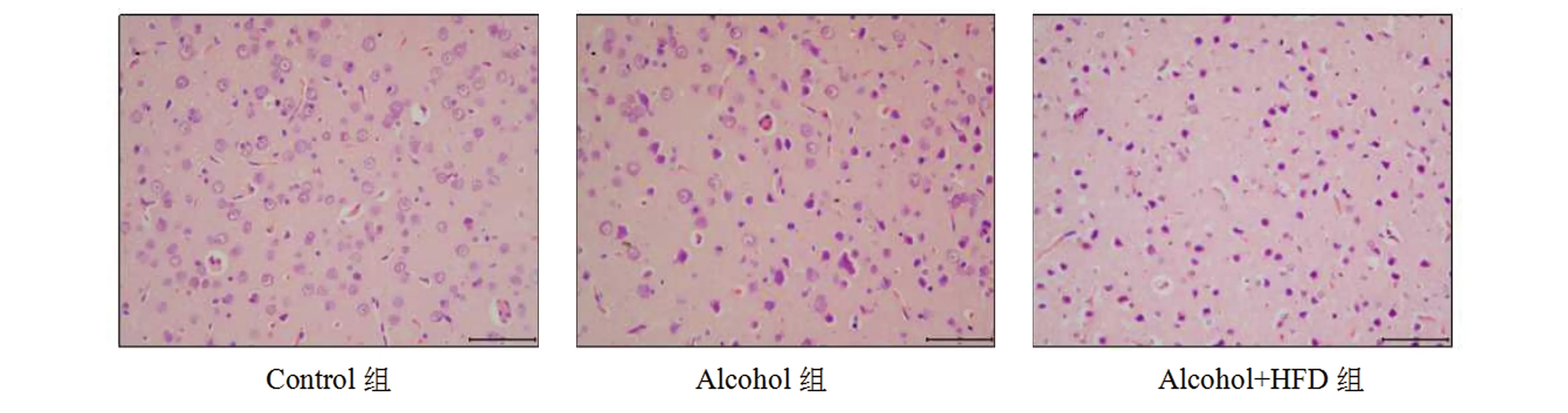
图1 各组大鼠前额叶HE染色对比图(×200)
2.3 酒精及高脂饮食对大鼠前额叶TGF-β1水平的影响本研究结果显示,对照组、酒精组、酒精+高脂组大鼠前额叶TGF-β1表达分别为(1578.75±136.25)pg/mL、(3031.81±431.17)pg/mL、(3824.17±113.04)pg/mL。经统计分析,与对照组相比,酒精组(P=0.043)、酒精+高脂组(P=0.006)大鼠PFC的TGF-β1表达水平显著增高,差异具有统计学意义。
2.4 酒精及高脂饮食对大鼠前额叶皮质P-Smad3、Smad4水平的影响在检测各组P-Smad3表达中,观察到对照组、酒精组、酒精+高脂组大鼠的表达呈上升趋势,酒精+高脂组大鼠的P-Smad3表达与对照组相比,差异具有统计学意义(P=0.035)(图2A、2B);检测Smad4中,与对照组相比,同样是酒精+高脂组大鼠的Smad4表达呈上升趋势,差异具有统计学意义(P=0.011)(图2A、2C)。
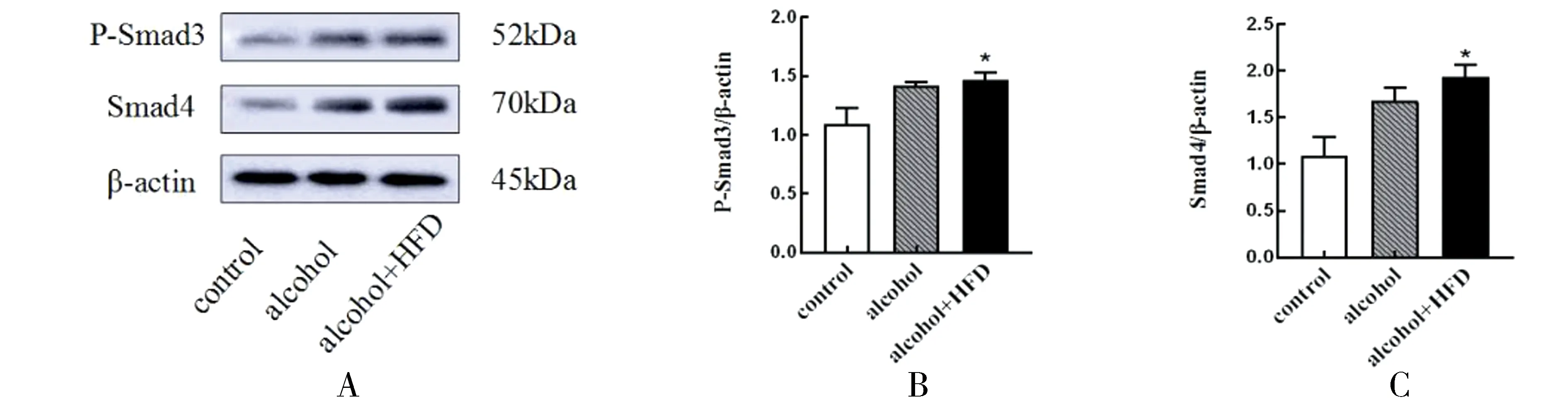
图2 酒精及高脂饮食对大鼠前额叶P-Smad3、Smad4水平的影响
3 讨论
人们在大量摄入高脂饮食及酒精的情况下,直接导致中枢神经系统活动的抑制、脑血管功能的改变和神经毒性,使得早发型认知障碍的出现[9]。在本研究中,大鼠在饮酒、高脂饮食28 d后,进行Morris水迷宫实验,酒精组、酒精+高脂组记忆力较对照组有不同程度损伤,酒精+高脂组损伤较为显著,说明在危险因素双重压力下,认知能力受损比单个危险因素要严重。与既往研究一致,Woods AJ等人[10]研究发现,无论患者年龄大小,既往或现在有酒精依赖史的人都有明显的神经认知障碍,在学习、记忆、运动功能和注意力、任务执行功能等方面存在明显的损伤,并证实这样整体认知障碍的症状与终生酒精依赖史相关。一项针对1159名中国老年人的纵向研究发现,长期高脂饮食造成了总胆固醇和低密度脂蛋白水平升高,这与认知能力加速下降之间存在关联[11]。
PFC似乎对酒精诱导的神经退行性变特别敏感,在本研究中,分别对3个组的PFC进行HE染色,镜下观察到与对照组相比,2个模型组神经元数量减少,细胞形态不规则,存在凋亡细胞,表明酒精、酒精+高脂对大鼠PFC造成了明显的损伤。既往研究表明,大鼠长期摄入酒精及暴饮暴食导致PFC星形胶质细胞突起范围减少[12]。在一项基于体视学系统对酒精对大鼠PFC区域的体积、面积估计的研究中,观察到长期饮酒导致PFC和前扣带回体积减少,PFC平均神经元体积减少且神经元总体积减少[13]。另一项动物研究中,将幼年大鼠暴露于高脂饮食中,发育阶段PFC发生的变化,影响社会记忆和可塑性,表明青少年时期急性摄入高脂饮食与PFC、社会记忆受损有关,并与PFC氧水平降低有关[14]。
酒精及高脂饮食对中枢神经的影响,其机制研究备受人们关注。TGF-β1通过Smad家族的磷酸化蛋白在中枢神经系统和外周器官之间充当信号介质,调节大脑的认知功能机制,其在神经系统中的作用受到了广泛关注。在一项关于的星形胶质细胞对阿尔兹海默病的病理机制研究中发现,淀粉样蛋白前体变性与TGF-β/ Smad信号激活有关,促进星形胶质细胞增生、淀粉样斑块形成和认知障碍加重,表明TGF-β/Smad信号激活与认知功能损害和淀粉样斑块积聚有必然的联系[15]。本实验与既往研究结果一致,在探究酒精、酒精+高脂饮食对大鼠认知功能造成明显损伤作用后,继续采用ELISA、Western blotting法对大鼠PFC中的TGF-β1、P-Smad3、Smad4进行检测,结果显示随着危险因素叠加的对认知损害严重程度的增加。大鼠PFC中的TGF-β1、P-Smad3、Smad4表达逐渐增加,可能是酒精、高脂饮食刺激了前额叶TGF-β/ Smad通路的过度表达,促进神经炎症、细胞外基质化合物的积累和脑血管粥样硬化及β-淀粉样蛋白积聚[6],导致认知障碍。
综上所述,本实验观察了28 d给予大鼠酒精、高脂饮食+酒精喂养后,对大鼠认知行为的改变及PFC神经元变化情况,并观察到PFC内炎症因子TGF-β1、P-Smad3、Smad4表达与认知障碍程度呈正相关,可能与TGF-β/Smad信号通路激活造成大脑中的β-淀粉样蛋白沉积和神经炎性斑块聚集,加重学习和记忆障碍,本研究为预防高脂饮食及酒精依赖相关认知障碍提供了更精准的分子靶点,未来可能通过抑制外周及中枢神经组织中的TGF-β/Smad信号通路的异常增高,来达到预防和治疗认知障碍的目的。
