臭鳜鱼源清酒乳杆菌的分离鉴定及其在臭鳜鱼发酵中的应用
2022-07-07周迎芹孙子怡黄晶晶郑海波谢宁宁
周迎芹,孙子怡,黄晶晶,鄢 嫣,郑海波,谢宁宁,*
(1.安徽省农业科学院农产品加工研究所,安徽 合肥 230031;2.安徽省食品微生物发酵与功能应用工程实验室,安徽 合肥 230031;3.安徽科技学院食品工程学院, 安徽 滁州 239000)
臭鳜鱼又称腌鲜鳜,是利用新鲜鳜鱼为原料,配以食盐、花椒等辅料,由乳酸菌等多种微生物共同发酵制得的发酵鱼制品。传统自然发酵使臭鳜鱼在加热熟化后,具有丰富的营养价值和细腻嫩滑的蒜瓣状肉质以及闻臭吃香的独特风味,市场接受度高,产业需求大。但在传统自然发酵条件下,臭鳜鱼发酵周期相对较长,生产效率低;人工操作过程较为模糊,加工环境控制不严,产品质量变化大,风味品质参差不齐,食用安全性存在潜在风险,使其标准化、工业化生产受到严重阻碍。
微生物接种发酵技术是缩短发酵时间和改善产品品质的有效途径之一。微生物发酵菌种主要来源于传统自然发酵制品,包括乳酸菌、葡萄球菌、微球菌、酵母菌和霉菌等。在传统自然发酵臭鳜鱼中,乳酸菌是其发酵的优势微生物菌群。Dai Zhiyuan等和李燕通过传统微生物分离培养技术,系统研究了臭鳜鱼在发酵过程中的微生物菌群组成,分离得到的乳酸菌主要为清酒乳杆菌()、乳酸乳球菌()、格氏乳球菌()等,在发酵中后期,清酒乳杆菌成为臭鳜鱼中特定的优势乳酸菌。本实验室前期在对臭鳜鱼不同发酵工艺微生物菌群组成解析时发现,清酒乳杆菌也是臭鳜鱼在传统干腌、湿腌工艺中的优势乳酸菌菌群。但目前,在对臭鳜鱼乳酸菌资源的开发利用研究中,鲜见有关清酒乳杆菌在臭鳜鱼中的应用研究报道。基于此,本研究以自然发酵臭鳜鱼为分离基质,对其中的优势乳酸菌——清酒乳杆菌进行分离、鉴定,研究其生物学特性,并结合黄山臭鳜鱼制作工艺,采用清酒乳杆菌接种发酵臭鳜鱼,研究菌株对臭鳜鱼发酵过程中特征蒜瓣的变化以及对质构、色泽和挥发性风味物质的影响,以期为臭鳜鱼发酵基础研究和工业化生产提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
臭鳜鱼:采集于黄山臭鳜鱼加工企业,为传统低温湿法腌制发酵16 d的成品。
鳜鱼():购于东至县大联圩有限公司,品种为秋浦花鳜,规格为0.5~0.6 kg/尾。
1.1.2 培养基
MRS液体培养基(1 L):胰蛋白胨10 g、牛肉膏8 g、酵母粉4 g、葡萄糖20 g、磷酸氢二钾2 g、柠檬酸氢二铵2 g、乙酸钠5 g、硫酸镁0.2 g、硫酸锰0.04 g、吐温-80 1 mL,pH 6.5±0.2。
MRS-溴甲酚绿鉴别培养基(1 L):胰蛋白胨10 g、牛肉膏10 g、酵母粉10 g、番茄汁200 g、葡萄糖10 g、碳酸钙20 g、溴甲酚绿0.1 g、吐温-80 0.5 mL、琼脂18 g,pH 6.0±0.2。
水琼脂培养基(1 L):琼脂粉15 g。
营养琼脂培养基(1 L):胰蛋白胨10 g、牛肉膏3 g、氯化钠3 g、琼脂18 g,pH 7.0±0.2。
培养基均用蒸馏水配制和定容,并经高压灭菌(1.0×10Pa,20 min)后备用。
1.1.3 试剂
食用钠盐、花椒等调料 市购;氯化钠、氢氧化钠、无水乙醇 上海阿拉丁生化科技股份有限公司;乳酸菌生化鉴定试剂盒 青岛高科技工业园海博生物技术有限公司;细菌DNA提取试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)聚合酶 北京天根生物有限公司。所有化学药品均为分析纯。
1.2 仪器与设备
ZWY-240恒温振荡培养箱 上海智城分析仪器制造有限公司;T100 PCR仪 美国Bio-Rad公司;JY600C电泳仪 北京君意东方电泳设备有限公司;H1750R高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;CR-400色差分析仪 柯尼卡美能达控股公司;TA. XT Plus质构仪 英国Stable Micro System公司;FlavourSpec气相色谱-离子迁移谱(gas chromatography-ion mobility spectrometry,GC-IMS)联用仪 德国G.A.S.公司;臭鳜鱼腌制发酵专用装置由本实验室自行设计。
1.3 方法
1.3.1 清酒乳杆菌的分离鉴定
在无菌条件下,取臭鳜鱼鱼肉打成鱼糜,用无菌生理盐水将鱼糜样品稀释至适当浓度,划线于MRS-溴甲酚绿平板上,进行厌氧培养(30 ℃,48 h)。挑取平板上呈黄色、有溶钙圈的菌落进行重复划线培养,至菌株纯化。通过革兰氏染色、生理生化实验,完成对疑似乳酸菌菌株的初步筛选。
根据纯化菌株在MRS-溴甲酚绿平板上的菌落特征,挑选符合清酒乳杆菌独特菌落特征的菌株,即中心深绿色而周围为浅绿色的菌落,进一步进行扫描电镜观察。通过细菌基因组提取试剂盒提取该菌基因组DNA,以通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)、1492R(5’-CTACGGCTACCTTGTTACGA-3’)进行PCR扩增。扩增体系(50 μL):20 ng/μL模板1.0 μL,含2.5 mmol/L Mg的10×Buffer 5.0 μL,10 μmol/L上/下引物各1.5 μL,10 mmol/L dNTP 1.0 μL,5 U/μL聚合酶1.0 μL,ddHO 39.0 μL。扩增程序:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃终延伸7 min。将扩增产物送至上海派森诺基因科技有限公司测序。通过MEGA 6.0软件对菌株16S rDNA序列与NCBI乳杆菌属菌株16S rRNA基因序列进行比对分析,并采用Neighbor-Joining法构建系统发育树。
1.3.2 清酒乳杆菌的生物学特性
1.3.2.1 生长条件优化
以厌氧培养至24 h的菌液OD为评价指标,先通过单因素试验,对菌株在MRS液体培养基中的初始pH值(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0),培养温度(4、8、15、20、25、30、37、42 ℃),接种量(0.5%、1.0%、2.0%、3.0%、4.0%、5.0%)进行优化,然后利用Design-Expert 11软件的Box-Behnken试验设计原理设计试验组,以初始pH值、培养温度和接种量3个因素为自变量,菌液OD为响应值,通过响应面分析对培养条件进一步优化,响应面设计因素水平如表1所示。
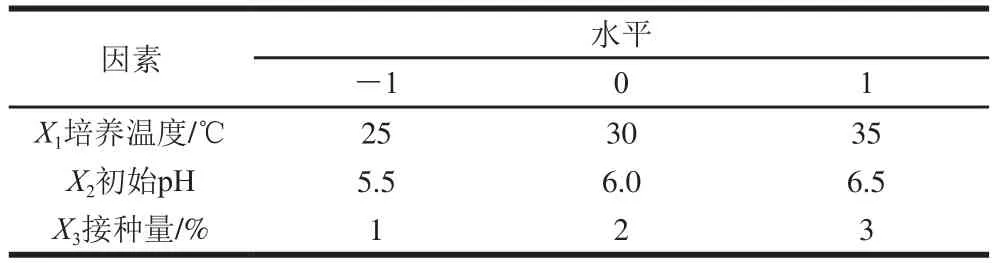
表1 响应面试验设计因素与水平Table 1 evels and codes of variables used for response surface analysis
1.3.2.2 生长、产酸能力测定
将活菌数为1.0×10CFU/mL的SMF-L5种子液,按2%接种量接种于MRS液体培养基,30 ℃厌氧培养24 h,间隔2 h取样,分别以平板琼脂计数法和光电比浊法测定活菌数和培养液OD,绘制生长曲线,用pH计测定pH值和用NaOH溶液滴定法测定菌株产酸量,各指标平行测定3 次。
1.3.2.3 耐盐、抑菌能力测定
将活菌数为1.0×10CFU/mL的SMF-L5种子液,以2%的接种量接种于含0、0.02、0.04、0.06、0.08、0.1 g/mL NaCl的MRS液体培养基中,以培养24 h后的OD为评价指标,测定菌株耐盐能力。
将大肠杆菌()、金黄色葡萄球菌()以及从臭鳜鱼中分离的腐生葡萄球菌()、丁香假单胞菌()分别划线于营养琼脂培养基上,30 ℃培养24 h。挑取单菌落接种于营养肉汤培养基中,以30 ℃、180 r/min培养24 h的培养液作为指示菌菌悬液。
以2%接种量将清酒乳杆菌种子液接种于MRS液体培养基中,30 ℃静置培养18 h,离心(6 000 r/min,10 min)后取上清液,采用牛津杯双层琼脂扩散法检测乳酸菌上清液抑菌特性。即取10 mL灭菌的水琼脂倾注于培养皿底层,待其干后在其上放置牛津杯,每个培养皿放置4个。按100 μL指示菌悬液/20 mL保温至46 ℃的营养琼脂比例进行混合,倾注于放置好牛津杯的培养皿内,待其干后拔下牛津杯,以1 孔作为对照,向其中加入100 μL未接菌的MRS液体培养基,另外3 孔作为平行样品,即向其中加入100 μL清酒乳杆菌上清液,4 ℃扩散2 h,30 ℃静置培养24 h。取出观察并用游标卡尺测量抑菌圈直径,根据抑菌圈直径大小判断菌株抑菌性能。耐盐及抑菌能力测试均设置3个平行样。
1.3.3 清酒乳杆菌对臭鳜鱼食用品质及挥发性物质形成的影响
1.3.3.1 发酵工艺流程
发酵工艺流程:新鲜鳜鱼→宰杀→清洗→码放→腌制→发酵→包装。
传统自然发酵操作步骤如下:a.取新鲜鳜鱼,用鱼鳞刷刷去鱼体表面鱼鳞,再经剖腹宰杀,去除内脏和鱼鳃,用自来水和10%盐水先后清洗一次,沥水待用;b.将鱼平整码放于鳜鱼发酵专用装置内,一桶约码放30 kg,每码一层,撒上若干粒干炒过的花椒(花椒总量为鱼质量的0.1%),码放结束后在上层鱼体上放置按压板;c.向桶内加入提前配制好的腌制液,即0.08 g/mL食盐溶液,以刚好浸没按压板为宜,按压板上放置扁圆状砝码(按压质量为鱼质量的40%),用以将鱼体全部浸压于腌制液液面以下;d.合上发酵装置顶盖,以厌氧发酵方式,8 ℃发酵16 d。
接种发酵则是将步骤c调整为:按1 kg鱼添加1.25 g清酒乳杆菌湿菌体的量,将清酒乳杆菌充分溶于0.08 g/mL食盐溶液中,作为腌制液。其他步骤同自然发酵操作步骤。
发酵结束后,将臭鳜鱼取出,用清水清洗干净,备用。
1.3.3.2 特征蒜瓣观察
用解剖刀沿臭鳜鱼的脊背和鳃盖后沿,将两侧鱼皮划裂,并轻轻剥离至尾部,分别切取同侧、沿背鳍下方至侧线之间的肌肉块,并置于蒸锅中隔水蒸煮10 min,取出室温下冷却后剥离蒜瓣肉,肉眼观察并拍照。
1.3.3.3 色泽、质构测定
参照本实验室建立的方法测定鱼肉的色泽、质构,每个样品平行测定6 次。
1.3.3.4 挥发性风味物质测定
参照本实验室建立的方法,采用GC-IMS测定和分析样品的挥发性风味物质,每个样品进行3 次平行测定。
1.4 数据处理

2 结果与分析
2.1 清酒乳杆菌的分离与鉴定
利用传统分离培养手段,从自然发酵臭鳜鱼中分离到1 株符合清酒乳杆菌形态学特征的菌株,命名为SMF-L5。SMF-L5菌株在含溴甲酚绿的MRS固体平板上的菌落特征为绿色(中心绿色,周围浅绿色),中央凸起,边缘整齐,表面光滑(图1A);革兰氏染色呈阳性,短杆状排列,菌体大小约为1.0 μm×0.5 μm,无芽孢,无鞭毛,单个或成对,成链状排列(图1B、C);可发酵纤维二糖、麦芽糖、水杨苷、蔗糖、菊糖和乳糖(表2)。对菌株SMF-L5的16S rRNA基因进行测序,在GenBank中获得序列登录号为MZ208836。通过NCBI数据库BLAST序列比对和系统发育树分析,证实菌株SMF-L5与6668、JBAR-SPR、subsp.JUL0153等菌株聚类在同一分枝上(图2),因此确定为清酒乳杆菌。
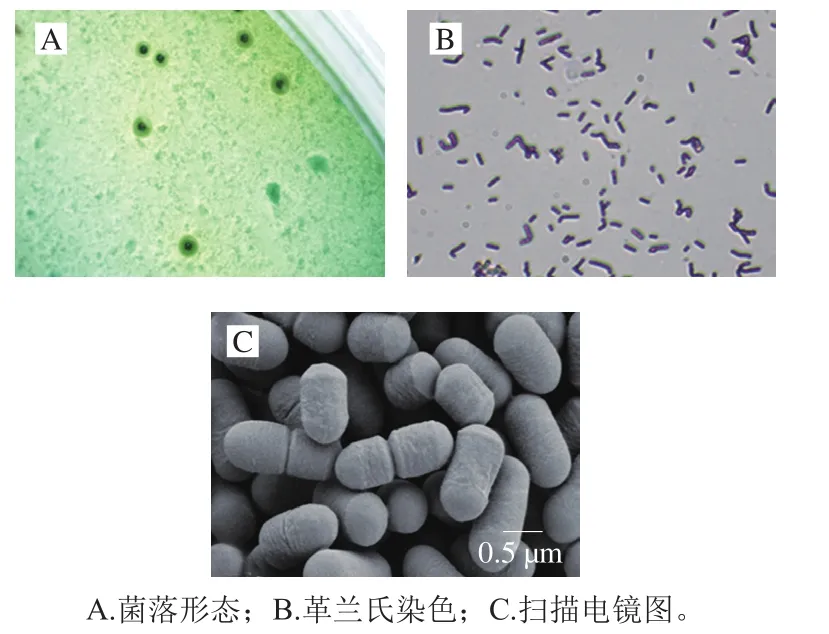
图1 清酒乳杆菌SMF-L5的形态特征Fig. 1 Morphological characteristics of L. sakei SMF-L5

表2 清酒乳杆菌SMF-L5的生理生化特性Table 2 Physiological and biochemical characteristics of L. sakei SMF-L5

图2 基于16S rRNA基因序列构建的系统发育树Fig. 2 Phylogenetic tree based on 16S rRNA gene sequences
2.2 清酒乳杆菌的生物学特性
2.2.1 清酒乳杆菌最适生长条件
通过单因素试验对菌株SMF-L5在MRS液体培养基中的培养条件(初始pH值、培养温度、接种量)进行初步优化。结果显示,当初始pH值为4.0~6.0时,菌液OD随着初始pH值的升高先逐渐升高,至pH 6.0~8.0时,菌液OD稍有下降;在培养温度4~30 ℃时,菌液OD随着温度升高而升高,在30~42 ℃范围内则随着温度升高而下降;菌株初始接种量在0.5%~2%时,菌液OD随接种量增加而升高,至2%~5%时又逐渐降低(图3)。因此,将最适培养条件定为培养温度30 ℃、初始pH 6.0、接种量2%。
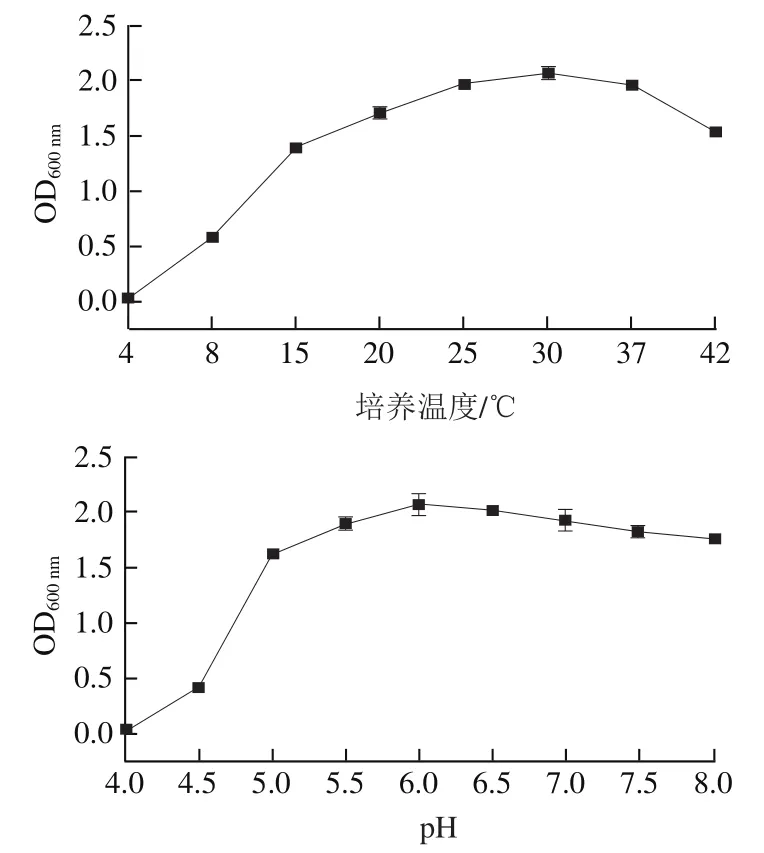

图3 不同培养条件对清酒乳杆菌SMF-L5生长的影响Fig. 3 Effects of different culture conditions on the growth of L. sakei SMF-L5
2.2.2 响应面试验结果
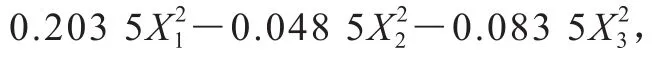
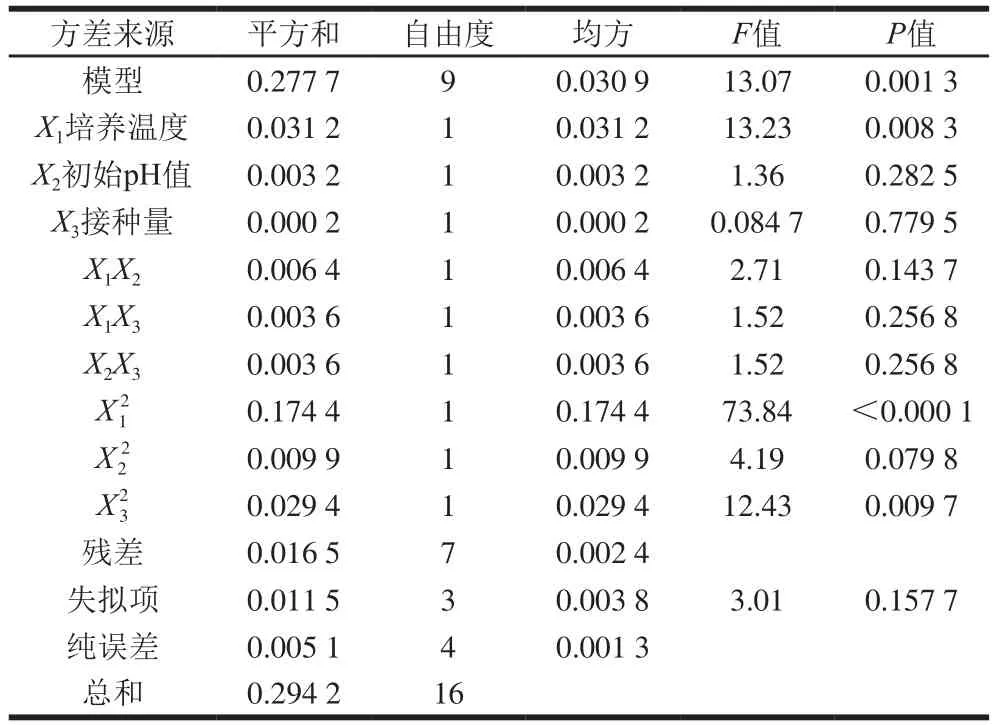
表3 模型回归方程方差分析Table 3 Analysis of variance of quadratic polynomial model
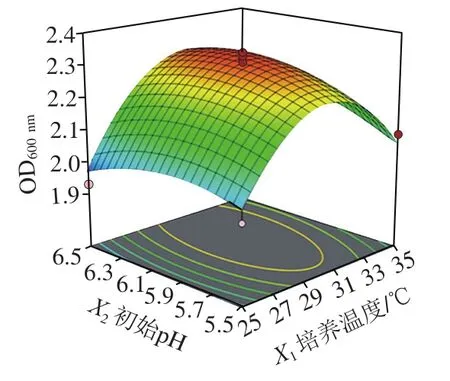
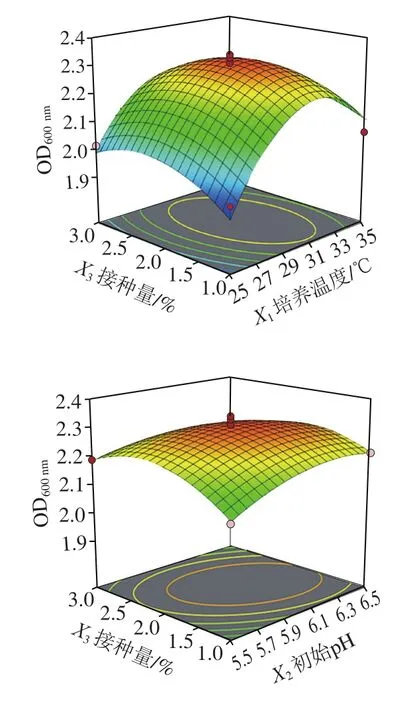
图4 初始pH值、培养温度与接种量交互作用对清酒乳杆菌SMF-L5 OD600 nm影响的响应面图Fig. 4 Response surface plots for individual and interactive effects of initial pH, growth temperature and inoculum on the growth of L. sakei SMF-L5
通过Design-Expert 11软件对回归方程求解得到模型最大值,即培养温度30.9 ℃、初始pH 6.15、接种量1.94%,此时菌体最大生物量达2.31。在最佳培养条件下进行培养验证实验,所得菌体生物量实际值为2.39±0.03,与理论值接近,表明该模型合理。
2.2.3 清酒乳杆菌生长、产酸能力
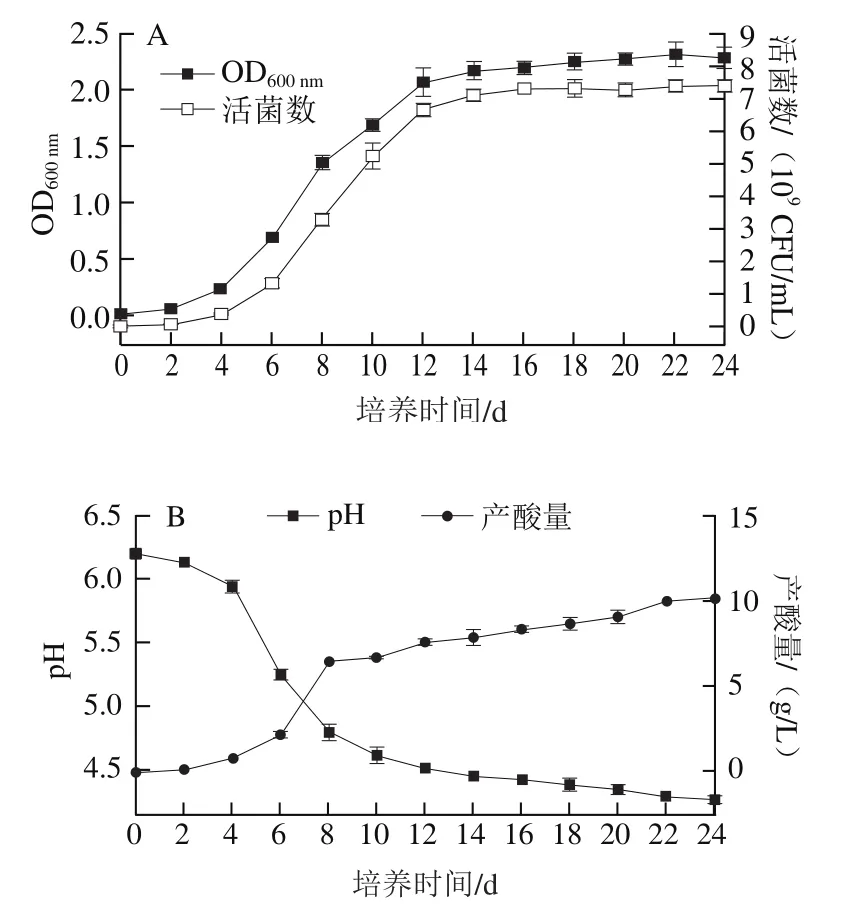
图5 清酒乳杆菌SMF-L5生长(A)、产酸(B)能力Fig. 5 Growth (A) and acid production ability (B) of L. sakei SMF-L5
菌株SMF-L5在培养最初,活菌数约为1.0×10CFU/mL,在4 h进入对数生长期,14~24 h进入生长稳定期,活菌数约达到7.0×10CFU/mL(图5A),结果表明清酒乳杆菌在接种至培养基后具有较强的适应能力和较快的生长速率。菌株在4~14 h对数生长期内,培养基pH值下降速率较快,进入生长稳定期后pH值降至4.2,这与它具有良好的适应性有关,符合菌株的生长曲线规律。在pH值不断下降过程中,菌株也在持续产酸,最大产酸量达到10 g/L(图5B)。表明菌株具有较强产酸能力,能够有效降低发酵体系中的pH值。
2.2.4 清酒乳杆菌耐盐、抑菌能力
2.2.4.1 清酒乳杆菌耐盐能力
在研究菌株SMF-L5耐盐能力时,发现当NaCl添加量在0~0.1 g/mL范围内,菌株生物量下降不明显,至0.04~0.08 g/mL时,生物量有所下降,但OD仍可维持在1.5以上,高于0.08 g/mL后,生物量则下降比较明显,OD低于1.0(图6),表明菌株具有一定的耐盐能力,在较高盐浓度环境中仍可较好地生长和繁殖。

图6 清酒乳杆菌SMF-L5对NaCl的耐受结果Fig. 6 Tolerance of L. sakei SMF-L5 to NaCl
2.2.4.2 清酒乳杆菌抑菌能力
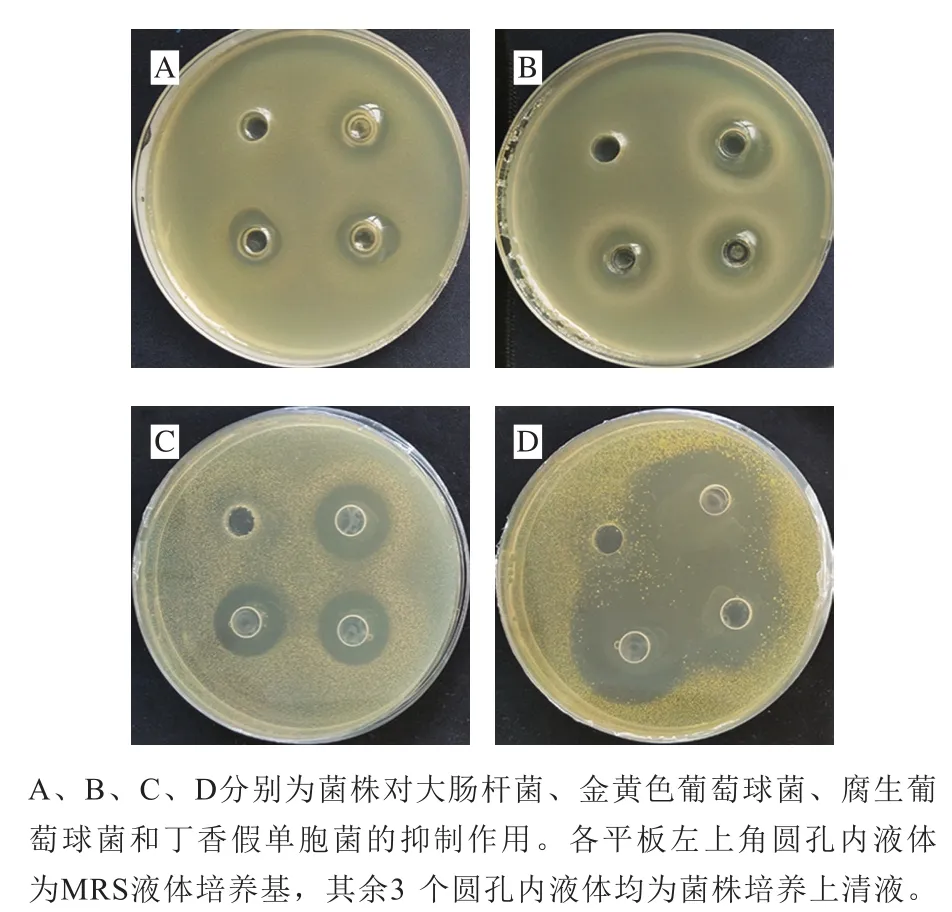
图7 清酒乳杆菌SMF-L5对病原菌的抑制效果Fig. 7 Inhibitory effects of L. sakei SMF-L5 on pathogens
以大肠杆菌、金黄色葡萄球菌以及本实验室在臭鳜鱼中常分离到的丁香假单胞菌、腐生葡萄球菌作为指示菌,研究清酒乳杆菌SMF-L5的抑菌能力,结果如图7所示。SMF-L5菌株培养上清液对所有指示菌均有不同程度的抑制作用。对大肠杆菌、金黄色葡萄球菌的抑菌圈直径分别达到(14.42±0.21)mm和(18.40±0.46)mm,对臭鳜鱼源丁香假单胞菌和腐生葡萄球菌抑菌圈直径分别为(19.24±0.11)mm和(24.66±1.58)mm。
2.3 清酒乳杆菌对臭鳜鱼食用品质及挥发性物质形成的影响
2.3.1 清酒乳杆菌对鱼肉特征蒜瓣的影响
腌制发酵而成的臭鳜鱼,其典型的品质特征为鱼肉呈蒜瓣状。沿背鳍下方至侧线之间的肌肉,其蒜瓣状尤为明显。蒸煮后通过剥离可以发现,通过清酒乳杆菌接种发酵的臭鳜鱼,其肉质的蒜瓣状比自然发酵臭鳜鱼的肉质蒜瓣状更规则、更白亮(图8)。

图8 清酒乳杆菌SMF-L5对臭鳜鱼特征蒜瓣的影响Fig. 8 Influence of L. sakei SMF-L5 on the characteristic garlic clove-like appearance of fermented mandarin fish
2.3.2 清酒乳杆菌对鱼肉色泽、质构的影响
通过清酒乳杆菌接种发酵后,臭鳜鱼的色泽和白度均得到提升(图9A),鱼肉质构也产生了变化,硬度在接种发酵后有所降低,黏附性、弹性、胶黏性和咀嚼性则均有所增加(图9B),表明清酒乳杆菌接种发酵可改善臭鳜鱼的色泽和质构,使臭鳜鱼鱼肉更为白亮、更有弹性。
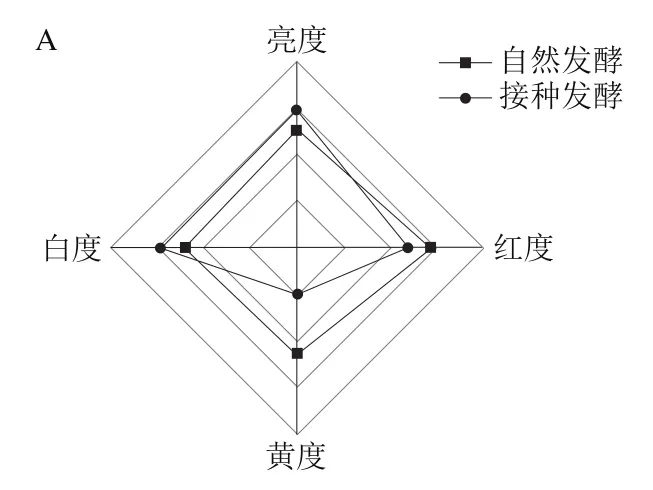

图9 清酒乳杆菌SMF-L5对臭鳜鱼色泽(A)、质构(B)的影响Fig. 9 Influence of L. sakei SMF-L5 on the color (A) and texture (B) of fermented mandarin fish
2.3.3 清酒乳杆菌对鱼肉挥发性风味物质形成的影响
通过GC-IMS的GC保留时间和IMS迁移时间对接种发酵、自然发酵臭鳜鱼中的挥发性风味物质进行鉴定,共鉴定出36种挥发性风味物质,其中醇类11种、酮类8种、醛类5种、酯类5种、酸类2种、醚类3种、烯烃类2种(表4)。为进一步比较接种发酵、自然发酵臭鳜鱼中挥发性物质组分的差异,利用LAV软件将三维谱图中的特征峰生成指纹图谱(图10),在指纹图谱中,每纵列特征峰对应一种挥发性风味物质。接种发酵的臭鳜鱼,丁酸乙酯、乙酸己酯、羟基丙酮、2,3-丁二醇、玫瑰醚、甲硫醇、2,3-戊二酮、甲硫基丙醛、2-辛醇、丙醇和4-甲基-2-戊酮等的含量明显低于自然发酵臭鳜鱼,而芳樟醇、-松油醇、-蒎烯、柠檬烯等挥发性香气成分的含量比自然发酵臭鳜鱼明显增加,表明清酒乳杆菌接种发酵臭鳜鱼,能够降低鱼肉中恶臭气味的产生和促进香气物质的生成。

表4 接种、自然发酵臭鳜鱼中挥发性风味物质Table 4 Volatile substances of fermented mandarin fish using inoculated and spontaneous fermentations

续表4

图10 清酒乳杆菌SMF-L5对臭鳜鱼挥发性风味物质形成的影响Fig. 10 Influence of L. sakei SMF-L5 on volatile flavor substances of fermented mandarin fish
3 讨 论
乳酸菌是世界公认的食品级安全微生物,被广泛用于食品发酵以及天然食品防腐剂等食品工业上。在发酵鱼制品中,乳酸菌是主导发酵过程的优势菌群之一,在改善发酵制品风味、延长保质期、加速色泽形成和提高产品安全等方面发挥着不可替代的作用。传统臭鳜鱼发酵工艺属于多菌种参与的、开放式的自然发酵,发酵体系中含有大量病原微生物,产品安全性不能得到有效保证,产品质量和风味品质稳定性差,通过乳酸菌发酵臭鳜鱼,有望能够解决这些问题。
清酒乳杆菌最早是从发酵米酒中分离获得,现已知泡菜、发酵乳制品、发酵香肠和发酵鱼等自然发酵制品也是获得清酒乳杆菌的良好来源。传统培养技术是获取纯菌株必不可少的步骤,也是进一步筛选优良菌株的基础。含溴酚蓝或溴甲酚绿的MRS培养基适用于产酸类乳酸菌的筛选。嗜酸乳杆菌()、植物乳杆菌()、罗伊氏乳杆菌()、双歧杆菌()等乳酸菌在含溴酚蓝的MRS培养基上较易区分,植物乳杆菌、清酒乳杆菌和格氏乳球菌等乳酸菌在含溴甲酚绿的MRS培养基上形态差异较为明显。清酒乳杆菌在含溴甲酚绿的MRS培养基上,其典型形态特征为菌落中心绿色、周围浅绿色或中心绿色、周围白色。努尔古丽•热合曼等为跟踪清酒乳杆菌在酸驼乳发酵过程中的作用,基于含溴甲酚绿的MRS鉴别培养基,实现了自然发酵酸驼乳中清酒乳杆菌的快速识别和分离。本实验在明确清酒乳杆菌为传统发酵臭鳜鱼中优势乳酸菌的前提下,借助含溴甲酚绿的MRS鉴别培养基从臭鳜鱼中也成功分离到清酒乳杆菌,进一步说明基于含溴甲酚绿的MRS鉴别培养基分类鉴定清酒乳杆菌的方法,简单、快速可行。
良好的生长环境对乳酸菌生长速率及生物量积累至关重要。乳酸菌的生长受环境中温度影响较大,pH值对乳酸菌的生长也具有较大影响。在本实验中,清酒乳杆菌SMF-L5对温度、pH值等生长条件具有较宽的适应范围,这很可能是清酒乳杆菌能够成为臭鳜鱼在自然发酵过程中优势菌的主要原因。乳酸菌生长代谢形成的低pH值发酵环境能够有效抑制腐败菌、致病菌的生长和减少有害物质的产生,从而提高产品的安全性。林城杏以传统发酵酸鱼中筛选出的植物乳杆菌接种发酵酸鱼,发现植物乳杆菌可明显抑制产胺肠杆菌等腐败菌和病原菌的生长,同时也使鱼肉中的生物胺含量有所减少。以产酸能力强的乳酸菌应用于臭鳜鱼发酵生产,将是主导臭鳜鱼发酵过程、提升产品安全品质的一种有效途径。
在发酵食品制作过程中,加入食盐可一定程度抑制腐败菌等杂菌的生长,在盐腌发酵技术基础上,通过添加耐盐性微生物主导发酵过程,有利于缩短发酵时间和提升产品品质。当前臭鳜鱼规模化生产主要以湿法腌制发酵工艺为主,盐水质量浓度控制在0.06~0.08 g/mL。清酒乳杆菌SMF-L5对高达0.08 g/mL盐质量浓度的培养条件仍具有较高的耐受能力,因此适于在臭鳜鱼发酵体系中生长。
清酒乳杆菌SMF-L5对大肠杆菌、金黄色葡萄球菌等食品中常见病原菌的抑制作用,与肉及肉制品中被普遍分离到的清酒乳杆菌,具有相似的结果。在发酵香肠中,清酒乳杆菌能够快速成为其中的优势菌,并能够明显抑制大肠杆菌和肠杆菌的生长。如果将臭鳜鱼源清酒乳杆菌接种至臭鳜鱼发酵体系中,可使其成为主导发酵过程的优势菌群并抑制其他杂菌的生长。
清酒乳杆菌SMF-L5在接种发酵臭鳜鱼时,可能是通过改变发酵体系中的菌群结构,抑制产臭微生物生长和减少细菌种类、数量,形成优于自然发酵臭鳜鱼的风味。在挥发性风味物质中,芳樟醇、-松油醇、-蒎烯和柠檬烯可赋予臭鳜鱼具有植物花香的风味特征,是在发酵过程中由添加的花椒所带入。这些成分也是植物花椒本身主要的挥发性物质,随着腌制发酵过程的进行,花椒中的风味物质逐渐渗透进入鱼体,构成鱼肉重要的风味物质。在臭鳜鱼风味研究中,芳樟醇是常见的挥发性物质,且被认为对臭鳜鱼整体风味品质具有重要贡献的风味活性物质。
4 结 论
通过含溴甲酚绿的MRS鉴别培养基,结合革兰氏染色、生理生化实验以及16S rDNA分子生物学鉴定方法从传统自然发酵臭鳜鱼中分离到一株清酒乳杆菌,命名为SMF-L5。清酒乳杆菌SMF-L5在MRS液体培养基中的最佳培养条件为培养温度30.9 ℃、初始pH 6.15、接种量1.94%;该菌可耐受0.08 g/mL NaCl,对大肠杆菌、金黄色葡萄球菌、腐生葡萄球菌和丁香假单胞菌具有明显的抑制作用;在应用于臭鳜鱼发酵时,能够使臭鳜鱼具有更规则、更白亮的蒜瓣状肉质和更具弹性的质构,同时还能使臭鳜鱼产品的风味得到提升。因此,表明臭鳜鱼源清酒乳杆菌SMF-L5可作为良好的乳酸菌发酵剂,在臭鳜鱼工业化生产上具有应用潜力。
