魔芋胶对南美白对虾肌原纤维蛋白凝胶特性的影响
2022-07-07孙乐常周典颖刘光明曹敏杰
孙乐常,周典颖,杜 瀚,翁 凌,缪 松,刘光明,曹敏杰,*
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.福建省海洋功能食品工程技术研究中心,福建 厦门 361021;3.水产品深加工技术国家地方联合工程研究中心,福建 厦门 361021;4.爱尔兰农业部Teagasc食品研究中心,爱尔兰 科克 999014)
南美白对虾()是世界三大养殖虾类之一。随着苗种选育与养殖技术的日益成熟,我国南美白对虾的产量呈现逐年上升的趋势,2020年全国南美白对虾养殖达186.29万 t,已成为我国重要的养殖虾种。除了鲜销外,南美白对虾主要被加工成冻虾、开背虾、面包虾以及即食虾干等加工品。近年来,以虾滑为代表的虾糜类制品因其口感爽滑Q弹、味道鲜美迅速成为火锅类餐饮的热捧产品,市场潜力巨大。凝胶特性是评价肉糜类制品品质的重要指标,而添加淀粉、非肌肉蛋白、多糖等生物大分子能有效提高肉糜类制品的凝胶弹性,提高产品的品质与经济价值。
魔芋胶(konjac glucomannan,KGM)是魔芋块茎中提取的水溶性、非离子性高分子质量多糖,由葡萄糖和甘露糖以1∶1.5或1∶1.6的物质的量比组成,具有良好的保水性、胶凝性与生物兼容性。KGM自身可以形成独立的网络,通过填充作用支撑和稳定蛋白凝胶的网络支架,还能与蛋白质产生相互作用,有效增强凝胶强度和持水能力。研究发现,KGM能有效改善凝胶强度较差的鱿鱼鱼糜与低值鱼糜的品质,弥补因凝胶劣化导致的品质下降。Yuan Li等发现相比于KGM,脱乙酰化后的KGM能形成热不可逆凝胶,添加到鲢鱼鱼糜中具有更好的凝胶强度,但持水力却显著下降。Jian Wenjie等单独考察KGM与肌原纤维蛋白(myofibrillar protein,MF)的相互作用,发现高分子质量KGM对罗非鱼MF的凝胶化反而具有负作用,而低分子质量KGM能通过多糖-蛋白分子的相互作用进一步促进MF凝胶化能力。Zhuang Xinbo等则发现,当KGM添加量小于1%时能显著提高猪肉MF的凝胶化能力与持水力,而过量的KGM会形成连续的水凝胶界面,进而抑制MF的分子间交联与凝胶化。由此可见,KGM对MF的影响会因KGM的化学性质、添加量以及不同物种来源的MF自身特性而存在显著差异。与鱼类、哺乳动物肌肉MF相比,对虾等甲壳类动物的MF蛋白组成存在明显差异,KGM在MF凝胶化过程中的作用机理尚鲜见报道。本研究以南美白对虾为对象,将KGM与对虾肌原纤维蛋白(shrimp myofibrillar protein,SMP)按不同质量比(1∶50、1∶20、1∶10)进行复配制备复合凝胶体系得到复合凝胶SK50、SK20、SK10,通过测定表面疏水性、内源性荧光、浊度及粒径、流变学、红外光谱、蛋白变化及凝胶微观结构,研究复合体系的凝胶特性变化,旨在为KGM在虾糜及其制品生产中的应用提供指导。
1 材料与方法
1.1 材料与试剂
南美白对虾购于福建省厦门市集美区水产品市场。
KGM(食品级) 厦门市美拉德食品科技有限公司;8-苯胺基-1-萘磺酸铵盐(8-anilino-1-naphthalenesulfonic acid ammonium salt,ANS) 美国Sigma公司;标准蛋白 美国Thermal公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS,电泳纯)、丙烯酰胺美国Bio-Rad公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)等其他试剂均为国产分析纯。
1.2 仪器与设备
PT-2100组织捣碎机 瑞士Kinematica公司;Avanti J-25大型冷冻离心机 美国Beckman公司;DHR-2流变仪 美国TA仪器公司;UB-7型pH计 瑞士Mettler Toledo公司;WB-14恒温水浴锅 美国Memmert公司;Mini-PROTEAN蛋白质电泳装置 美国Bio-Rad公司;759s紫外-可见分光光度计 上海棱光技术有限公司;FP-8200荧光分光光度计 日本Jasco公司;Phenom Pro扫描电子显微镜 荷兰Phenom-World Pr公司;G∶BOX凝胶成像仪 英国Syngene公司。
1.3 方法
1.3.1 SMP的制备
无特殊说明,以下实验均在4 ℃条件下进行。根据Shui Shanshan等的方法并适当修改,将新鲜的南美白对虾用清水洗净后,去头、去壳,收集虾肉。加入10 倍体积的缓冲液A(20 mmol/L Tris-HCl,0.1 mol/L NaCl,0.001 mol/L EDTA,pH 8.0)混合后组织捣碎,经8 000×离心15 min后收集沉淀部分。沉淀重新用10 倍体积相同的缓冲液A悬浮,并重复以上步骤3 次,最终所得沉淀即为SMP。将SMP重新复溶于缓冲液B(20 mmol/L Tris-HCl,0.5mol/L NaCl,pH 8.0),调节蛋白终质量浓度为30 mg/mL作为蛋白母液,贮存于4 ℃冰箱用于以下实验。蛋白浓度测定采用Bradford法,并以牛血清白蛋白为标准。
1.3.2 SMP-KGM复合凝胶体系制备
参考Zhuang Xinbo等的方法并适当修改。配制12 mg/mL KGM,分别按SMP与KGM质量比50∶1、20∶1、10∶1配制SMP-KGM复合凝胶,且每组肌原纤维最终质量浓度均为20 mg/mL,搅拌均匀放在4 ℃以备用,各组分别命名为SK50、SK20和SK10。以未加KGM的SMP(20 mg/mL)为对照。
1.3.3 表面疏水性的测定
参照Shui Shanshan等的方法并适当修改。用缓冲液B将SMP-KGM复合体系稀释至蛋白质量浓度为0.1 mg/mL。为考察加热前后的表面疏水性变化,设置未加热组与加热组(90 ℃加热30 min,迅速冰水冷却备用)。2 mL样品液加入20 μL 8 mmol/L ANS溶液混匀,避光反应10 min,测定荧光强度。测定条件:激发波长390 nm,发射波长470 nm,狭缝宽度10 nm。
1.3.4 内源性荧光的测定
参照Li Jinling等的方法,将SMP-KGM复合凝胶用缓冲液B稀释至蛋白质量浓度为0.5 mg/mL,利用荧光分光光度计进行测试。测试所用激发波长为280 nm,发射波长为300~500 nm。
1.3.5 浊度及粒径的测定
将SMP-KGM复合凝胶用缓冲液B稀释至蛋白质量浓度为1 mg/mL,90 ℃加热30 min后于冰水中冷却,放在冰上备用。浊度测定参考An Yueqi等的方法,测定波长370 nm处SMP-KGM复合体系的紫外吸光度,蛋白吸光度表示浊度值。粒径的测定参考Zhu Zongshuai等的方法,将1 mL样品液装载在可抛式比色皿中,控制测试环境温度为25 ℃,检测角为90 °。
1.3.6 流变学性质
稳态扫描参照Wu Fan等的方法,用移液枪吸取1.4 mL复合凝胶放在测量平台上,移除超出夹具的多余样品。参数如下:40 mm平行铝板夹具,间距1 mm,剪切速率范围0.1~100 s,记录样品的表观黏度与剪切速率的关系。
动态流变学(温度斜坡及频率扫描)参照Sun Lechang等的方法,取1.4 mL样品放在测量平台上,移除超出夹具的多余样品,用硅油将样品进行密封,防止水分蒸发。温度斜坡参数如下:40 mm平行铝板夹具,间距1 mm,温度范围20~90 ℃,升温速率2 ℃/min,振荡频率0.1 Hz,应变0.5%(线性黏弹区范围内)进行测试。为考察加热对样品的影响,分别测定未加热与90 ℃加热30 min后样品的频率扫描曲线,参数如下:40 mm平行铝板夹具,间距1 mm,振荡频率范围0.01~10 Hz,应变0.5%(线性黏弹区范围内)。
1.3.7 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
参考Chen Jinyu等的方法,样品冷冻干燥过后研磨成粉末,以2 mg/100 mg(样品/KBr)的比例与KBr混合并压片,室温条件下使用红外光谱仪在4 000~400 cm的波数范围内记录样品的FTIR。用KBr的红外光谱作为背景。
1.3.8 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分析
取100 μL样品(20 mg/mL)经90 ℃加热30 min后形成热凝胶,然后加入2 倍体积的溶解缓冲液C(20 mmol/L Tris-HCl pH 8.0,含8 mol/L尿素、1% SDS、2%-巯基乙醇),充分振荡溶解后,进行SDS-PAGE分析。
1.3.9 扫描电镜与分形维数分析
参考Laemmli的方法,将20 mg/mL的SMP-KGM复合凝胶在90 ℃中水浴加热30 min,随后用冰水立即冷却。取少量样品在含0.1 mol/L的磷酸盐缓冲液(pH 7.3)的2.5%戊二醛中固定24 h,用0.1 mol/L的磷酸盐缓冲液(pH 7.2)漂洗3 次(10 min/次),随后分别用50%、60%、70%、80%、90%、100%乙醇溶液进行梯度脱水。将样品取出,干燥48 h后进行镀金即可用于电镜观察。
将电镜图形转换成1 024×1 088像素的八位二进制图像,使用ImageJ 1.53e(Wayne Rasband and Contributors National Institutes of Health, USA)并通过盒子计数进行分析。按下式计算分维()值:

式中:N为在给定标度下凝胶网络中的盒子数;为相应的缩放比例。
评析: 试题以六个真实的学生认知活动情境为主线,以不同的动物呼吸系统或器官的结构及功能为切入点,针对呼吸器官结构的“是什么”、实验现象的“为什么”和归纳总结的“怎么样”三个层面进行考查。题干中已经明确了动物呼吸的本质的基础上,从“为什么”层面对A草履虫和B蚯蚓及E鱼的呼吸过程分析,考查学生应用演绎推理解释现象的能力。同时,对五类动物进行了呼吸的结构或器官结构与分类的双重考查;再对动物呼吸的结构和功能进行概括和总结,归纳出结构与功能的关系和进化的规律。试题的综合性充分体现了统一观和进化观的高度融合。
通过图像分析的值是基于二维空间的。因此,有必要在值上增加一个额外的维度代表实际的蛋白质凝胶的三维(3D)结构。
1.4 数据统计分析

2 结果与分析
2.1 KGM对SMP表面疏水性的影响
蛋白的表面疏水性反应其表面疏水残基的分布,可用来衡量蛋白质物理化学状态的变化。如加热前,随着KGM添加量的增多,复合体系的表面疏水性呈现先增高后降低的趋势(图1A)。其中SK50、SK20组的表面疏水性增加,可能是由于在一定质量浓度下KGM分子能与蛋白的亲水基团结合,使蛋白空间结构变得更为松散,由此暴露更多的疏水基团。而过量的KGM分子则会进一步包围在蛋白表面,使本暴露在表面的疏水基团被掩盖,导致疏水性降低。
进一步将样品进行90 ℃加热以促使体系凝胶化,结果表明SMP-KGM复合体系的表面疏水性随着KGM添加量的增加而增加(图1B)。这可能是因为融解态的KGM通过离子键、氢键与SMP相结合,有利于SMP在热凝胶化过程中蛋白内部结构进一步展开,进而暴露出更多的疏水性氨基酸残基。杨振也发现魔芋粉的添加能使鲤鱼肌原纤维蛋白表面疏水性提高并伴有剂量依赖性。

图1 KGM对SMP表面疏水性的影响Fig. 1 Effect of KGM on surface hydrophobicity of SMP
2.2 KGM对SMP内源性荧光的影响
如图2所示,在280 nm的激发波长下,SMP的最大发射波长在333 nm处。与SMP相比,随着KGM添加量增加,SMP-KGM复合体系的内源性荧光强度均出现不同程度的下降。荧光强度的减小与混合体系中生物聚合物的相互作用以及蛋白质分子环境对色氨酸的猝灭效应有关。其中,SK10组的内源荧光强度高于SK20组,与表面疏水性下降(图1A)结果一致,这可能是由于过多KGM包围在肌原纤维蛋白表面,使蛋白的空间结构进一步收紧,减少了色氨酸残基的暴露。另外,多糖和蛋白之间的静电相互作用也能为内源色氨酸残基提供良好的疏水环境,进而避免了荧光猝灭现象发生。

图2 KGM对SMP内源荧光的影响(25 ℃)Fig. 2 Effect of KGM on intrinsic fluorescence of SMP (25 ℃)
2.3 KGM对SMP浊度及粒径的影响

图3 KGM对SMP浊度(A)、PDI(B)、平均粒径(C)及粒径分布(D)的影响Fig. 3 Effect of KGM on turbidity (A), polydispersity index (B),average particle size (C) and particle size distribution (D) of SMP
蛋白溶液的浊度水平是评价蛋白聚集程度的主要指标之一,反映了蛋白液中悬浮粒子的大小及数量,浊度的增加表明形成了更多蛋白聚集体。如图3A所示,随着KGM添加量的增加,复合体系的浊度值也逐渐增大。与对照组相比,SK20、SK10组的浊度值显著增大(<0.05),这表明体系中形成了更多的蛋白质聚合物。结合表面疏水性(图1B)测定结果,推测KGM的加入使更多SMP-KGM复合体系疏水基团的暴露,蛋白分子内部结构相对开放,更有利于KGM和蛋白结合进而形成更大的聚合物。
为了进一步了解SMP与KGM在加热过程中的相互作用,对其粒径分布变化进行分析,如图3所示。随着KGM比例的增多,SMP-KGM复合体系的聚合物分散性指数(polymer dispersity index,PDI)逐渐增大。SMP、SK50、SK20、SK10平均粒径分别为277.75、279.15、284.45、289.36 nm,粒径主要分布在100~1 000 nm,并在1 000~10 000 nm之间形成了少量的大分子聚体。PDI越小,说明蛋白质溶液粒径分布范围越小且分散性越好,该结果也表明了KGM的加入减小了SMP-KGM复合凝胶体系的分散性,更容易形成聚合体。另一方面,SMP-KGM复合体系复合凝胶的平均粒径随着KGM添加量的增大逐渐增大且粒径分布逐渐右移,这与浊度的结果(图3A)相吻合。以上结果表明,KGM与SMP在复合体系中存在相互作用,适量KGM的加入能促进SMP的热聚集。
2.4 KGM对SMP流变学性质的影响
为了进一步探究复合体系的胶凝化过程,研究了温度对复合凝胶储能模量(’)的影响。如图4B所示,所有组的’变化曲线基本一致,表明KGM与SMP之间没有发生交联。与鱼肌原纤维相比,SMP在35 ℃和50 ℃出现了2个波谷,这可能与SMP中存在副肌球蛋白有关。此外,SMP在35~42 ℃出现明显上升趋势,并在42 ℃达到最大,这可能是由于肌球蛋白头部相互作用形成聚体,初步形成了早期的凝胶结构。而当温度高于42 ℃时,’值出现了明显的下降趋势,这可能与轻链肌球蛋白的热变性以及肌球蛋白复合物的解离相关。与SMP组相比,SMP-KGM复合体系组在42 ℃左右的’峰值相对较低,而后’继续上升,造成了此阶段“双峰”的形成。这可能是由于KGM分子在热凝胶的过程中吸水溶胀,导致结构发生变化。同时,肌球蛋白尾部的螺旋被打开,解开的蛋白质又再次聚集、交联,KGM与SMP相互作用,进而导致’再次上升。随着温度的进一步升高(55~70 ℃)中’又急剧上升,到70 ℃左右’趋于平稳,这可能是重链肌球蛋白的缔合与交联,形成了较稳定的三维网络结构。加热至90 ℃时,SMP对应的’为317.96 Pa,而不同添加量的KGM-SMP存在显著差异,其中SK20的’值最高,约为SMP组的2 倍,而SK50的’值最低。这可能是由于一定量的KGM会在MF凝胶结构中起到“填充”作用,进而表现出凝胶增强作用。而KGM添加量较多时,KGM会自身凝胶化进而与MF形成混合凝胶,对复合体系的凝胶具有消极作用。另一方面,SK50组凝胶化低于对照组,推测可能是由于少量的KGM虽能结合在SMP的亲水基团,但形成的凝胶体系并不稳定,在加热凝胶化过程中KGM的热融化作用反而阻碍了蛋白的交联与凝胶网络结构的形成。Jian Wenjie等发现不同添加量的天然KGM(0.5%、1.0%、1.5%)反而抑制罗非鱼MF(7 mg/mL)的凝胶形成,推测其可能是由于大分子质量的天然KGM与MF发生了错配,进而影响了复合体系的凝胶化。而Iglesias-Otero等却发现加入1%的天然KGM对鱿鱼鱼糜凝胶具有较好的提升效果。由此可见,本实验中KGM对SMP凝胶化的影响可能还与对虾肌原纤维自身蛋白组成与物种不同有关。
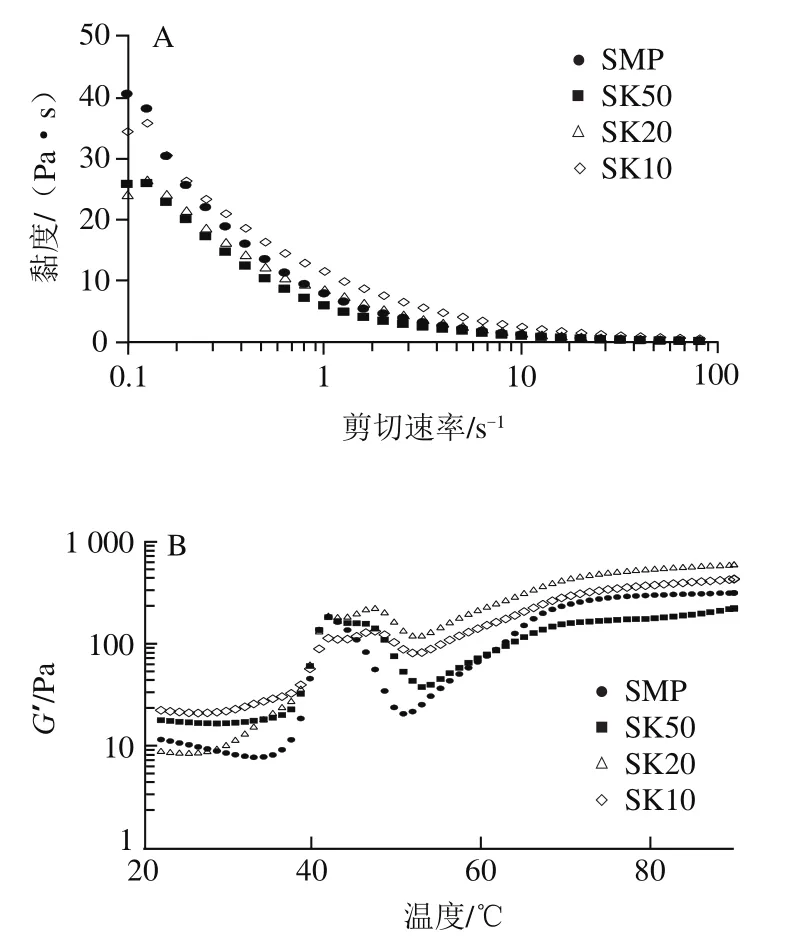
图4SMP-KGM复合凝胶的稳态扫描(A)和温度斜坡(B)曲线Fig. 4 Steady state scan (A) and temperature slope (B) curves of SMP-KGM
添加KGM促进SMP的热聚集,进而影响SMP-KGM复合凝胶结构稳定程度。如图5所示,在相同振动频率条件下,无论加热前后SMP及SMP-KGM复合体系所有组的’均大于″,表现出弹性行为特征,表明形成了较为稳定的网状结构。加热前样品的’与″随着KGM添加量的增加逐渐增加(图5A、B),表现出明显的剂量依赖性,这可能与KGM本身的流变学特性有关。相比之下,90 ℃加热后(图5C、D),样品的’与″随着KGM添加量的增加呈现先增加后下降的趋势,其中SK20的’值最大,与温度斜坡结果一致(图4B),这说明经过加热后SK20组形成的凝胶弹性最好。SK10的’值有所下降,推测可能是由于过量的KGM自身形成了连续网络结构,进而阻碍了SPM蛋白凝胶网络的形成。

图5 SMP-KGM复合凝胶频率扫描曲线Fig. 5 Frequency scan curves of SMP-KGM
2.5 FTIR分析
复合凝胶体系中碳水化合物和蛋白质通过红外光谱分析能检测到各自不同的光谱学特征。其中,蛋白质的光谱特征分别位于1 650 cm和1 540 cm附近的强酰胺I带和酰胺II带。碳水化合物在1 180~953 cm范围间则有一系列不同振动模式重叠峰,如C—C、C—O拉伸,以及C—H键的弯曲模式。另外,3 500~3 000 cm处酰胺A吸收带为N—H或O—H伸缩振动峰,2 925 cm附近处酰胺B吸收带为—CH伸缩振动峰。
如图6所示,SMP及SMP-KGM复合体系所形成的凝胶没有出现新的吸收收峰,表明复合凝胶中无新化学基团产生。随着KGM添加量的增多,SK50、SK20组酰胺A(—OH)峰的位移没有发生明显变化,吸收峰的强度呈现先增大后减小的趋势,这表明SMP与KGM之间可能存在氢键的作用。同时,SK10组酰胺A带有轻微蓝移,表明蛋白质分子与水分子之间的氢键作用逐渐减弱。肖雄在研究KGM对肌球蛋白的影响中也发现,当KGM添加量达到0.46%和0.6%时峰值向高波数移动。这可能是由于KGM分子自身含有丰富的羟基,过多的KGM分子可能与蛋白质竞争凝胶体系中的水分子,进而影响了蛋白质分子间作用力。

图6 肌原纤维蛋白-KGM复合物FTIR图Fig. 6 FT-IR spectra of SMP-KGM
2.6 SDS-PAGE分析
为深入了解KGM与SMP在凝胶中的相互作用,对复合凝胶中SMP进行了电泳分析,如图7所示。SMP主要蛋白组成有:肌球蛋白重链(myosin heavy chain,MHC)、副肌球蛋白(paramyosin,PM)、肌动蛋白(actin,AC)、原肌球蛋白(tropomyosin,TM)与肌球蛋白轻链(myosin light chain,MLC)。KGM的加入并没有引起各组分蛋白条带的明显变化,这与FT-IR(图6)结论一致,说明复合凝胶中并没有产生新的基团。于加美在研究不同脱乙酰度KGM对鲢鱼糜凝胶中蛋白组分的影响时也发现了类似现象,推测不同脱乙酰度KGM与鱼糜蛋白之间并没有发生化学反应,这与本研究的结果类似。相较于未加热组,加热后样品中MHC、PM以及AC的条带明显减弱,这说明了加热能促使MHC与PM、AC发生热聚合反应。这与动态流变学(图4B)结果一致,表明PM在加热过程中参与了SMP的凝胶化。

图7SMP-KGM SDS-PAGE分析Fig. 7 SDS-PAGE analysis of SMP-KGM
2.7 扫描电镜与分形维数分析
如图8A~D所示,SMP蛋白凝胶的结构比较松散,孔洞较多并且大小不均一。随着KGM的增加,SMP-KGM复合体系结构变得更加致密有序,表面相对也变得更光滑,推测是由于KGM促进SMP中各蛋白组分的热聚集,进而形成更致密的凝胶网络。此外,由于KGM具有较强的水结合能力,在热凝胶过程KGM部分支链与水分子共同填充到凝胶网孔也可能会是凝胶显得更加致密。
扫描电镜能可视化和直观看出复合凝胶的结构变化,但是仍然需要使用可靠的方法进行定量描述。分形维数()是评价凝胶微观结构变化以及蛋白质聚集体复杂程度的常用指标,分形维数越大表明了凝胶结构更复杂性且更有序。如图8A~D所示,根据盒计数法计算斜率值如图8A~D所示,由此可以计算出SMP、SK50、SK20、SK10相应的值分别为2.866 4、2.863 8、2.869 3、2.879 0,这与鳙鱼肌球蛋白的值类似。随着KGM添加量的增加,从2.866 4增加到了2.879 0,这进一步说明了KGM-SMP复合体系形成了更复杂且有序的微观结构。其中SK50组的值略低于对照组,这与本研究中的动态流变学(图4B)结果一致。



图8SMP-KGM微观结构和分形维数分析Fig. 8 Microstructures and fractal dimension analysis of SMP-KGM
3 结 论
分析不同KGM添加量对KGM-SMP凝胶的影响。结果表明KGM能不同程度地增加SMP的表面疏水性、浊度与粒径。不同KGM添加对SMP理化性质与凝胶特性的影响存在显著差异。一定浓度的KGM能与SMP发生相互作用,显著提升SMP的凝胶特性,但过低与过高浓度则会阻碍SMP凝胶网络形成。研究还发现,有别于鱼类,KGM与PM的相互作用对SMP的凝胶化可能也存在重要影响。此外,作为一种优质的膳食纤维,KGM的添加是否对虾糜凝胶类制品的消化性产生影响也有待进一步阐明。本研究结果可为KGM在虾糜中的应用提供一定理论参考。
