大豆分离蛋白与染料木素共价交联对蛋白表征和结构的影响
2022-07-07吕思瑶朱登兆鲍云翔张德斌于寒松谷春梅
吕思瑶,朱登兆,鲍云翔,张德斌,于寒松,2,谷春梅,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.吉林农业大学 国家大豆产业技术体系加工研究室,吉林 长春 130118)
大豆作为世界上应用最多的豆类之一,与其他豆类相比,有价格低、营养价值高、来源广等优点。大豆异黄酮(soy isoflavone,SIF)是一种多酚类化合物,是大豆生长中形成的一类次级代谢产物,是从大豆中提取的一种活性物质。SIF具有抗氧化、抗肿瘤、维持动物正常生殖机能、预防甚至治疗骨质疏松症、更年期综合症、前列腺癌等功效。染料木素(genistein,Ge)是一种苷元型的SIF单体,可直接被人体消化吸收,具有植物雌激素的活性。大豆分离蛋白(soy protein isolate,SPI)是将豆粕粉中的可溶性及不可溶性碳水化合物、灰分等去除后得到的一种全价蛋白,其中蛋白质含量占90%以上。SPI含有9种必需氨基酸并且其含量能满足人体对植物蛋白的需求,是一种可以代替动物蛋白的植物高蛋白产品,也是一种营养价值丰富的蛋白资源。
由于多酚类物质是小分子化合物,与蛋白质结合时有一种天然的亲和力,会形成一种共价化合物,这种共价交联通常发生在碱性、氧化酶、高温和自由基的条件下。多酚与蛋白的共价结合是稳定且不可逆的,它不仅会对蛋白的表征特性造成影响,还会改变蛋白的结构。研究表明,单宁酸与大豆蛋白、绿原酸与向日葵蛋白分离物质在碱性条件下能够生成共价键;咖啡提取物与牛奶蛋白在高温(90 ℃)条件下也会产生共价键;儿茶素与明胶在多酚氧化酶(漆酶)的作用下能够产生共价复合物。此外,贾娜等研究表明没食子酸与肌原纤维蛋白在自由基氧化的条件下可以发生交联作用,交联后对蛋白的二级结构产生影响。
目前对SPI与SIF共价复合物的基础特性还不清楚。因此,本实验以SPI和Ge为研究对象,在碱性条件下制备SPI-Ge共价复合物,对其表征特性进行探究,并通过紫外吸收光谱、荧光光谱、傅里叶变换红外光谱法3种光谱学方法研究蛋白的结构特性。这不仅能拓宽SPI食品的研发领域,还可以为SPI-Ge共价复合物在食品中的应用提供创新思路和一定理论依据。
1 材料与方法
1.1 材料与试剂
脱脂豆粕 山东禹王生态食业有限公司;Ge 上海源叶生物科技有限公司;5,5’-二硫双-2-硝基苯甲酸美仑生物技术有限公司;8-苯胺基-1-萘磺酸镁(II)盐水合物(8-anilino-1-naphthalenesulfonic acid magnesium salt,ANS) 阿拉丁生物科技有限公司;溴化钾 麦克林生物科技有限公司;实验所用分析试剂均为分析纯。
1.2 仪器与设备
FD-1C型冷冻干燥机 北京德天佑科技发展有限公司;LGR20-W型台式高速冷冻离心机 北京京立离心机有限公司;KPB-V1358搅拌机 深圳市康佳电器有限公司;BT-9300HT型激光粒度分布仪 丹东市百特仪器有限公司;Zetasizer Nano ZS90电位分析仪 英国马尔文仪器有限公司;F-280型荧光分光光度计 天津港东公司;MAGNA-IR560傅里叶变换红外光谱仪 天津恒创立达科技发展有限公司;FE-28 pH计 梅特勒-托利多(上海)仪器有限公司;T6紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 SPI的制备
参考Keppler等的方法并稍作修改。用去离子水将低温脱脂豆粕粉配成质量浓度为0.05 g/mL的溶液,用1 mol/L NaOH溶液调pH值至8.5,在室温下充分搅拌3 h后,将溶液9 000×离心20 min,取上清液。将上清液用1 mol/L HCl溶液调pH值至4.5,静置3 h。将静置后的溶液8 000×离心30 min,得到蛋白沉淀。将蛋白沉淀水洗3 次后加入去离子水中,使蛋白沉淀充分溶解,并用1 mol/L NaOH溶液调pH值至7.0。溶液经过真空冷冻干燥后得到SPI粉末(纯度91%),贮存备用。
1.3.2 SPI-Ge共价复合物的制备
参考Kroll等的方法并稍作修改。用磷酸盐缓冲溶液(phosphate buffered saline,PBS)(pH 7.0、10 mmol/L)溶解SPI粉末,使SPI质量浓度为60 mg/mL。加入叠氮钠抑制细菌的生长并使其质量浓度为0.2 mg/mL,充分搅拌4 h后放入4 ℃冰箱中过夜使溶液充分水合。将不同质量浓度(0、1.2、1.5、2.0 mg/mL)的Ge与SPI等体积混合,并用0.5 mol/L NaOH溶液调pH值至9.0,室温下充分与氧气接触搅拌24 h,然后转移至透析袋(截留分子质量8~10 kDa)内透析48 h后,进行冷冻干燥,得到SPI-Ge共价复合物,分别标记为SPI、SPI-Ge-1.2、SPI-Ge-1.5、SPI-Ge-2.0。
1.3.3 粒径分布的测定
使用激光粒度分布仪测定溶液的粒径,为防止粒子浓度过高引起的多种散射效应,在加样之前用PBS(pH 7.0、10 mmol/L)稀释100 倍进行测定,测定温度为25 ℃,每个样品做3 次。
1.3.4 Zeta电位的测定
使用Zeta电位仪测定。将样品注入Zeta电位仪之前用PBS(pH 7.0、10 mmol/L)稀释1 000 倍进行测定,测定温度为25 ℃,每个样品做3 次。
1.3.5 浊度的测定
参考Gao Hao等的方法,将样品用PBS(pH 7.0、10 mmol/L)稀释至质量浓度为3 mg/mL后放入石英比色皿中,使用紫外分光光度计在600 nm波长处测定吸光度,测定温度为25 ℃,每个样品做3 次。
1.3.6 表面疏水性()的测定
参考Kato等方法稍作修改。使用荧光探针ANS测定蛋白质的表面疏水性。将SPI-Ge共价复合物溶液用PBS(pH 7.0、10 mmol/L)稀释,使质量浓度达到0.2~1 mg/mL;同时使用相同的PBS(pH 7.0、10 mmol/L)配制ANS储备液(8.0 mmol/L)。将ANS溶液与各稀释样品按1∶100进行混合摇匀,避光反应20 min,使用荧光光度计在激发波长355 nm、发射波长460 nm、狭缝宽度5 nm下测量荧光强度。以荧光强度为纵坐标、蛋白质质量浓度(mg/mL)为横坐标作图,表面疏水性为曲线初始斜率。
1.3.7 总巯基含量的测定
根据Lü Tong等的方法稍作改动。在0.5 mL样品溶液中加入2.5 mL含有8 mol/L尿素的Tris-甘氨酸缓冲液(十二烷基硫酸钠1 g/100 mL、甘氨酸9.4 g/100 mL、Tris1.51 g/100 mL)和0.02 mL含有4 mg/mL 5,5’-二硫双-2-硝基苯甲酸的Tris-甘氨酸缓冲液,将其置于室温下反应25 min。利用紫外分光光度计在波长412 nm处测定吸光度。以Tris-甘氨酸缓冲溶液作空白,根据下式计算蛋白的总巯基含量:

式中:为吸光度;为稀释倍数;为样品质量浓度/(mg/mL);73.53=10/(1.36×10),1.36×10为摩尔吸光系数。
1.3.8 紫外吸收光谱分析
参考Cheng Jing等的方法稍作改动。将共价复合物溶液用PBS(pH 7.0、10 mmol/L)稀释,使蛋白质量浓度达到0.3 mg/mL。测定溶液在波长200~400 nm、分辨率0.5 nm、扫描速率50 nm/min时的紫外吸收光谱,重复扫描3 次,记录平均值。经Origin 8.5软件分析得到紫外吸收曲线。
1.3.9 荧光光谱测定
参考Arroyo-Maya等方法对样品进行内源荧光分光光度计检测。将共价复合物溶液用PBS(pH 7.0、10 mmol/L)稀释,使蛋白质量浓度达到0.3 mg/mL。记录波长300~500 nm的发射光谱,激发波长为280 nm,激发和发射狭缝宽度均为5 nm,激发电压为400 V,扫描速度为1 200 nm/min。
1.3.10 傅里叶变换红外光谱分析
采用溴化钾压片法测定样品的红外光谱。将共价复合物经真空冷冻干燥后研磨成粉状,与提前烘干的溴化钾以1∶100比例进行混合,在红外灯的照射下用玛瑙烟波将粉末混匀,并进行压片。扫描条件设置如下:光谱范围4 000~500 cm,扫描次数32 次,分辨率为4 cm。
1.4 数据统计
所有实验至少做3 次,利用SPSS 22.0软件进行差异显著性分析。<0.05,差异显著。采用Origin 8.5软件进行图形绘制。利用PeakFit 4.12软件进行红外光谱的拟合处理。
2 结果与分析
2.1 SPI-Ge共价复合物的表征分析
2.1.1 SPI-Ge共价复合物的粒径变化
溶液的粒径能够直接反映出溶液的稳定性,因此本实验对在碱性条件下制备出的不同质量浓度的Ge与SPI共价交联复合物的粒径进行探究。如图1所示,粒径分布主要成单峰,表明所形成的溶液体系较稳定,其中对照组与实验组的中位径(值)基本都在90~160 μm之间,而且还可以看出SPI-Ge共价复合物的粒径分布范围相比于对照组都有所减小。其中对照组与实验组的值从大到小依次为SPI组(135.6 μm)>SPI-Ge-2.0组(117.6 μm)>SPI-Ge-1.5组(108.9 μm)>SPI-Ge-1.2组(98.0 μm)。由此可以看出,与对照组相比,实验组的中位径显著减小(<0.05),并且随着Ge质量浓度的增加共价复合物粒径逐渐增大,其中SPI-Ge-1.2组的粒径最小,稳定性最强。这可能是因为在共价作用下,Ge与SPI通过共价键结合在一起,使结构更加稳定,所以使共价复合物的粒径减小。Li Ting等研究发现,在大米蛋白中加入花青素后,大米蛋白与花青素的复合物粒径减小,这与本实验研究结果相似。

图1SPI-Ge共价复合物的粒径分布Fig. 1 Particle size distribution of covalent complexes of SPI with genistein
2.1.2 SPI-Ge共价复合物的Zeta电位变化
Zeta电位绝对值越小,粒子之间的相互斥力就越小,易形成较大颗粒;Zeta电位绝对值越大,粒子之间的相互斥力越大,易形成较小颗粒。如图2所示,对照组的Zeta电位绝对值最小,为15.0 mV;共价复合物溶液与对照组相比,Zeta电位的绝对值显著增大(<0.05),说明在碱性条件下Ge与SPI共价交联后能够使蛋白的Zeta电位绝对值增大,结构更加稳定。此外,从图2还可以看出,随着SIF质量浓度的增加共价复合物溶液的电位绝对值减小,低质量浓度组(SPI-Ge-1.2)的Zeta电位绝对值最大(21.4 mV),高质量浓度组(SPI-Ge-2.0)的Zeta电位绝对值最小(17.1 mV)。这可能是由于Ge质量浓度较高时,它与蛋白之间共价交联后产生的相互斥力减弱,SPI结合更少带负电荷的Ge,导致形成的共价复合物所带的负电荷减少。花春阳等研究酪蛋白与香芹酚相互作用时,发现加入质量浓度为15 mg/mL的香芹酚相对于加入低质量浓度(3、6、9、12 mg/mL)香芹酚后所形成的纳米颗粒所带负电荷减少,这与本实验研究的结果相似。

图2SPI-Ge共价复合物的Zeta电位Fig. 2 Zeta potential of covalent complexes of SPI with genistein
2.1.3 SPI-Ge共价复合物的浊度的变化
复合物溶液的浊度变化可以反映溶液分散与聚集的程度,并且浊度与溶液颜色和粒子的粒径有关。将不同质量浓度SPI-Ge共价复合物溶液稀释至3 mg/mL后对浊度变化进行探究,结果如图3所示。可以看出,对照组的浊度显著低于共价复合物组(<0.05),这是因为在碱性条件下多酚与蛋白发生共价交联会使酚类物质氧化成棕色的醌类物质,所以碱性条件形成的共价复合物的浊度大于对照组。此外,实验组中随着Ge质量浓度的增加,共价复合物溶液的浊度增加,说明在实验组中,SPI-Ge-1.2组更加稳定,这与粒径结果一致。孙红波等研究发现花青素与SPI在碱性条件下形成共价复合物后溶液浊度也随之增加,与本实验结果类似。
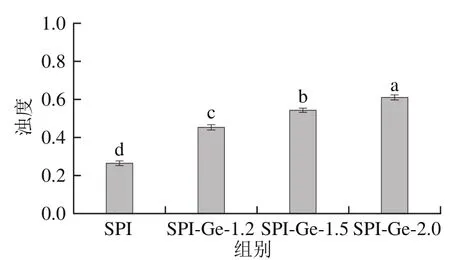
图3SPI-Ge共价复合物的浊度Fig. 3 Turbidity of covalent complexes of SPI with genistein
2.1.4 SPI-Ge共价复合物的表面疏水性的变化
是影响其表面相关功能的重要指标,能够衡量蛋白分子表面疏水基团数目,同时也影响着分子间相互作用,其与蛋白质的结构变化和功能特性密切相关。使用ANS作为荧光探针探测SPI与Ge共价复合物的表面疏水性的变化。如图4所示,与对照组相比,共价复合物的表面疏水性显著降低(<0.05)。由此可以看出Ge与SPI共价交联后能够使SPI的表面疏水性减小,这可能是由于Ge与SPI的共价相互作用使蛋白结构发生改变,将内部的亲水区域暴露出来,复合物的表面疏水性降低,从而使SPI表面的疏水性向亲水的结构改变。从图4还可知,随着Ge质量浓度的增加,表面疏水性增加,当质量浓度为1.2 mg/mL时表面疏水性最小。Ali等在研究-乳球蛋白和咖啡酸共价相互作用时,发现咖啡酸与-乳球蛋白共价交联后能够减小-乳球蛋白表面的疏水性,并且Cao Yungang等研究发现高浓度的绿原酸处理猪肌原纤维蛋白后蛋白表面疏水性增大,上述研究结果与本实验相似。

图4SPI-Ge共价复合物的表面疏水性Fig. 4 Surface hydrophobicity of covalent complexes of SPI with genistein
2.2 SPI-Ge共价复合物的结构变化
2.2.1 SPI-Ge共价复合物的总巯基的变化
从图5可知,与对照组相比,SPI与Ge在碱性条件下共价交联后总巯基含量显著下降(<0.05)。一方面,这可能是由于与蛋白质发生共价作用时,Ge羟基基团与SPI巯基基团发生结合,从而使巯基含量减少;另一方面,当发生共价交联时,Ge的羟基能够氧化成醌,然后与SPI上的巯基发生交联形成巯基-醌的加成物,也使巯基含量减少。此外,从图5还发现,随着Ge质量浓度的增大,总巯基含量显著增加(<0.05),这可能是由于SPI与Ge过度交联,Ge与SPI共价作用减弱,导致总巯基含量随之增加。贾娜等研究发现没食子酸与肌肉纤维蛋白共价交联后,肌肉纤维蛋白的总巯基含量明显减少,并且随着没食子酸的浓度增大总巯基含量增加,这与本实验研究结果类似。

图5SPI-Ge共价复合物的总巯基含量Fig. 5 Total sulfhydryl contents of covalent complexes of SPI with genistein
2.2.2 SPI与Ge共价作用的紫外吸收光谱分析
在研究蛋白质与多酚相互作用时,紫外可见吸收光谱是最常用的方法。由于蛋白质中的一些氨基酸残基具有紫外吸收性质,如色氨酸、酪氨酸、苯丙氨酸和含硫氨基酸,它们在230~310 nm波长范围内具有吸收峰,因此可以通过对比吸收峰位移以及吸光度变化判断蛋白质与多酚是否发生了相互作用。
从图6可以看出,对照组与实验组均在波长290 nm左右处出现峰值,并且在加入Ge后,共价复合物的峰值明显升高。与此同时,与对照组相比,实验组SPI-Ge-1.2的吸收峰波长由290 nm蓝移到285 nm。共价复合物的吸光度升高可能是因为SPI与Ge的共价交联导致蛋白质发生解折叠,色氨酸与酪氨酸残基暴露,微环境的疏水性降低,蛋白质解折叠使更多的发色基团转移到蛋白质的表面。研究还发现随着Ge质量浓度的增加,共价复合物的紫外吸收光谱峰值逐渐降低。上述结果表明Ge的加入对SPI结构产生了影响,二者的共价作用生成了新的SPI-Ge共价复合物,并且低质量浓度的Ge与SPI相互作用更强。

图6SPI-Ge共价复合物的紫外吸收光谱图Fig. 6 UV absorption spectra of covalent complexes of SPI with genistein
2.2.3 SPI与Ge共价作用对蛋白内源性荧光光谱的影响
SPI中存在色氨酸、酪氨酸和苯丙氨酸等残基,这些残基含有的苯环结构或共轭双键使其在一定波长下发射荧光。一般当激发波长为280 nm时,蛋白质分子中苯丙氨酸残基的荧光极弱且易被猝灭,所以可以只探究色氨酸与酪氨酸残基的变化。色氨酸与酪氨酸分别在波长348、303 nm左右处出现峰。如图7所示,在发射光谱扫描范围波长300~500 nm、激发波长280 nm、温度25 ℃的条件下,蛋白质的最大发射波长为337 nm,并在303 nm左右未出现峰值,所以本实验主要探究色氨酸的变化。从图7可以看出,与对照组相比,加入Ge后SPI的荧光强度降低,随着Ge质量浓度的增加SPI的荧光强度逐渐升高,并且共价复合物的最大发射波长发生1 nm的红移,说明共价复合物的结构发生改变。这可能是由于Ge与SPI在碱性条件下发生了共价结合,使蛋白的色氨酸基团被掩盖,降低了色氨酸含量,从而使蛋白质的微环境亲水性增加。Pan Xin等研究发现大米蛋白和绿原酸共价作用后,其最大发射波长也发生了红移。因此,Ge与SPI共价相互作用对SPI的内源荧光产生了猝灭作用,同时低质量浓度Ge对蛋白的猝灭效果更好。
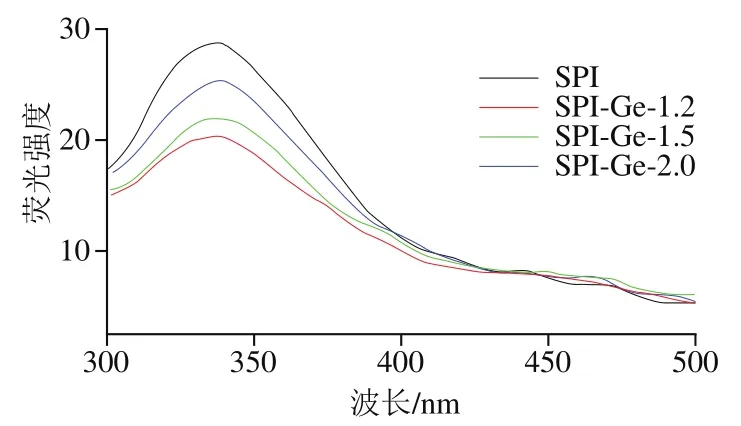
图7SPI-Ge共价复合物的荧光光谱图Fig. 7 Fluorescence spectra of covalent complexes of SPI with genistein
2.2.4 SPI与Ge共价作用的傅里叶变换红外光谱分析
将不同质量浓度的SPI-Ge共价复合物冻干压片后得到的红外光谱图,见图8。蛋白红外光谱中的酰胺I带(1 600~1 700 cm)由C=O伸缩振动引起,主要伴随蛋白质二级结构的改变。Ji Hui等研究表明,在酰胺I带中,蛋白质二级结构与峰值的对应关系为:波数1 650~1 658 cm对应-螺旋;1 610~1 640 cm对应-折叠;1 660~1 700 cm对应-转角;1 640~1 650 cm对应无规卷曲。从图8可以看出,与对照组相比,加入Ge后,酰胺I带的峰值发生波数由1 643 cm至1 650 cm的蓝移,表明Ge与SPI发生了相互作用,并且形成的新的共价复合物改变了SPI的二级结构。

图8 SPI与Ge共价复合物的红外光谱图Fig. 8 Infrared spectra of covalent complexes of SPI with genistein
将得到的不同质量浓度Ge与SPI共价作用后的红外光谱图进一步分析,对酰胺I带(1 600~1 700 cm)进行拟合,通过对峰面积定量计算得出了各个二级结构的含量,如表1所示。与对照组相比,加入Ge后的共价复合物中-螺旋含量增多、-折叠含量减少、-转角含量增多、无规卷曲含量减少。此外,还发现随着Ge质量浓度的降低,蛋白质二级结构中-螺旋含量增多、-折叠含量减少、-转角含量增多、无规卷曲含量减少。因此说明Ge与SPI共价交联会对SPI的二级结构造成影响,另外低质量浓度的Ge对蛋白质结构影响更加明显,Ge质量浓度过高时会对蛋白质的结构影响减弱。贾娜等研究发现没食子酸与肌肉纤维蛋白共价作用也会使蛋白的-螺旋、-折叠、-转角、无规卷曲的含量改变,并且添加没食子酸含量为10 μmol/g对蛋白结构的影响强于50、100 μmol/g,这与本实验的研究结果相似。

表1SPI-Ge共价复合物二级结构相对含量Table 1 Relative contents of secondary structures in covalent complexes of SPI with genistein
3 结 论
将SPI与Ge在碱性(pH 9.0)条件下得到的共价复合物进行表征和结构分析,发现加入Ge后蛋白的粒径分别减小了37.6、26.7、18.0 μm,Zeta电位绝对值分别增大了6.4、3.8、2.1 mV,表面疏水性分别减小了100.5、87.5、80,总巯基含量分别减少11.1、8.3、5.8 μmol/g,这说明低质量浓度Ge的引入对蛋白质的影响更加明显。同时添加Ge后共价复合物的浊度都有着不同程度的增加,说明碱性条件下SPI与Ge发生了共价作用。在对SPI-Ge共价复合物的紫外吸收光谱与荧光光谱分析中,发现二者发生共价相互作用后使蛋白质的色氨酸与酪氨酸残基所处的微环境疏水性减少,并且Ge对SPI有猝灭的效果,低质量浓度Ge猝灭效果更好。红外光谱分析表明SPI与Ge形成共价复合物后蛋白的-螺旋含量增多、-折叠含量减少、-转角含量增多、无规卷曲含量减少,导致了二级结构的相互转化。与对照组相比,Ge质量浓度越高,对蛋白质的二级结构作用效果越弱。本实验从研究SPI与Ge之间的共价作用出发,探究二者形成的新型共价复合物的表征特征以及对蛋白结构的影响,为蛋白质与多酚在食品保健以及大豆食品的研发提供了更多的可能性。
