利多卡因对胰腺癌细胞PANC-1增殖、凋亡和STING/IRF3/IFN-β通路的影响
2022-06-29刘炯汪向飞江斌
刘炯, 汪向飞, 江斌
(十堰市太和医院肝胆胰外科诊疗中心,湖北省十堰市 444200)
胰腺癌是全球第四大癌症相关死亡原因,其5年总生存率低于7%,在所有癌症中最低[1],探索胰腺癌的新治疗策略具有重要意义。某些麻醉药不仅可用于手术镇痛,还具有一定抗癌作用[2-3]。局部麻醉剂利多卡因具有抗炎、抗肿瘤等特殊功效,但其抗肿瘤机制尚不清楚[4]。干扰素基因刺激因子(stimulator of interferon genes,STING)是一种跨膜蛋白,由环鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS)产生的环二核苷酸激活。STING通过促进CD8+T细胞的招募和激活来调节实体肿瘤的免疫抑制肿瘤微环境。STING激活导致了TANK结合激酶1(TANK-binding kinase 1,TBK1)的激活,磷酸化干扰素调节因子3(interferon regulatory factor 3,IRF3)诱导干扰素-β(interferon-β,IFN-β)产生,从而触发肿瘤抗原交叉递呈和抗肿瘤T细胞免疫反应[5]。激活STING/IRF3/IFN-β通路具有强大的抗癌作用[6]。因此,本研究检测利多卡因对胰腺癌细胞PANC-1增殖和凋亡的影响,并探讨STING/IRF3/IFN-β通路在整个过程中的作用。
1 材料和方法
1.1 主要试剂和仪器
利多卡因(沈阳光大制药有限公司);注射用盐酸吉西他滨(江苏豪森药业股份有限公司);人胰腺癌PANC-1细胞(中国科学院典型培养物保藏委员会细胞库);细胞计数试剂盒8(cell count kit 8,CCK-8)和ANNEXIN V-FITC/PI凋亡检测试剂盒(南京凯基生物科技发展有限公司);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和IFN-β酶联免疫吸附法(ELISA)检测试剂盒(南京建成生物工程研究所);TRIzol(美国Invitrogen公司);RNA反转录试剂盒和荧光定量PCR试剂盒(大连TaKaRa公司);Prime Script RT reagent Kit Perfect Real Time RNA反转录试剂盒和Ultra SYBR One Step RNA PCR Kit荧光定量PCR试剂盒[宝生物工程(大连)有限公司];STING、IRF3、Akt、Caspase-3和GAPDH引物由大连TaKaRa公司设计并合成;RIPA裂解液(北京索莱宝生物技术公司);STING、IRF3、磷酸化IRF3(p-IRF3)、Akt、Caspase-3和GAPDH抗体(美国Santa Cruz公司);BD FACSVerse流式细胞仪(美国BIO-RAD公司);辣根过氧化物酶HRP标记山羊抗IgG(北京中杉金桥生物技术有限公司);Real-time PCR扩增仪(美国ABI公司);DYCZ-24EN双垂直电泳槽和WD-9413C型凝胶成像分析系统(北京六一仪器厂);Sunrise型全自动酶标仪(瑞士Tecan公司)。
1.2 细胞培养和分组
细胞在含10%胎牛血清的RPMI-1640培养基中37 ℃、5%CO2条件下培养,取对数期细胞进行实验。实验分为阴性对照组、利多卡因低、中、高剂量组和阳性对照组。对照组不干预,利多卡因低、中、高剂量组分别用20、40、80 mg/L利多卡因干预[7],阳性对照组用10 mg/L吉西他滨干预[8],48 h后进行相关检测。
1.3 CCK-8法检测细胞增殖
细胞接种于96孔板,干预44 h后加入CCK-8(10 μL/孔),培养4 h,酶标仪检测490 nm处光密度(OD),细胞增殖率(%)=(实验组OD-空白孔OD)/(阴性对照组OD-空白组OD)×100%。
1.4 流式细胞术检测细胞凋亡
细胞接种于6孔板,干预48 h后收获细胞,用PBS洗涤2次,分别加入5 μL膜联蛋白(Annexin)V-FITC和碘化丙啶,充分混匀后室温避光孵育20 min,流式细胞仪检测细胞凋亡率。
1.5 酶联免疫吸附法检测TNF-α和IFN-β水平
细胞接种于6孔板,干预48 h后收获细胞,用PBS洗涤2次,加入1 mL PBS,细胞超声破碎仪处理30 s,离心后收集上清液。将标准品和样品加入孔中,并与TNF-α和IFN-β抗体进行预孵育。2 h后,与HRP偶联物孵育30 min,用酶标仪测量450 nm处OD。绘制标准曲线,计算TNF-α和IFN-β水平。
1.6 荧光定量聚合酶链反应法检测STING、IRF3、Akt和Caspase-3 mRNA水平
细胞接种于6孔板中,干预48 h后收获细胞,用PBS洗涤2次,加入1 mL TRIzol提取总RNA,根据Prime Script RT reagent Kit Perfect Real Time RNA反转录试剂盒说明合成cDNA,再根据Ultra SYBR One Step RNA PCR Kit荧光定量PCR试剂盒说明,制备20 μL反应体系进行扩增。反应条件93 ℃预变性40 s;93 ℃变性10 s,62 ℃退火1 min,72 ℃延伸45 s,共循环50次,然后72 ℃延长7 min,采用2-ΔΔCt法计算STING、IRF3、Akt和Caspase-3 mRNA相对表达量(以GAPDH为内对照)。引物序列见表1。
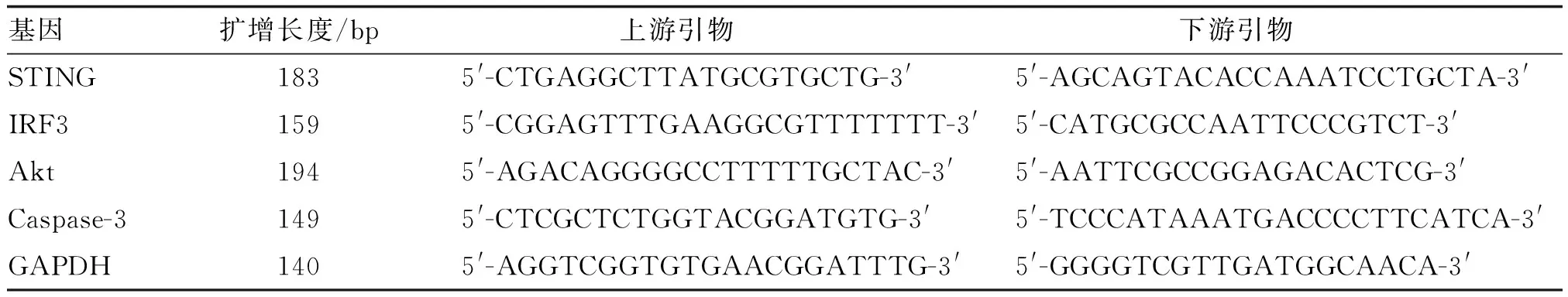
表1 引物序列
1.7 蛋白印迹法检测STING、IRF3、Akt、Caspase-3蛋白水平
细胞接种于6孔板,干预48 h后收获细胞,用PBS洗涤2次,加入RIPA裂解液(200 μL),裂解2 h后离心取上清,电泳(20 μg/孔),切胶、转膜后,将膜与STING(1∶500)、IRF3(1∶400)、p-IRF3(1∶200)、Akt(1∶200)和Caspase-3(1∶400)进行孵育,4 ℃过夜,用PBS洗涤2次,将膜与辣根过氧化物酶HRP标记山羊抗IgG(1∶10 000)在室温下孵育30 min,用PBS洗涤2次,显色,采集图像进行分析(以GAPDH为内对照)。
1.8 统计学处理
2 结 果
2.1 利多卡因对细胞增殖和凋亡的影响
与阴性对照组比较,其余各组细胞增殖率降低,细胞凋亡率增加,且利多卡因组随利多卡因剂量增加呈剂量效应关系,但效应不及阳性对照组(P<0.05;表2和图1)。

表2 利多卡因对PANC-1细胞增殖和凋亡的影响(n=3) 单位:%
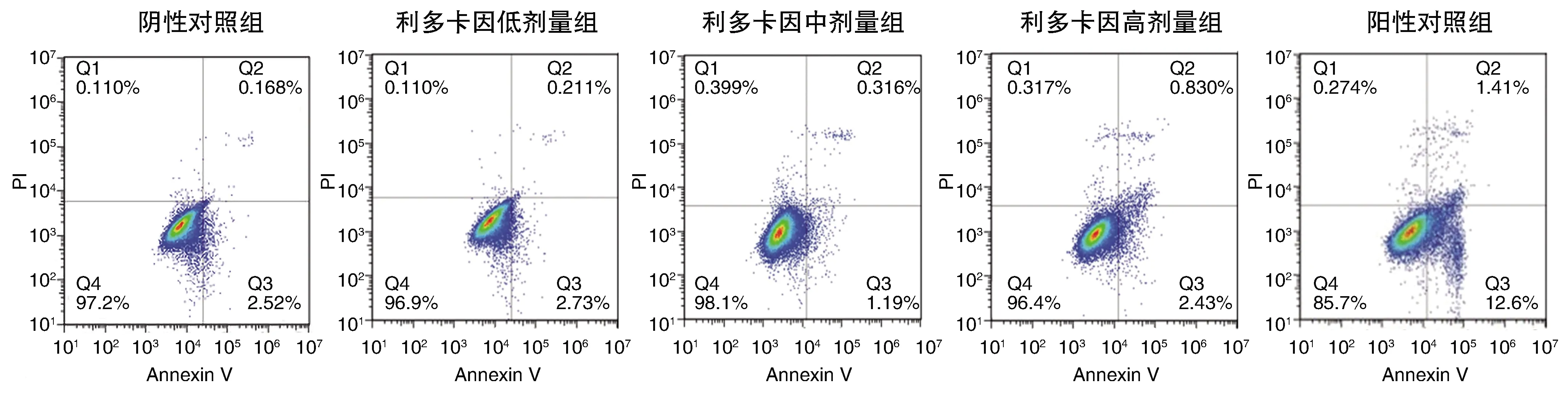
图1 利多卡因对PANC-1细胞凋亡的影响
2.2 利多卡因对TNF-α和IFN-β水平的影响
与阴性对照组比较,其余各组细胞TNF-α水平降低,IFN-β水平增加,且利多卡因组随利多卡因剂量增加呈剂量效应关系,但效应不及阳性对照组(P<0.05;表3)。
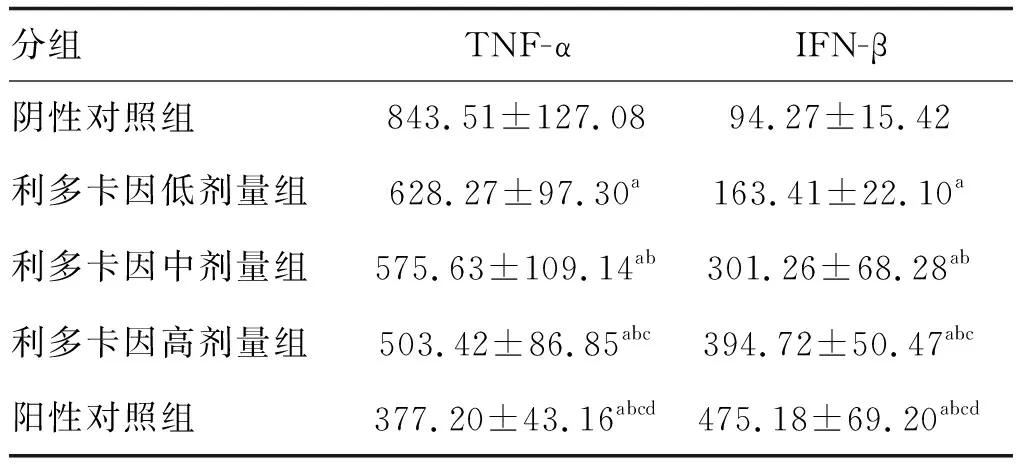
表3 利多卡因对PANC-1细胞TNF-α和IFN-β水平的影响(n=3) 单位:ng/L
2.3 利多卡因对STING、IRF3、Akt和Caspase-3 mRNA水平的影响
与阴性对照组比较,其余各组细胞Akt mRNA水平降低,STING、IRF3和Caspase-3 mRNA水平增加,且利多卡因组随利多卡因剂量增加呈剂量效应关系,但效应不及阳性对照组(P<0.05;图2和图3)。
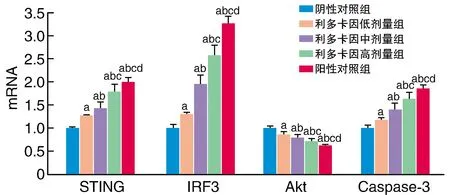
图2 利多卡因对STING、IRF3、Akt和Caspase-3 mRNA水平的影响a为P<0.05,与阴性对照组比较;b为P<0.05,与利多卡因低剂量组比较;c为P<0.05,与利多卡因中剂量组比较;d为P<0.05,与利多卡因高剂量组比较。

图3 PANC-1细胞STING、IRF3、Akt和Caspase-3的溶解曲线
2.4 利多卡因对STING、IRF3、Akt和Caspase-3蛋白水平的影响
与阴性对照组比较,其余各组细胞Akt蛋白水平降低,STING、p-IRF3/IRF3和Caspase-3蛋白水平增加,且利多卡因组随利多卡因剂量增加呈剂量效应关系,但效应不及阳性对照组(P<0.05;图4)。
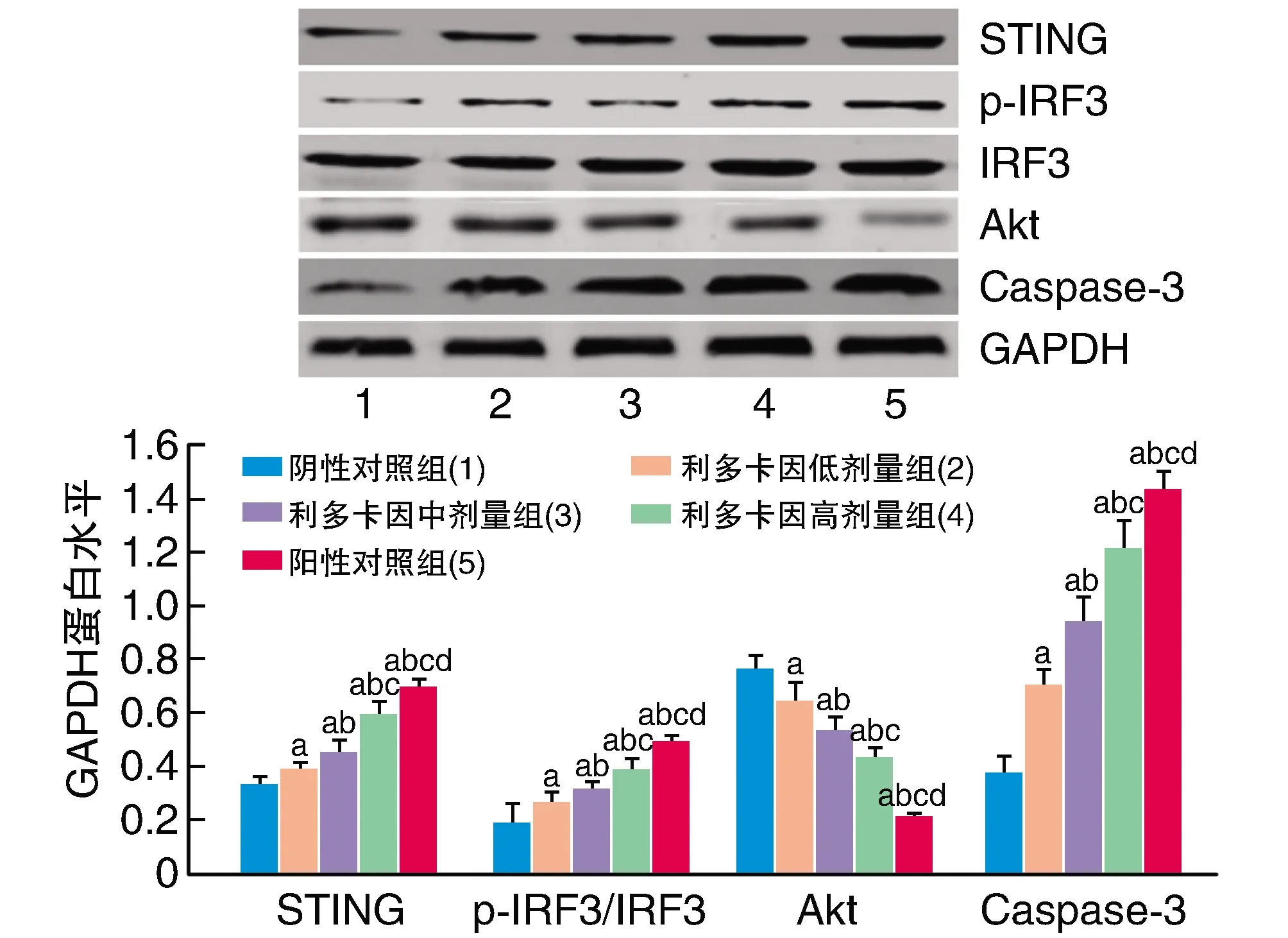
图4 利多卡因对PANC-1细胞STING、IRF3、p-IRF3、Akt和Caspase-3蛋白水平的影响a为P<0.05,与阴性对照组比较;b为P<0.05,与利多卡因低剂量组比较;c为P<0.05,与利多卡因中剂量组比较;d为P<0.05,与利多卡因高剂量组比较。
3 讨 论
肿瘤细胞可以通过多种肿瘤细胞内在和外在机制逃脱宿主的免疫反应,从而增强免疫疗法的抵抗力。胰腺癌的免疫原性特别低,可能是由于存在广泛的纤维炎性和细胞增殖,造成CD8+T细胞浸润[9]。在胰腺癌的麻醉和术后疼痛治疗中给予的药物,如氯胺酮、罗匹卡伐因和利多卡因,均具有一定抗肿瘤效果[10]。值得注意的是,初步研究表明,利多卡因可改善胰腺癌患者的预后[11]。本研究结果显示,利多卡因能抑制PANC-1细胞增殖并促进细胞凋亡,发挥抗肿瘤作用,与国内外研究一致。吉西他滨单药治疗目前是国家综合癌症网络专家组推荐的一线治疗方案,但大多数胰腺癌患者对吉西他滨耐药[12]。虽然利多卡因的抗肿瘤细胞增殖作用不如吉西他滨,但考虑到吉西他滨的耐药性,对利多卡因的抗肿瘤作用进行研究还是很有必要。
目前利多卡因的抗肿瘤作用机制尚不清楚,特别是在免疫调节方面,近年来,免疫检查点抑制剂(immune checkpoint blockade,ICB)已成为一种很有前途的治疗方法。已有研究提示,利多卡因可通过炎症细胞诱导肿瘤浸润[13]。本研究结果显示,利多卡因可降低PANC-1细胞TNF-α水平,这可以解释利多卡因抑制胰腺PANC-1细胞增殖的能力。STING/IRF3/IFN-β通路通过诱导IFN和其他促炎细胞因子的产生,在抗肿瘤免疫应答中发挥重要作用[14]。cGAS在自身DNA与炎症信号传递中起着重要作用。来自细胞核中的游离DNA可以通过cGAS激活STING,进而招募TBK1。TBK1以肿瘤坏死因子受体相关因子6依赖的方式抑制核转录因子-κB的激活[15];同时,TBK1可以直接诱导IRF3的激活,诱导IFN-β产生[16]。IFN-β可以抑制免疫细胞的活力和功能,包括T细胞、B细胞和自然杀伤细胞,最终抑制TNF-α和白细胞介素等炎症因子的产生,从而参与炎性反应的调控[17]。2′3′-cGAMP是STING通路的第二信使,直接与STING结合并激活STING,2′3′-cGAMP能抑制肿瘤生长,延长荷瘤小鼠的生存时间,在胰腺癌中2′3′-cGAMP已被证明可以调节免疫抑制肿瘤微环境并减轻肿瘤负担[18]。本研究结果显示,利多卡因可以激活STING/IRF3/IFN-β通路,为利多卡因治疗胰腺癌提供了理论支撑。
人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)/Akt信号已被证明负调控STING通路,利多卡因被证明可以抑制肿瘤细胞HER2/Akt信号[19]。HER2/Akt信号参与肿瘤细胞增殖、迁移和凋亡调控。作为HER2/Akt信号的下游信号分子,Akt在许多类型的肿瘤中持续被高度激活[20]。本研究结果显示,利多卡因通过抑制Akt的激活来增强STING表达,揭示了利多卡因介导STING通路激活的机制。Caspase的激活介导了肿瘤细胞的凋亡过程,而Caspase-3是凋亡中的重要启动子。Caspase-3的激活影响主要的结构蛋白并激活其他酶,从而导致细胞凋亡[21]。重要的是,Akt信号通路可以抑制裂解的Caspase-3活性[22]。本研究结果显示,利多卡因通过促进Caspase-3的激活诱导PANC-1细胞凋亡。
综上所述,利多卡因通过激活STING/IRF3/IFN-β通路,抑制PANC-1细胞的炎症反应,抑制PANC-1细胞增殖并促进PANC-1细胞凋亡,为利多卡因治疗胰腺癌提供了理论依据,但后续还需大量体内和体外研究来验证利多卡因治疗胰腺癌的具体机制和作用疗效。
