SNHG1在泌尿男生殖系统肿瘤中的研究进展
2022-06-29邓世栋刘凌志郭大勇王超张晖辉
邓世栋, 刘凌志, 郭大勇, 王超, 张晖辉
(南华大学衡阳医学院附属第一医院泌尿外科,湖南省衡阳市 421001)
长链非编码RNAs(long non-coding RNAs,lncRNAs)是非编码RNA家族的重要成员,由于没有明显的开放阅读框架而不具备编码蛋白质的功能,但可以通过转录和转录后调节基因的表达。近年来,由于lncRNAs表达水平的变化与肿瘤的发生发展密切相关,对lncRNA的探索已成为临床研究的热点。其中长链非编码核仁小分子RNA宿主基因1(lnc small nucleolar RNA host gene1,SNHG1)是一种新发现的lncRNA,位于染色体11q12.3上,在多种肿瘤中具有异常高表达和致癌特性,参与肿瘤细胞增殖、凋亡和转移等[1-2]。SNHG1在胃癌中低表达且具有抑癌作用提示SNHG1在不同的肿瘤中可能发挥不同的功能[3]。SNHG1在泌尿男生殖系统肿瘤中表达上调,并参与肿瘤的生物学行为[4]。本文综述了SNHG1基因在泌尿男生殖系统肿瘤中的最新研究进展。
1 肾细胞癌
肾细胞癌(renal cell carcinoma,RCC)是泌尿男生殖系统最具侵袭性的癌症之一,尽管近年来在手术、分子靶向治疗、化疗和放疗等综合治疗方面取得了进展,但转移性肾癌患者的5年总生存率仍低至10%~20%[5]。
Yang等[6]发现,与癌旁正常组织相比,肾癌组织中SNHG1表达显著上调。Zhao等[7]对GEO数据库的分析也表明SNHG1在肾癌细胞系中过表达,而且与肾癌患者预后不良相关。SNHG1基因敲除降低了肾癌细胞的增殖和侵袭能力,并抑制了肾癌的上皮-间充质转化(epithelial-mesenchymal transition,EMT)过程。作为癌基因,SNHG1通过负性调控miR-137促使癌细胞的增殖、转移和侵袭。SNHG1基因敲除后,癌细胞中磷酸化信号转导与转录激活因子3(phosphorylated signal transducer and activator of transcription 3,p-STAT3)、STAT3和细胞程序性死亡-配体1(programmed cell death 1 ligand 1,PD-L1)的表达水平显著降低,miR-129-3p的表达水平则升高[8]。双荧光素酶报告分析表明miR-129-3p与SNHG1或STAT3之间存在调控相互作用,提示在肾癌细胞系中SNHG1可能通过海绵吸附miR-129-3p促进STAT3的表达,而STAT3可以通过激活PD-1/PD-L1信号通路来促进肿瘤的增殖和发展,从而促进肾癌的免疫逃逸[9]。miR-129-3p通过靶向STAT3促进CD8+T细胞的增殖和细胞因子的分泌,从而抑制肾癌细胞的增殖。SNHG1通过抑制miR-129-3p来上调STAT3和PD-L1的表达,促进肾癌细胞的增殖、侵袭和免疫逃逸。
SNHG1通过负性调控miR-137发挥癌基因的作用,也可促进STAT3和PD-L1介导肾癌细胞的免疫逃逸(图1)。
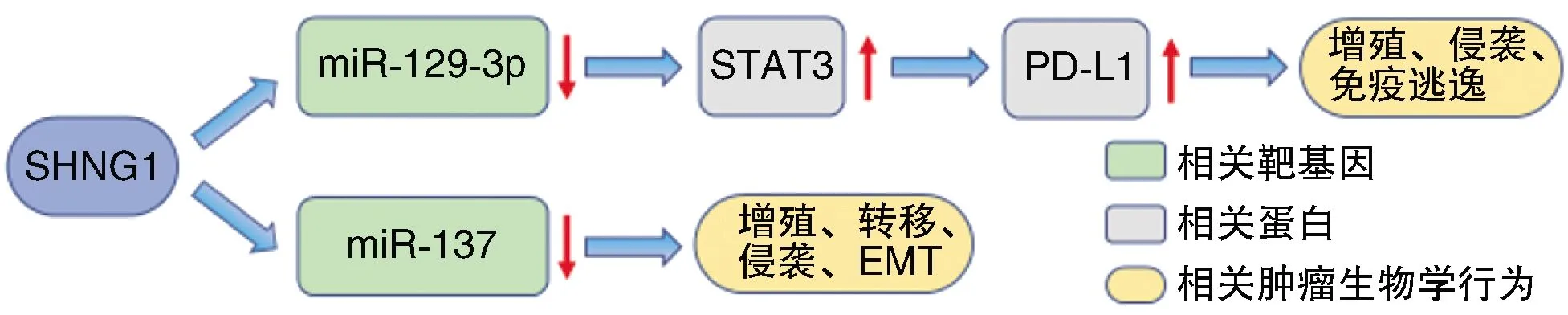
图1 SNHG1在肾癌中的生物学作用途径
2 前列腺癌
前列腺癌(prostate cancer,PCa)是老年男性常见的恶性肿瘤性疾病。对于早期前列腺癌,目前其手术治疗的疗效较为理想,但术后复发是导致前列腺癌患者总生存率下降的主要原因之一[10]。非编码RNA可能与前列腺癌的发病机制有关。
Tang等[11]研究发现,SNHG1的表达与前列腺癌的TNM分期、Gleason评分、淋巴结侵犯和远期转移死亡率明显相关。Xie等[12]发现,SNHG1在前列腺癌组织中过度表达,且与预后差有关。然而,miR-377-3p在癌组织中的表达低于癌旁组织,与SNHG1的表达呈负相关。miR-377-3p可部分抑制Akt2基因促进PCa细胞生长和抑制细胞凋亡的作用,而SNHG1过表达则能在一定程度上抑制这一作用。Meng等[13]发现,SNHG1和miR-195-5p具有结合靶点,且两者成负相关,而miR-195-5p在前列腺癌中具有抗癌作用,下调miR-195-5p可以促进肿瘤细胞的增殖、侵袭和EMT。Huang等[14]通过生物信息学分析、双荧光素酶报告基因分析、RNA免疫沉淀和RNA Pull-Down实验,确定miR-383-5p是SNHG1的靶点,SNHG1可以下调miR-383-5p的表达。而miR-383-5p能通过调节细胞周期、细胞凋亡、活性、克隆形成和转移抑制前列腺癌进展[15]。因此,SNHG1通过负调控miR-383-5p的表达促进前列腺癌的增殖、迁移和侵袭。SNHG1通过负性调控miR-199a-3p,上调细胞周期蛋白依赖性激酶7(cyclin-dependent kinase 7,CDK7)表达,从而促进细胞的增殖和细胞周期进程[16]。Chen等[17]发现,SNHG1和EZH2(enhancer of zeste homolog 2,EZH2)基因在前列腺癌组织中高表达,且两者表达呈正相关。SNHG1结合EZH2能激活前列腺癌细胞磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白质丝氨酸苏氨酸激酶(protein serine threonine kinase,Akt)/哺乳动物雷帕霉素靶蛋白(the mammalian target of Rapamycin,mTOR)信号通路和Wnt/β-catenin信号通路,最终抑制肿瘤细胞的自噬和凋亡。SNHG1的表达与PCa患者的预后呈正相关,而EZH2的表达与PCa患者的预后呈负相关。提示SNHG1/EZH2可作为PCa的预后指标。Tan等[18]还发现,SNHG1与异质性胞核核糖核蛋白L(heterogeneous nuclear ribonucleoprotein L,hnRNP L)相互作用导致钙黏蛋白E(E-cadherin)表达下调,激活EMT通路,促进PCa的恶性进展。EMT是一个动态过程,导致上皮细胞获得间质特性,从而增加迁移和侵袭能力,使早期癌症向侵袭性癌症过渡,而E-cadherin的丢失是启动EMT的关键步骤,最终导致PCa的肿瘤转移。
SMHG1通过一系列潜在机制(图2)影响着前列腺癌细胞的增殖、凋亡、自噬、EMT等过程,最终促进前列腺癌的增殖与迁移。
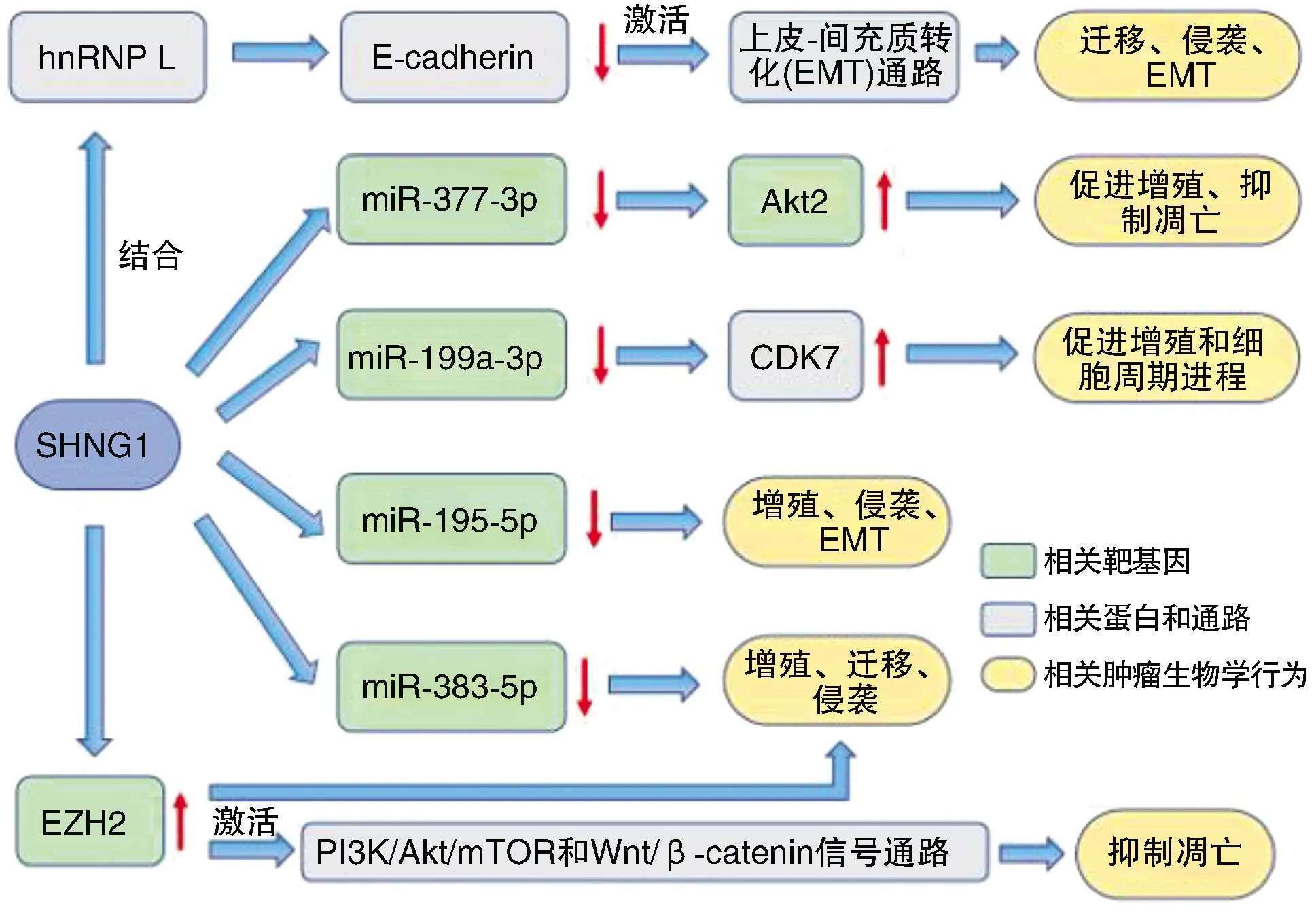
图2 SNHG1在前列腺癌中的生物学作用途径
3 膀胱癌
膀胱癌(bladder cancer,BC)包括非肌层浸润性膀胱癌(non-muscle invasive bladder cancer,NMIBC)和肌层浸润性膀胱癌(muscle invasive bladder cancer,MIBC)。MIBC的标准治疗方法是根治性膀胱切除术,其5年生存率仅为50%[19]。
Xu等[4]发现,SNHG1在人类BC侵袭过程中起着重要作用。SNHG1基因敲除可显著抑制MIBC癌细胞的侵袭。相反,SNHG1的过表达导致癌细胞侵袭力显著增加。SNHG1可通过提高基质金属蛋白酶2(Matrix metalloproteinase 2,MMP2)的转录和MMP2 mRNA稳定性而特异性地诱导MMP2的表达。MMP2是一种蛋白酶,在癌细胞分解细胞外基质的过程中是必不可少的,能促进癌细胞的侵袭[20]。SNHG1诱导MMP2表达可能存在两种机制。①SNHG1直接与蛋白磷酸酶2A(protein phosphatase 2A,PP2A)催化亚基(PP2A-c)结合,抑制PP2A-c与c-jun基因的相互作用,进而促进c-jun磷酸化,介导MMP2转录。②SNHG1通过诱导自噬,导致miR-34a降解,降低了miR-34a与MMP2 mRNA的3′UTR的总结合,从而促进了MMP2 mRNA的稳定。Xiang等[21]研究发现,SNHG1在BC组织和细胞中显著上调,并与BC患者的TNM分期、淋巴浸润、转移和无复发生存密切相关。SNHG1表达下调可显著抑制BC细胞的增殖、迁移、侵袭和EMT。在细胞质中,SNHG1通过内源性竞争调节miR-143-3p的表达来增强HK2基因的表达,从而促进BC细胞的增殖。在细胞核内,SNHG1可以与EZH2相互作用,抑制CDH1基因的表达,从而促进BC细胞的迁移、侵袭和转移。Guo等[22]发现,SNGH1高表达与膀胱癌细胞的自噬、侵袭和增殖成正相关,自噬抑制剂3-甲基腺嘌呤(3-MA)可部分或全部抑制SNHG1诱导的细胞侵袭和增殖,表明SNHG1通过自噬促进膀胱癌细胞的侵袭和增殖。SNHG1在膀胱癌中通过海绵吸附miR-493-5p来抑制其与ATG14mRNA的3′-UTR结合,从而促进自噬相关蛋白ATG14的表达。SNHG1过表达能通过miR-493-5p/ATG14/自噬途径促进膀胱癌细胞的自噬、增殖和侵袭。但与Chen等[17]研究的SNHG1促进肿瘤发生发展的结论相反。以往研究报告,自噬在肿瘤抑制和肿瘤促进中有着矛盾的作用,其相关分子机制与肿瘤的发展阶段、外部环境等多种因素有关[23-25]。此外,Du等[26]研究表明,SNHG1的过表达还可通过激活PI3K/Akt信号通路促进膀胱癌细胞的增殖、迁移和侵袭。
SNHG1与膀胱癌的发病机制密切相关,参与一系列肿瘤生物学行为的调控(图3)。SNHG1在不同亚细胞位置的不同调控机制为抑制BC进展提供了治疗选择。
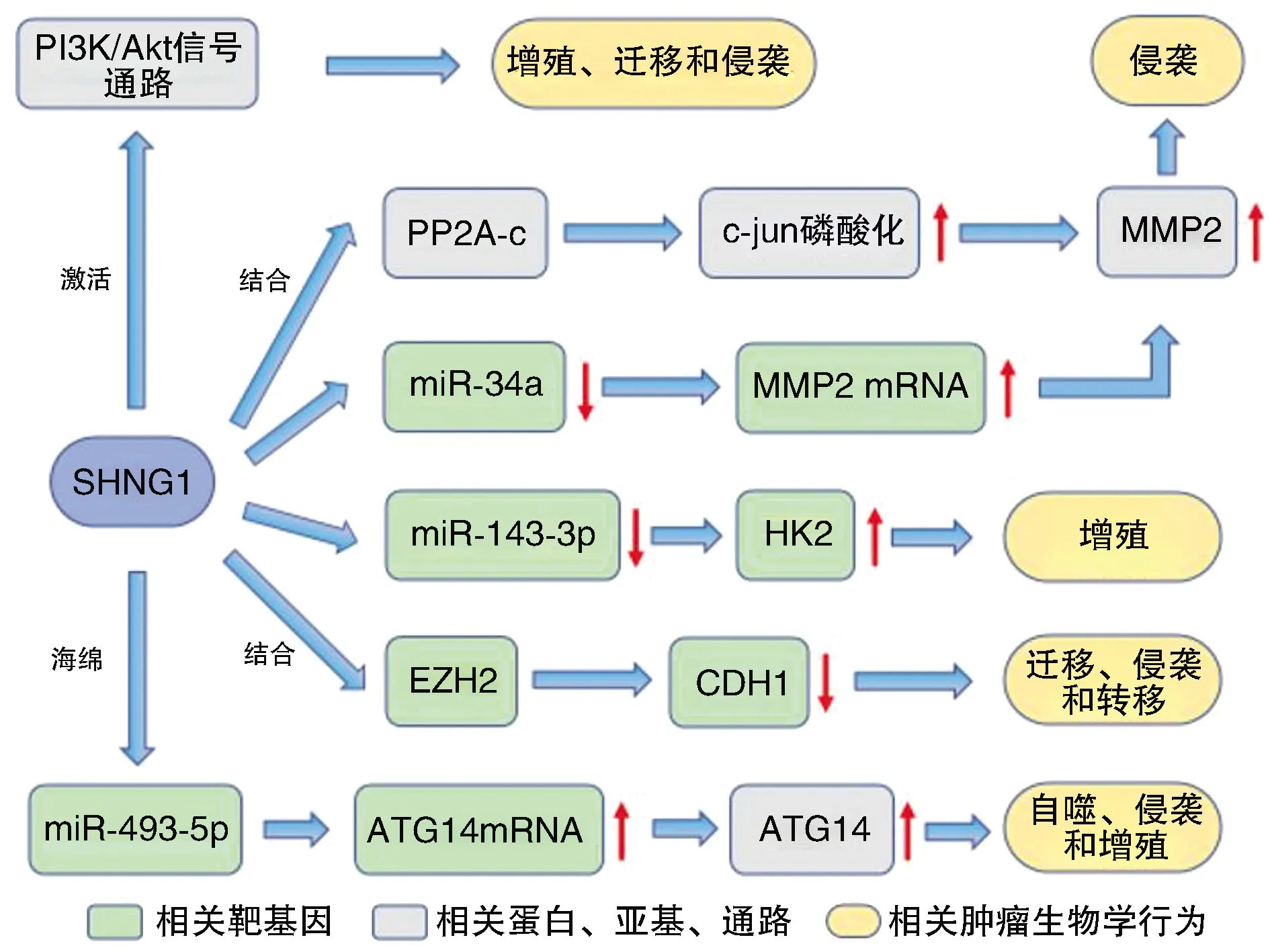
图3 SNHG1在膀胱癌中的生物学作用途径
4 总结与展望
lncRNAs是肿瘤的形成和发展过程中重要的调节因子,并在恶性肿瘤中扮演着不同的角色。随着lncRNAs在肿瘤中的研究不断深入,其在泌尿男生殖系统肿瘤发生发展中的作用值得不断探讨和总结。其中SNHG1是一个新发现的癌基因,在多种人类肿瘤中表达异常。此外,SNHG1还参与细胞的增殖、迁移、侵袭、转移、凋亡、EMT和自噬等过程。在肾癌、前列腺癌、膀胱癌中,SNHG1介导其作用的分子功能和细胞机制是复杂的,涉及多个因素。这些分子机制对泌尿男生殖系统肿瘤的临床诊断、治疗、预后和疾病进展有重要意义。然而,SNHG1参与癌症发展涉及许多复杂机制,其详细的下游分子机制以及网络调控机制仍有待阐明,SNHG1的临床应用及相关途径尚需进一步研究。
