内耳免疫及炎症介导的耳聋研究进展
2022-06-15王锐高雪徐金操
王锐高雪徐金操*
1锦州医科大学火箭军特色医学中心研究生培养基地(北京 100088)
2中国人民解放军火箭军特色医学中心耳鼻喉科(北京 100088)
既往人们认为耳蜗是免疫豁免器官,后来研究发现耳蜗侧壁的血管纹和螺旋韧带区域是炎症的关键区域[1],其介导毛细胞或螺旋神经节细胞死亡机制与炎症反应、活性氧(Reactive oxygen species,ROS)、细胞内钙超载、细胞凋亡等多种因素有关,在过去的三十余年中,免疫/炎症介导的耳聋受到了广泛关注。
1 内耳免疫结构及组成成分
1.1 耳蜗外侧壁血-迷路屏障
位于耳蜗外侧壁的血-迷路屏障能防止蜗内区域接触外周血并阻止血液中的抗体和T细胞进入内耳,其完整性是由血管内皮细胞、中间细胞和血管周围巨噬细胞维持的,血管周围巨噬细胞的减少会导致毛细血管渗漏和听力阈值升高[2]。屏障功能可能在创伤或感染的内耳炎症中受损,脂多糖(Lipopolysaccharide,LPS)能通过激活血管周围常驻巨噬细胞和上调基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)破坏耳蜗血-迷路屏障[3],也可通过直接破坏血管内皮细胞促进细胞进入耳蜗。
1.2 免疫细胞及膜标记物
耳蜗的免疫能力是由专业免疫细胞和具有免疫特性的常驻细胞支持的。专业免疫细胞主要由巨噬细胞组成,具有免疫特性的常驻细胞包括纤维细胞和Corti器中的支持细胞[4]。
巨噬细胞分布于耳蜗的多个解剖区域,包括螺旋韧带、螺旋神经节区域、骨螺旋板、基底膜以及血管纹周围的血管,在一些文献中也被称为血管周围的巨噬细胞[5,6]。耳蜗巨噬细胞的广泛分布表明它们参与了耳蜗组织稳态的维持和疾病条件的形成。噪声刺激小鼠后,CD4+T细胞和巨噬细胞会浸润基底膜区域。第一个用于识别噪声损伤后免疫细胞浸润耳蜗的标记物是CD45,也被称为白细胞共同抗原,以单核细胞或巨噬细胞为主。后对其他标记物进行了研究发现在噪声损伤后浸润免疫细胞的特征包括CD45、F4/80、IBA1、CD11b和CX3CR1+巨噬细胞[7]。在人耳蜗的内外毛细胞以及螺旋神经节神经元发现趋化因子CX3CL1,螺旋神经节神经元之间的巨噬细胞发现其受体CX3CR1,CX3CL1/CX3CR1轴促进巨噬细胞侵袭炎症部位,证明巨噬细胞和其他重要的细胞类型之间可相互作用[5]。
2019年,Wei Liu等发现CD4+和CD8+T细胞存在于蜗轴血管、Rosenthal's管周边,偶尔在螺旋韧带出现,揭示了人耳蜗中执行细胞毒和辅助功能的T淋巴细胞能与巨噬细胞共同介导免疫功能[8]。
2020年,Agnieszka J.Szczepek等首次发现肥大细胞(MCs)存在于C57BL/6小鼠和Wistar大鼠的耳蜗的蜗轴,螺旋韧带和血管纹中[9]。外侧壁生长的造血干细胞可再生为纤维细胞,分化为成年听神经中的巨噬细胞,甚至再生为听神经[10]。由于小胶质细胞标记物TMEM119和P2Y12在人耳蜗中是阴性的[11]推测耳蜗缺乏小胶质细胞。
1.3 免疫分子
在免疫应答过程中,需要两类免疫分子参与。一类是膜型分子如主要组织相容性复合体、细胞因子受体、黏附因子受体;一类是分泌型分子如细胞因子、黏附因子。
主要组织相容性复合体(Major Histocompatibility Complex,MHC)属于糖蛋白,分为两类MHC I和MHC II。前者几乎表达于所有有核细胞表面,主要功能是呈递内源性抗原肽至CD8+杀伤T细胞(killer T cell,Tc);后者表达于抗原呈递细胞(Antigen Presenting Cells,APCs)如DC细胞、单核-巨噬细胞、B细胞表面,主要功能是呈递外源性抗原肽至CD4+辅助T细胞(helper T cell,Th)。外来微生物抗原与MHC II结合形成复合物后,才能激活辅助T细胞,启动后续的免疫应答反应。PRRs可分为Toll样受体(Toll Like Receptor,TLRs)、核苷酸结合寡聚域样受体(Nucleotide binding oligomerization domain Like Receptors,NLRs)、C 型凝集素受体(C type Lectin Receptor,CLRs)和视黄酸诱导基因1样受体(Rig 1 Like Receptor,RLRs)四类,其中 TLRs和CLRs是跨膜蛋白,NLRs和RLRs是胞质蛋白。病原体相关分子模式(Pathogen Associated Molecular Patterns,PAMPs),如鞭毛蛋白、细菌的细胞壁成分、真菌以及病毒核酸和无病原体的情况下细胞损伤的副产品即损伤相关分子模式(Damage Associated Molecular Pattern,DAMPs)如细胞外热休克蛋白、线粒体DNA和甲酰肽,都能刺激模式识别受体。模式识别受体(Pattern Recognition Receptors,PRRs)是抗原呈递型MHCs的关键组成部分。内耳细胞损伤与DAMP-PRR有很大的联系。
趋化因子如CCL2、CCL4和CXCL12在噪声损伤后6小时即可表达。细胞因子如TNF-α、IL-1β、IL-6于噪声损伤后6小时至1天表达[12]。在大鼠中,噪声损伤后在耳蜗外侧壁纤维细胞及螺旋神经节神经元表达IL-6。在小鼠中,噪声损伤后在毛细胞和螺旋神经节神经元中表达IL-6受体。在可能是由巨细胞病毒感染导致的突发性耳聋病例中,TNFα、IL2、IL8和IL6升高[13]。衰老过程本身与炎症的轻微增加有关,研究显示ARHL与促炎细胞因子升高有关,特别是IL1β和IL18。细胞因子促进免疫细胞浸润的方式之一是诱导螺旋韧带中细胞间黏附分子-1(Intercellular Cell Adhesion Molecule-1,ICAM1)的表达,ICAM1在TNF-α引起的NF-κb活化后表达,通过与淋巴细胞功能相关抗原 1(Lymphocyte Function-ssociated Antigen-1,LFA-1)相互作用,促进淋巴细胞从血流中渗出进入耳蜗[12]。
2 内耳炎症的噪声性/药物性耳聋
在没有病原体的情况下,免疫细胞被召集到炎症部位以清除受损细胞碎片并促进炎症。早期炎症DAMP-PRR信号是一种进化保守的控制病原体或坏死组织传播的机制。噪声或耳毒性药物损伤后,损伤细胞释放的DAMP激活PRR导致第一波细胞——常驻巨噬细胞的迅速激活,骨髓来源的巨噬细胞和中性粒细胞试图通过非特异性手段如释放ROS杀死受损细胞,也吞噬死亡和濒死的细胞。纤维细胞比巨噬细胞有更多的机会接触DAMPs,当刺激物存在于耳蜗时,纤维细胞比巨噬细胞更早产生促炎细胞因子。巨噬细胞的积累可能作为一种代偿性反应来限制耳蜗损伤,如保护螺旋神经节(spiral ganglion cells,SGCs)[14]。第二波细胞由适应性免疫系统的T细胞组成,通过细胞碎片识别自身抗原,进一步浸润活跃的炎症区域[15]。上述炎症信号会在耳蜗中迅速产生,导致毛细胞和螺旋神经元受到不可逆的损伤[10]。多项研究表明,TLR4激活是噪声或药物(氨基糖苷或顺铂等)引起耳蜗炎症损伤的途径之一。Cai等在正常耳蜗内毛细胞和Hensen细胞中观察到TLR4的表达[16]。噪声损伤后,严重受损的外毛细胞释放的DAMPs被相邻的Deiter细胞表面的TLR-4识别并结合,随后TLR-4的上调激活了吞噬功能。推测Deiter细胞等非感觉支持细胞具有小胶质样细胞的功能,在免疫监测中可能发挥不可替代的作用[17]。研究表明,噪声暴露3 d后TLR-4及其下游信号分子MyD88和NF-κB p65亚基IκBα及其下游分子表达均上调,且血管纹、螺旋韧带和SGCs中p65核转位增加,核提取物中NF-κB与DNA的结合增加,螺旋韧带和SGCs发生DNA碎裂,推测听力损伤后螺旋韧带纤维细胞通过TLR-4/NF-κB信号通路产生促炎细胞因子参与先天免疫[18]。噪声暴露后,SGCs的促炎症作用由TNF-α、IL-1β和IL-6的表达上调实现[19]。TLR4的下游是ROS的产生和典型的NF-κB活化,NF-κB的激活和TNF-α,IL-1β和IL-6的产生。Corti氏器中的支持细胞是产生炎性因子的一个重要来源[20]。敲除Tlr4的小鼠耳蜗炎症更轻,特别是TNF-α的表达更少,从而听力损失更小[21]。
除了TLRs外,耳蜗中还发现了其他感受器分子。例如,当耳蜗组织发生变化时,定位于Hensen和Claudius细胞的视黄酸诱导基因I(RIG-I)受体家族的两个成员RIG-I和黑色素瘤分化相关基因5(MDA5)表达增加。通过对耳蜗感觉上皮中免疫相关基因的表达谱分析,RIG-I样受体信号通路是耳蜗对听觉损伤反应的潜在分子通路[7]。
3 内耳炎症与遗传性耳聋
3.1 NLRP3突变与常染色体显性遗传性耳聋
炎症反应由多种炎症小体诱导,核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptors 3,NLRP3)是关键调控蛋白,耳蜗中的单核-巨噬细胞存在可激活的NLRP3炎性小体,可能与先天免疫反应和听力损失有关[6]。
NLRP3基因编码同名蛋白NLRP3,属于核苷酸结合寡聚化结构域样受体家族,NLRs是一个细胞内天然感受器家族,是调节炎症和凋亡反应的胞质蛋白,是PRR的一种。NLRP3是固有免疫系统中被广泛研究的炎症信号通路的关键组成部分,在单核细胞、巨噬细胞和树突状细胞等免疫细胞中表达。有研究通过在Cx3cr1+细胞中检测到Nlrp3 mRNA而在Cx3cr1-细胞中未检测到,表明正常小鼠耳蜗巨噬细胞表达Nlrp3[22]。它能被多种外源性和内源性化合物同时激活,使得其成为炎症小体介导炎症反应中的关键点[23]。NLRP3炎症小体活化的初始信号包括TLRs、IL-1R、TNFR激活,上调NLRP3和pro-IL-1β的表达水平。激活信号是穿孔毒素、ATP激活通道P2X7、胞外钙离子流入导致的钾外流。激活NLRP3蛋白与半胱氨酸蛋白酶募集结构域(ASC)及半胱氨酸蛋白酶-1前体(pro-Caspase-1)组装,成型的同时活化Caspase-1。细胞焦亡是炎症小体介导的依赖于Caspase-1的细胞程序性死亡[24]。活化的Caspase-1是一种特定作用于天冬氨酸的半胱氨酸蛋白酶,可在细胞质中分割促炎因子IL-1β、IL-18的前体,使其转化为成熟的IL-1β、IL-18并释放到胞外(见图1[25])。
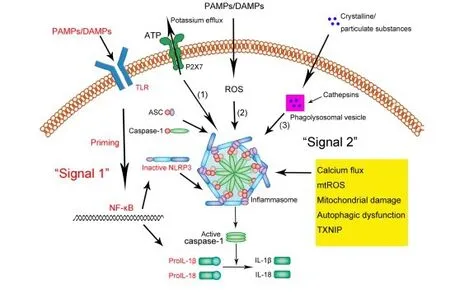
图1 NLRP3炎症小体激活示意图[25]Fig.1 Schematic illustration of the NLRP3 inflammasome activation[25]
NLRP3依据蛋白的结构和功能可划分为N-端热蛋白结构域(pyrin domain,PYD)、中间的腺苷三磷酸酶结构域(NACHT)、C-端11个亮氨酸重复序列(LRRs)3个部分(见图2[26])。位于N-端的PYD区域可以与其他蛋白PYD结构域结合,形成PYDPYD复合物,从而激活下游反应,具有募集和连接作用。如与衔接蛋白ASC(apoptosis-associated speck-like protein containing a CARD)末端 PYD区域结合形成 NLRP3-ASC复合物[26]。NACHT与ATP结合,可将其水解为二磷酸腺苷ADP释放能量,并对NLRP3下游蛋白发挥重要调控功能;LRR区域富含高度保守的亮氨酸重复序列。

图2 NLRP3蛋白结构示意图[26]Fig.2 Structure of protein NLRP3[26]
NLRP3的功能获得突变导致患者体内NLRP3炎性小体的异常激活及IL-1β的过度产生,进而促进IL-1β与IL-1R I型及其附属蛋白结合,通过级联信号转导激活细胞,进一步活化IL-18、TNF-α、IL-17等多种炎症因子,从而引发持续性炎症。可导致常染色体显性自身免疫性疾病,如Cryopyrin蛋白相关周期性综合征(CAPS)、家族性自体炎症综合征(FCAS)、Muckle-Wells综合征(MWS)和新生儿发病多系统炎症性疾病(MID)/慢性婴儿神经、皮肤和关节综合征(CINCA)。耳蜗自身炎症导致NOMID和MWS的典型症状——感音神经性聋,单一症状也被称作常染色体显性遗传性耳聋(DFNA34)[6,27]。2016年,Chen等首先报道了NLRP3蛋白在螺旋神经节有表达,NLRP3基因突变可引起综合征型和非综合征型耳聋[28]。NLRP3相关常染色体显性遗传性耳聋通常表现为为迟发性、渐进性(早期高频听力下降,随着年龄的增加涉及所有频率)。杨涛等在一个中国MWS家系中采用全外显子组测序鉴定了NLRP3 c.937G>A(p.Glu313Lys)致病新突变[29]。2017年,Nakanishi等进一步证实了NLRP3 c.2753G>A(p.Arg918Gln)可引起常染色体显性遗传性耳聋[22]。
3.2 其他小样本免疫分子变异与耳聋
干扰素这类细胞因子在内耳研究较少,最近一项研究表明IFNLR1基因突变与常染色体显性非综合征型遗传性耳聋相关[30],其致聋机制目前还不清楚。IFNLR1蛋白(Interferon Lambda Receptor 1,IFNLR1)属于Ⅱ型细胞因子受体家族,目前对其功能的研究主要基于小鼠模型。其表达位置与Ⅰ型干扰素受体相比,组织特异性更强。IFNLR1蛋白与IL-10RB蛋白结合成异二聚体,与配体Ⅲ型干扰素(IFNλs)识别并结合,激活JAK-STAT信号通路并促进干扰素刺激基因(IFN-Stimulated Genes,ISGs)转录,ISGs转录能够上调细胞表面MHCI的表达,起到调节免疫、抗病毒、抗增殖及促凋亡作用[31]。
转录因子也可以通过影响免疫因子的表达而致聋。最近一项研究发现转录因子相关基因EYA4突变与常染色体显性遗传性耳聋相关,在干扰素介导的免疫应答中起关键作用,尤其是I型干扰素基因[32]。有文献表明雌激素、经典雌激素受体(ERs)和雌激素相关受体(ERRs)在维持听觉功能中发挥关键作用。ESRRb最近也被报道与听力损失有关[33]。
自证实耳蜗并非免疫豁免器官以来,人们对内耳的免疫功能和炎症过程的研究逐步深入,这有助于丰富听觉生理及耳聋的致病机制。在感音神经性耳聋的病理生理学研究中,内耳的巨噬细胞似乎是调节内耳免疫反应的潜在靶点。
