氨基糖苷类抗生素在小鼠耳蜗毛细胞中的分布特征研究
2022-06-15吴俪媛郭瑞柳柯冀飞乔月华时晰
吴俪媛 郭瑞 柳柯 冀飞 乔月华 时晰*,5
1徐州医科大学听觉与平衡医学研究所(徐州 221004)
2首都医科大学附属北京友谊医院耳鼻咽喉头颈外科(北京 100000)
3中国人民解放军总医院耳鼻咽喉头颈外科;解放军总医院耳鼻咽喉研究所,耳鼻咽喉头颈外科国家临床研究中心,聋病教育部重点实验室,聋病防治北京市重点实验室,军事声损伤防护实验室,老年共病国家临床研究中心(北京 100853)
4徐州医科大学附属医院临床听力中心(徐州 221006)
5江苏省人工听觉重点实验室(徐州 221004)
获得性听力损失主要诱导因素包括噪声、衰老和耳毒性药物。在全世界范围内,由于使用耳毒性药物而导致的听力损失人群数量仍然十分庞大。有研究表明,药物性耳聋发生比例占发展中国家儿童和成人听力损失的3-4%,是发达国家成人听力损失的主要诱因之一[1-3]。药物性耳聋是指使用某些药物治疗疾病或长期接触某些化学制剂所引起的位听神经系统中毒性损害[4],是获得性听力损失的主要病因之一,其中,“氨基糖苷类”药物尤为多见,这类抗生素主要用于敏感需氧革兰阴性杆菌所致的全身感染[5,6]。目前多数研究认为氨基糖苷类药物的致病机制在于其与细菌30S核糖体亚单位中16S核糖体RNA(rRNA)的氨基酰基位点结合,从而改变核糖体构象导致错误蛋白合成比例增加,抑制细菌增殖[1],同时哺乳动物细胞线粒体中可能存在类似敏感结合位点,造成线粒体损伤(敏感性因人而异),因此氨基糖苷类药物可引起多器官不良反应,如剂量依赖性肾毒性和耳毒性(包括前庭和听功能受损)[1,7,8]。
已有研究表明,过度暴露于氨基糖苷类药物,比如庆大霉素等,可导致静纤毛缺损,以及内外毛细胞功能紊乱[9-11]。且持续注射庆大霉素可能会增强耳蜗对庆大霉素的摄取能力[12,13]。另有研究发现,内毛细胞带状突触更容易受到耳毒性氨基糖苷类药物的攻击,可能也是其引发听力损失的重要机制[12,14]。然而,目前关于庆大霉素被摄取后在细胞内的分布规律以及在细胞持续存在的时间等重要问题依然不明确。解析以上问题的一个主要难点在于研究人员无法精确追踪进入毛细胞内的庆大霉素,既往针对耳毒性药物毛细胞损害的研究多是呈现了应用药物以后毛细胞纤毛、细胞排列以及细胞数量破坏的证据,但是人们难以知晓这些进入毛细胞内的耳毒性药物,比如庆大霉素,在细胞内的分布情况以及药物在细胞高浓度存在的时间,因此对于耳毒性药物引起毛细胞损伤和继发的听力损害机制理解仍然较为浅显。
在本研究中,我们使用一种可被荧光标记的庆大霉素-Texas Red结合物,这使得示踪耳蜗毛细胞摄入的庆大霉素成为可能。Gentamicin conjugated to Texas Red(GTTR)是一个庆大霉素荧光直标的示踪剂,其吸收、分布、聚集和清楚的特点与庆大霉素基本相似,既往用于庆大霉素在耳蜗和肾脏研究中[15]。采用这种方法,我们可以阐明在庆大霉素暴露后药物在毛细胞及耳蜗其它重要结构中的分布方式,进一步通过延长观察时间,我们可以明确药物在毛细胞内代谢及存留情况,这将为阐明耳毒性药物损害耳蜗毛细胞结构和功能的机制提供更加直观的证据,也将为氨基糖苷类药物的科学使用提供必要理论依据。
1 材料与方法
1.1 实验动物
本次实验使用成年健康、清洁级5周龄C57BL/6J小鼠,雌雄不限,体重约为15~17g,由中国人民解放军总医院提供。经听功能检查示听力正常方可入组开始实验。将实验动物随机分为对照组、连续用药14天组和用药后恢复组(28天)共3组,每组各5只。连续用药14天组实验动物每天给予100mg/kg剂量庆大霉素腹腔注射,持续14天;用药后恢复组,在持续用药14天后暂停庆大霉素治疗至28天。本实验所有流程操作通过中国人民解放军总医院动物伦理使用委员会的批准。
1.2 庆大霉素-Texas Red复合物合成
本实验使用的耳毒性药物为庆大霉素-Texas Red结合物。庆大霉素硫酸盐溶液由庆大霉素干粉(sigma,MO,USA)溶解于100mM碳酸钾中配置而成,浓度为50mg/ml。庆大霉素溶液与德克萨斯红Texas Red(Molecular Probes,OR,USA)在 4℃环境下混合反应数日,得到庆大霉素-Texas Red结合物(GTTR)。该混合液用于庆大霉素的荧光标记,同时Texas Red不能进入细胞,且不具有耳毒性[15]。
1.3 听性脑干反应(ABR)检测
检测ABR阈值来反映小鼠的听功能。采用1%戊巴比妥钠(0.1ml/10g)对小鼠进行腹腔麻醉,分别对对照组、连续用药14天组和用药后恢复组动物进行双侧耳ABR的阈值测试。将记录电极插入实验动物的颅骨顶部,参考电极插入记录侧耳的小鼠乳突后,接地电极插入对侧耳乳突后。ABR记录在TDT系统Ⅲ诱发电位仪(Tucker-Davis Technologies,Alachua,Florida,USA)进行,重复率为20次/秒,叠加1024次,扫描时程10ms,滤波带宽80-3000 Hz。在短声(click)和短纯音(4,8,16,24kHz)时记录ABR波形。测试强度由90dB SPL开始,按10dB递减,接近阈值时按5dB逐档递减。
1.4 小鼠耳蜗获取及基底膜的制备
将小鼠引颈处死,快速断头后迅速取出耳蜗,置于盛有4%多聚甲醛的培养皿中,用镊子打开圆窗和卵圆窗,蜗尖开口,用巴氏管吸取多聚甲醛自蜗顶缓慢灌流,并于4%多聚甲醛中4℃冰箱过夜。将固定完全的耳蜗放入10%EDTA中常温脱钙6-12h,充分脱钙后,将耳蜗放入盛有0.01mmol/L PBS的培养皿中,在立体解剖显微镜下用镊子从蜗顶开始剥除蜗壳,分离基底膜和蜗轴,切除螺旋韧带和血管纹,撕去前庭膜和盖膜。
1.5 免疫荧光染色
用anti-CtBP2特异性标记耳蜗带状突触前蛋白。用含0.25%的Triton-100 PBS缓冲液对基底膜标本进行破膜处理30分钟后,用含10%山羊血清的PBS封闭孵育30分钟。然后将anti-CtBP2(Santa Cruz,CA,USA)与基底膜标本组合孵育并4℃过夜。孵育后标本在PBS中洗涤3次,并与IgG荧光素异硫氰酸酯(FITC)识别抗CtBP2(Santa Cruz,CA,USA)在37℃条件下孵育40min。孵育后,样品用PBS洗涤3次。将标本置于载玻片上并滴加DAPI液,盖玻片封片。
1.6 激光共聚焦显微镜成像
应用激光共聚焦显微镜(Leica TCS SP2 AOBS,德国)对耳蜗基底膜铺片标本进行观察,在63×油镜下观察,选择蓝色、绿色和红色激发光波长分别为405nm、488nm和543nm。对所观察区域从上到下扫描后进行叠加获得最终的结果图片。本实验用Image-J对所得影像进行荧光标记强度(OD)值的计算。首先测算仪器红色荧光的最大荧光强度值并将其设定为1.0,之后将软件测得的数值与其相比,即标本荧光强度值/荧光强度最大值,得到每组标本的荧光强度相对值。所有图像均从每组各3只小鼠收集,并在相同倍数物镜下随机取3个相同大小视野进行OD值计算。
1.7 统计学方法
本实验所有数据使用SPSS18.0软件(美国SPSS)进行统计分析。所有数据均以平均值±标准差()表示,并通过单因素方差分析进行分析。P<0.05代表组间差异具有统计学意义。
2 结果
2.1 庆大霉素暴露后小鼠听功能检测
本实验采用了100mg/kg庆大霉素-Texas Red(GTTR)用于小鼠腹腔注射,我们分别对对照组、连续用药14天组和用药后恢复组(28天)进行了ABR阈值的检测。检测结果如图所示(图1),结果发现与对照组相比,耳毒性暴露持续14天后ABR阈值显著升高(P<0.001),而停止用药14天后ABR阈值并未得到显著恢复(P>0.05)。因此,本研究提示,耳毒性庆大霉素暴露会导致小鼠的听力损失,在停止耳毒性暴露后听力并不会显著恢复。

图1 庆大霉素介导耳毒性听力损伤模型建立。A:庆大霉素暴露过程示意图。虚线框表示连续暴露庆大霉素的时间(每日腹腔注射),第15-28天是小鼠暂停暴露庆大霉素的持续时间,分别在第14天及第28天进行听功能及免疫荧光的检测;B-F:分别为耳毒性暴露对小鼠不同频率(click、4k、8k、16k、24k)的听力影响。与对照组相比,持续庆大霉素暴露14天后各个频率出现明显阈移(P<0.001)。停药后至28天,ABR各频率阈值并未得到恢复(P>0.05)。***表示P<0.001,ns表示P>0.05,n=5。Fig.1 Establishment of gentamicin mediated ototoxic hearing loss model.A:Schematic diagram of gentamicin exposure process.The dotted box indicates the time of continuous exposure to gentamicin(daily intraperitoneal injection).The auditory function and immunofluorescence were detected on the 14th and 28th days respectively;B-F:the hearing effects of ototoxic exposure on mice at different frequencies(click,4K,8K,16K and 24K).Compared with the control group,each frequency showed significant threshold shift after 14 days of continuous gentamicin exposure(P<0.001).The frequency thresholds of ABR did not recover from drug withdrawal to 28 days(P>0.05).***indicates P<0.001,ns indicates P>0.05,n=5.
2.2 庆大霉素在小鼠耳蜗毛细胞中动态分布特征
本研究采用了荧光偶联氨基糖苷(庆大霉素-Texas Red),在荧光显微镜下便于观察庆大霉素在组织中的分布。本实验中,我们分别观察比较了连续用药14天组和用药后恢复组(28天)的小鼠耳蜗基底膜中段毛细胞中的庆大霉素分布和荧光强度等指标,利用激光共聚焦显微镜拍摄并进行三维重建,来观察庆大霉素在内毛细胞和外毛细胞中的摄取和蓄积情况。研究表明,庆大霉素(箭头所示红色荧光标记)在外毛细胞核上区域及纤毛区域广泛分布,其他部位的分布则少(图2A、C)。而在内毛细胞中,庆大霉素在核上区域以及核下区域的细胞浆中均有显著分布,即使在内毛底部区域的带状突触区域,仍有较多荧光聚集(图2B、D)。
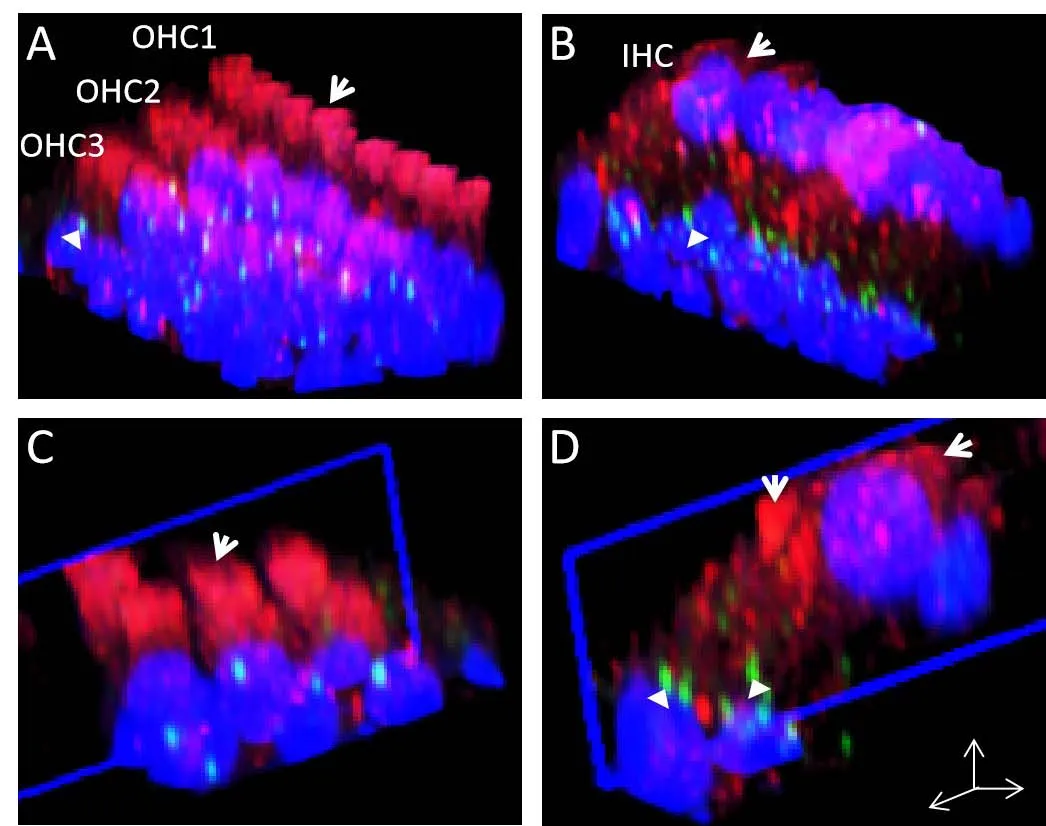
图2 庆大霉素暴露14天后在耳蜗内外毛细胞中的分布特点。A:庆大霉素连续给药14天后,3排外毛细胞中红色荧光分布细胞核上部区,该区域与外毛细胞颈部重叠(红色荧光标记,箭头);B:同样庆大霉素连续给药14天后,内毛细胞中庆大霉素分布情况,可见红色荧光在核上及核下区均有显著聚集,并且可见红色荧光与带状突触前标记物RIBEYE/CtBP2(绿色荧光,三角)位置分布存在重叠。C:庆大霉素单层外毛细胞分布侧面观,清晰可见红色荧光位于核上区,且细胞颈部区域红色荧光浓度最强;外毛细胞核下区(细胞底部)单个突触(ribbon,绿色荧光标记)区域则无红色荧光分布。D:单层内毛细胞庆大霉素分布侧面观,可见从核上区开始呈瀑布状分布的红色荧光,细胞底部标记带状突触的绿色荧光与红色荧光位置分布存在重叠。Fig.2 Gentamicin distribution in inner hair cells and outer hair cells after 14 days of continuous gentamicin exposure.A:After 14 days of continuous administration of gentamicin,the red fluorescence in 3 rows of outer hair cells was distributed in the upper part of the nucleus,which overlapped with the neck of outer hair cells(red fluorescence labeling,arrow);B:Similarly,after 14 days of continuous administration of gentamicin,the distribution of gentamicin in inner hair cells showed that the red fluorescence was significantly concentrated in the supranuclear and subnuclear areas,and the red fluorescence overlapped with the position of ribbon presynaptic marker RIBEYE/CtBP2(green fluorescence,triangle).C:From the lateral view of the distribution of gentamicin monolayer outer hair cells,it can be clearly seen that the red fluorescence is located in the supranuclear area,and the red fluorescence concentration in the cell neck area is the strongest;There was no red fluorescence distribution in the single synapse(ribbon,green fluorescence labeled)in the lower area of outer hair nucleus(cell bottom).D:From the lateral view of gentamicin distribution in monolayer inner hair cells,it can be seen that the red fluorescence is waterfall distributed from the supranuclear area,and the green fluorescence of banded synapses at the bottom of cells overlaps with the red fluorescence.
2.3 停止庆大霉素暴露后耳蜗毛细胞内庆大霉素仍有较多蓄积
为了观察停止庆大霉素腹腔连续给药后毛细胞摄取的庆大霉素是否可以快速代谢,本研究中我们对用药后恢复组(28天)小鼠耳蜗基底膜中段毛细胞内的庆大霉素进行了观察。我们发现持续庆大霉素暴露14天后,又停止给药14天(共计28天),内外毛细胞内庆大霉素分布情况与给药14天时的情况没有发生显著变化(图3A-D,P>0.05)。同时结合先前对停药14天小鼠进行的听力检测结果(图1B-F),发现和连续给药14天小鼠相比,听力恢复并不明显。综上,我们的研究表明,摄入的庆大霉素可在毛细胞内存在较长时间,而且对听力的损害可持续存在。
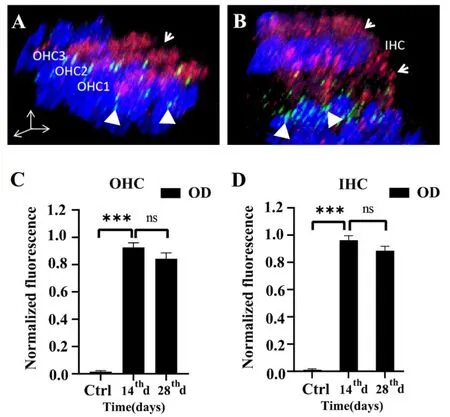
图3 停止给药后耳蜗毛细胞内庆大霉素可存留较长时间。A:停止庆大霉素给药14天后,红色荧光标记物(箭头标记)在外毛细胞核上区仍有较多分布;B:停止庆大霉素给药14天后,红色荧光标记物在内毛细胞中仍呈现瀑布状分布,覆盖内毛细胞核上区、核下区和带状突触区域(绿色荧光标记,三角)。C&D:停药14天后与连续给药14天的内外毛细胞红色荧光强度比较并无显著性差异(P>0.05)。***表示P<0.001,ns表示P>0.05,n=5。Fig.3 Gentamicin can remain in cochlear hair cells for a long time after stopping administration.A:After stopping gentamicin administration for 14 days,red fluorescent markers(arrow)were still distributed in the upper region of outer hair nucleus;B:After 14 days of suspending gentamicin treatment,the red fluorescent markers still showed waterfall distribution in inner hair cells,covering the upper nuclear area,subnuclear area and synaptic area of inner hair cells(green fluorescence,triangle).C&D:There was no significant difference in the red fluorescence intensity of inner and outer hair cells after 14 days of drug withdrawal and 14 days of continuous administra-tion(P>0.05).***indicates P<0.001,ns indicates P>0.05,n=5.
2.4 庆大霉素连续给药对毛细胞数量及排列的影响
为了观察腹腔连续注射耳毒性药物是否对毛细胞造成影响,我们对用药后恢复组(28天),即连续给药14天又停止给药14天小鼠的耳蜗基底膜中段毛细胞形态进行了DAPI荧光染色。我们发现,持续庆大霉素暴露后恢复14天组小鼠毛细胞数量及排列并未发生显著差别(图4)。
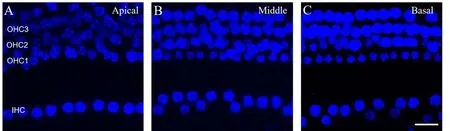
图4 庆大霉素连续给药对耳蜗毛细胞数量和排列状态无明显影响。A-C:采用DAPI染色标记耳蜗毛细胞细胞核,分别观察耳蜗顶回、中回及顶回毛细胞数量及排列状态,结果可见毛细胞排列完整,细胞数量没有明显缺失。比例尺=20μm。Fig.4 Gentamicin had no significant effect on the number and arrangement of hair cells.A-C:Hair cells were stained with DAPI to label nucleus.The number and arrangement of hair cells in the apical,middle and basal turns of cochlea were observed respectively.The results showed that the hair cells were arranged completely without obvious loss of cell number.Scale bars=20μm.
3 讨论
庆大霉素主要用于治疗敏感菌引起的肠道感染性疾病,或腹部术前肠腔清洁等,临床应用广泛。然而,随着庆大霉素使用疗程的延长和用药剂量的增加往往导致严重肾毒性和耳毒性的发生,其中耳毒性损害大部分是不可逆转的,特别是针对遗传易感性的患者[6,16]。《2016年儿童用药安全调查报告白皮书》指出,因不科学用药,我国每年约有3万名0-14岁儿童致聋。其中1-4岁儿童占比最大。不仅给众多家庭蒙上无法磨灭的阴影,同时也极大的增加了社会负担。
关于耳毒性药物损害听力及耳蜗毛细胞的研究已经进行了几十年,但是对于毛细胞是如何摄取耳毒性药物,以及其在内外毛细胞中的分布及代谢情况,人们仍然缺乏直接的研究证据。本研究借助GTTR,可以实现庆大霉素在体状态下的内耳荧光示踪,同时对停止给药后耳毒性药物在内耳毛细胞中的代谢情况进行详细观察。研究发现,荧光标记的庆大霉素分子能够在较短时间内进入耳蜗及内外毛细胞,并可在内外毛细胞内长时间驻留。受实验条件及观察时间限制,本研究未能进行更长时间的观察测试,但按本研究最长观察时间28天状态推测,荧光标记的庆大霉素分子在小鼠内耳毛细胞中存留时间理论上至少长达一个月以上。我们推测这可能与耳蜗自身的封闭特性及代谢途径密切相关。这个研究结果表明,一旦发生不当用药,体内庆大霉素分子进入内耳毛细胞后难以被快速清除代谢,因而可以对毛细胞产生较长时间的损伤效应。
本研究中条件下庆大霉素造成小鼠听力损失,但其毛细胞数量及排列并未发生变化,故我们推测该剂量下其听力损失可能并不是由于细胞数量减少或排列异常导致的,毛细胞对这种损害具有一定程度的抵抗性,或者有些形态学的损害可能会延迟出现[11,12,23],具体机制有待我们进一步研究。庆大霉素能够快速进入耳蜗毛细胞,但其在内外毛细胞中的分布情况又不近相同[17,18],其中荧光标记的庆大霉素分子在外毛细胞中主要聚集于细胞核上颈部区域,这个区域内富含MET通道[19,20],故此区域耳毒性药物的高浓度分布,很有可能损害离子通道的结构和功能,进而严重损害耳蜗的听觉功能。与此明显不同的是,庆大霉素在内毛细胞中的分布较为广泛,在细胞核上、核下以及突触带部位均有较多分布,在内毛细胞中整体呈现出“瀑布状”分布。之前的研究已经发现庆大霉素造成的耳毒性损伤效应首先发生在耳蜗内毛细胞的突触部分而非外毛细胞[12,13],本研究中观察到的内毛细胞庆大霉素的“瀑布状”分布特点,也进一步支持了之前的研究结果。
有研究认为过量使用庆大霉素导致内外毛细胞同时受损,造成明显听力损失[9-11],我们推测在大剂量耳毒性药物的暴露下,由于内外毛细胞摄入的药物量大,使得内外毛细胞不同部分的损害同时发生,因而难以准确判断耳毒性药物内外毛细胞损害部分的先后顺序。本文采用100mg/kg剂量的庆大霉素进行研究,旨在较为准确地判断耳毒性药物对耳蜗内外毛细胞损害的先后顺序,研究结果表明该剂量庆大霉素下对耳蜗损害可能主要集中在内毛细胞带状突触区域。
鉴于庆大霉素分子在内外毛细胞存在明显的分布差异,我们推测庆大霉素进入内外毛细胞的分子途径可能不完全一致:由于外毛细胞主要集中于纤毛区域,我们推测其主要路径可能经由血管纹(血迷路屏障)进入内淋巴液后,随纤毛所在的表皮板上各类通道的开放,进入外毛细胞胞体,并长期存留其顶部;而内毛细胞除上述途径外,庆大霉素分子可能也可以经由基底血管先进入corti隧道后再进入内毛细胞,所以在内毛细胞中分布更为广泛,危害也更加显著[21,22]。但上述分子路径仍有待未来的分子示踪及活体动态观察技术进一步完善后,加以确证。
总之,本研究利用荧光标记庆大霉素观察了一定时间耳毒性药物暴露后其在毛细胞中的分布特征,以及相应的听力学改变,并进一步发现毛细胞摄入的庆大霉素在细胞内存留时间较长的现象。上述特点使得针对药物性耳聋的干预变得十分具有挑战性。因此,耳毒性药物介导的药物性聋仍然要以预防性手段进行科学用药指导,广泛的科普宣传必不可少;本研究也进一步为今后氨基糖苷类药物致聋的分子机制及干预研究提供了重要的参考依据。
