KitF856S小鼠模型耳聋病理机制初步研究
2022-06-15郑凡君徐聪张晨李子博李雨青任巍郭维维赵辉
郑凡君 徐聪 张晨 李子博 李雨青 任巍 郭维维 赵辉
中国人民解放军总医院耳鼻咽喉头颈外科医学部;国家耳鼻咽喉疾病临床医学研究中心;解放军耳鼻咽喉研究所;聋病教育部重点实验室;聋病防治北京市重点实验室(北京 100853)
听觉色素障碍(Auditory-pigmentary disorders,APDs)指的是先天性感音神经性听力损失与先天性虹膜、头发或皮肤色素缺陷联合出现的一类神经嵴疾病;主要包括了Waardenburg综合征、Tietz综合征、眼白化病、斑驳病伴发先天性耳聋等[1-3]。c-KIT是人类斑驳病的主要致病基因,参与调控神经嵴细胞的发育、迁移及黑素细胞的形成、迁移、增殖和分化[4]。截止目前报道的临床病例中位于胞内激酶结构域区的突变会导致先天性色素障碍伴先天性耳聋[2,5-8]。动物模型研究报道中,KIT基因突变可出现先天性耳聋伴色素分布异常的表现,这与人类临床病例表现具有一定的相似性[9-13],这些研究加强了斑驳病与各种形式APDs的临床相似性。动物模型研究中研究者普遍认为,KIT基因功能缺失性突变后无法调控黑素细胞的迁移和分化,从而导致了血管纹中间细胞的减少和缺失,内淋巴电位消失,毛细胞无法正常产生机-电反应,导致感音神经性聋。但截止目前为止,KIT突变导致APDs的病理机制及分子机制研究仍不明确。2005年Ruan等人建立了KitF856S(Wads)小鼠模型,并对该模型纯合突变小鼠的白化、贫血、耳聋、不育和肥大细胞缺乏进行了报道,强调了该模型可用于Kit突变导致多种疾病的研究[12];但关于此模型各种病变机制均未作深入研究。由于该模型相较于之前报道的模型进一步明确了Kit突变的位点,且该位点位于KIT基因编码酪氨酸激酶结构域区,与人类临床病例报道的突变位于同一结构域区。因此利用该模型对KIT突变引起APDs耳聋的听力变化表型、病理机制及相关分子机制进行研究具有重要意义。
1 材料与方法
1.1 研究模型
KitF856S(Wads)小鼠模型,该模型由南京大学高翔教授所有,是Kit基因(c.2567T>C,p.F856S)错义突变,突变点位于18号外显子的酪氨酸激酶结构域区。
1.2 家系建立与筛选
向南京大学高翔教授申请获得使用授权后,同窝胚胎复苏后,取同窝杂合型雄鼠及杂合型雌鼠、野生型雌鼠两种配繁方式进行繁育,并对繁育后代行鼠尾基因型鉴定。
1.3 听性脑干反应测试
使用TDT RZ6系统,记录电极放置于颅顶,参考电极放置于同侧耳后,接地电极至于对侧耳后。频率分别选用短声(Click)及短声(Tone-pip)4kHz、8kHz、16kHz、24kHz、32kHz,自 最 大 输 出 功 率90dBSPL给声刺激,以引出可辨认的ABR波I波的最小声强定为阈值,刺激强度以10dBSPL递减,接近阈值时以5dBSPL递减。
1.4 扫描电镜及透射电镜
使用双束扫描电镜(美国FEI,Helios Nano lab 600i)及透射电子显微镜(美国 FEI,TECNAI Spirit120kV)。听力监测至8周,取同窝不同表型小鼠,处死后取出耳蜗,经固定脱钙后,于0.1M的PB溶液中解剖耳蜗,充分暴露膜迷路,并完整取下螺旋韧带及血管纹。将标本使用1%四氧化锇工作液进行后固定,2%单宁酸导电染色,梯度脱水并进行临界点干燥后镀膜,而后进行扫描电镜观察。梯度脱水后的血管纹分为顶、中、底三段,包埋后固化再延样品长轴超薄连续切片,行透射电子显微镜观察。
1.5 统计学方法
应用GraphPad Prism 9.0软件分析数据。各频率听力阈值用均数±标准差表示,组间采用单向方差分析,P<0.05具有显著统计学意义。
2 结果
2.1 外观毛色表型
家系内野生型小鼠与家系外C57BL/6J小鼠具有一样的外观及毛色分布表型,既全身皮肤毛色为黑色;杂合型小鼠则表现为全部具有腹部白斑及白毛,其中少量个体还有少量局部的背部白斑及白毛,四肢及尾巴靠近尾端局部皮肤白化;而纯合型小鼠则变现为全身皮肤白化及白毛。详见图1:
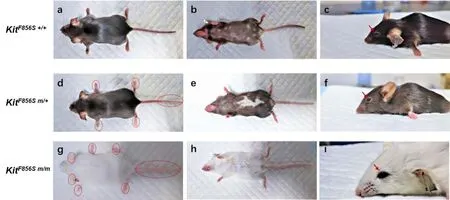
图1 同窝野生型、杂合型及纯合型小鼠毛色分布表型。ac为同窝野生型小鼠,d-f为杂合型小鼠,g-i为纯合型小鼠。红色虚线表示了杂合型小鼠及纯合型小鼠皮肤或毛色异常的位置,红色箭头标注出不同表型小鼠虹膜颜色均为黑色。Fig.1 Pigment distribution phenotype of wild-type,heterozygous and homozygous mice.a-c were wild-type mice,d-f were heterozygous mice,and g-i were homozygous mice.The red dotted lines showed abnormal skin or hair pigment in heterozygous and homozygous mice,and the red arrows showed black iris in mice with different phenotypes.
2.2 听力表型
将家系外野生型C57BL/6J小鼠及家系内不同配繁方式野生型小鼠分为3组,每组5只小鼠,对3组小鼠自2周开始每周测听至8周,发现家系外野生型小鼠及家系内不同配繁方式获得的野生型小鼠的听力形成及变化情况基本相似,在2周龄时家系外野生型小鼠的听力与家系内野生型小鼠各频有一定的统计学差异(图2)。将同窝小鼠分为野生型小鼠、杂合型小鼠、纯合型小鼠3组,对3组小鼠自3周开始每周测听至8周,野生型及杂合型小鼠听力表型总体表现为低频(click、4k、8k、16k)在3周后趋于稳定。纯合型小鼠在3周时尚有听力,而后随周龄逐渐下降,观察至8周时其听力在8k及16k两个频率仍保有一定的听力,其平均阈值分别为:78.75dBSPL和81.25dBSPL(图3、4)。
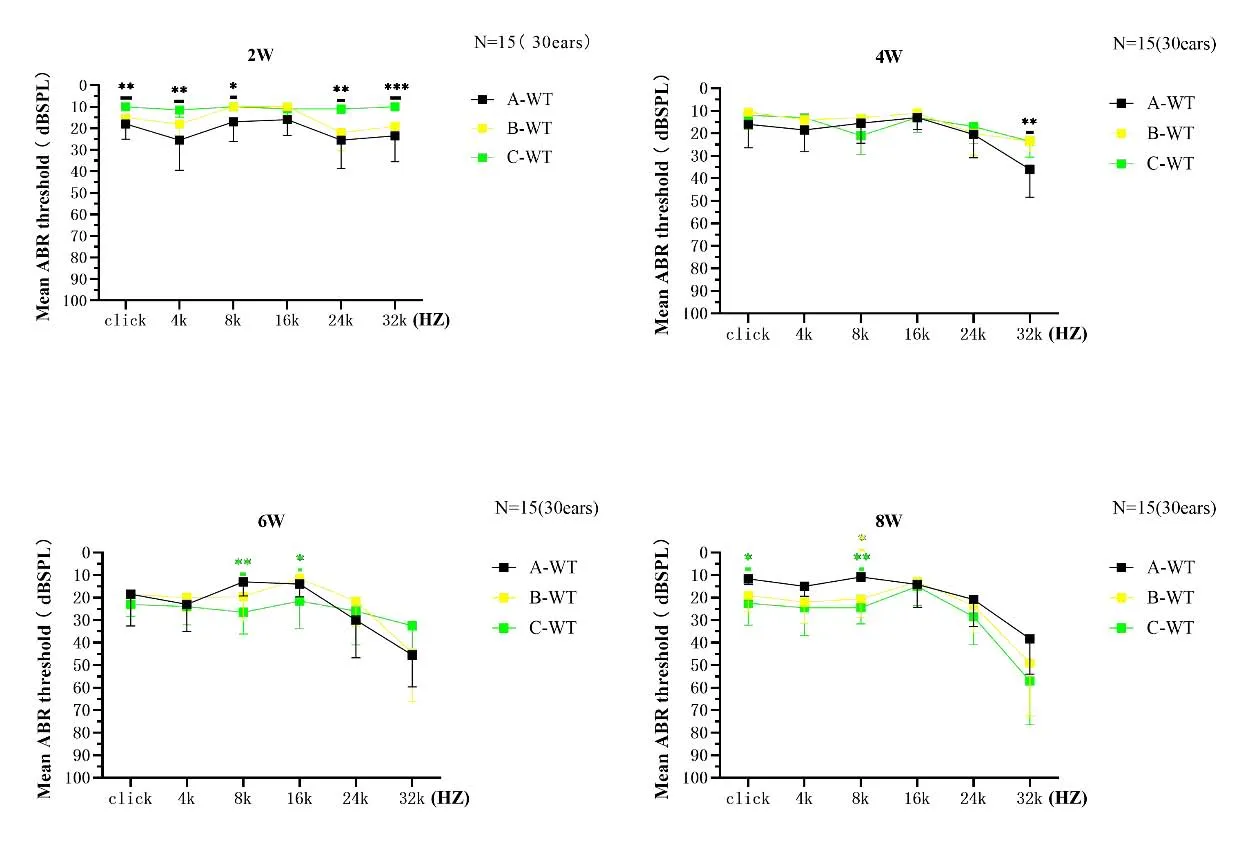
图2 家系外与家系内不同配繁方式野生型小鼠听力图。其中A-WT为家系外野生型C57BL/6J小鼠,B-WT为家系内野生型与杂合型小鼠后代中的野生型小鼠,C-WT为家系内杂合型与杂合型小鼠后代中的野生型小鼠。(***P<0.001,**P<0.01,*P<0.05)Fig.2 Audiogram of wild type mice under different breeding patterns inside the family and C57BL/6J mice.A-WT refers to wild-type C57BL/6J mice independent from the family,BWT refers to wild-type offspring mice under heterozygous with wild-type breeding pattern,C-WT refers to wild-type offspring mice under heterozygous with heterozygous breeding pattern.(***P<0.001,**P<0.01,*P<0.05)

图3 家系内不同表型小鼠听力图。(****P<0.0001)Fig.3 Audiogram of mice with different phenotypes in the family.(****P<0.0001)

图4 家系内纯合型突变小鼠听力随周龄变化图。(*P<0.05)Fig.4 Audiogramofhomozygous miceinthefamily.(*P<0.05)
2.3 家系遗传模式确认
遗传模式分析:对家系内所生小鼠于P7时取鼠尾行PCR测序,基因型鉴定,并结合听力筛查情况绘制出该模型的遗传家系图(图5)。自F1代开始对家系内杂合配杂合模式繁育的小鼠个体计数后进行卡方适合度检验提示家系的耳聋伴色素异常的遗传方式符合孟德尔常染色体隐性遗传(表1)。

表1 卡方适合度检验Table 1 Chi-square fitness test
2.4 基底膜扫描电镜
8周测听后取家系内同窝野生型、杂合型、纯合型小鼠,取耳蜗后对基底膜行扫描电镜观察,发现野生型与杂合型的三转内、外毛细胞及其他支持细胞结构无明显异常。纯合型三转的内毛细胞及其纤毛未见明显异常,外毛细胞可见部分纤毛缺失,残余头板;部分区域外毛细胞缺失,基底膜上皮化;以底转及顶转最为明显严重。(详见图6g-i所示)。

图6 同窝野生型、杂合型及纯合型小鼠基底膜扫描电镜。红色箭头所指为缺失的外毛细胞。Fig.6SEM image of basal membrane of wild-type,heterozygous and homozygous mice in the same litter.The red arrows indicated the absence outer hair cells.
2.5 血管纹透射电镜
对血管纹行透射电镜观察,发现野生型与杂合型的三转血管纹厚度、三层细胞(边缘细胞、中间细胞、基底细胞)的分布及结构无明显异常;而纯合型的三转血管纹均明显变薄,其三层细胞结构明显异常:边缘细胞结构未见明显异常,但相较于野生型个体其细胞间隔增大,紧密连接松散;中间细胞(图8中红色★)数量显著减少(图9a),其胞质中黑色素颗粒似乎相对减少,顶、中转的细胞指突紊乱,底转细胞指突消失;基底细胞(图8中红色)排列紊乱,细胞间紧密连接异常,连接疏松,与螺旋韧带屏障界限模糊;毛细血管明显减少(图9c),且在野生型及杂合型个体毛细血管周围可观察到巨噬样-黑素细胞(图8中红色),而在纯合型个体中未观察到典型的巨噬样-黑素细胞(图9b)。

图7 同窝野生型、杂合型及纯合型小鼠血管纹透射电镜。红色虚线标注为血管纹。Fig.7 TEM image of the stria vascularis of wild-type,heterozygous and homozygous mice.The red dotted lines showed the stria vascularis.

图8 同窝野生型、杂合型及纯合型小鼠血管纹透射电镜。其中红色★为中间细胞,红色为基底细胞,红色△为毛细血管,红色为巨噬样-黑素细胞。Fig.8 TEM image of the stria vascularis of wild-type,heterozygous and homozygous mice.Red★refers to the intermediate cell(IC),red refers to the basal cell(BC),red △ refers to the capillary,and redrefers to Perivascular-resident macrophage-like melanocytes(PVM).
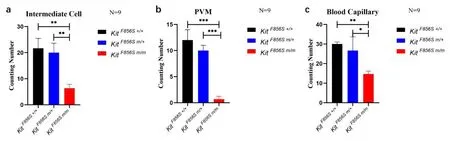
图9 透射电镜中间细胞、PVM及毛细血管计数分析图(***P<0.001,**P<0.01,**P<0.05)。Fig.9 Analysis of intermediate cells,PVM,and blood capillaries of TEM.
3 讨论
本研究再次验证了KitF856S(Wads)小鼠家系的色素分布异常伴先天性耳聋的突变性状符合孟德尔单基因常染色体隐性遗传规律。在Ruan等人关于此模型耳聋、色素分布异常、血管纹异常,Corti器可疑病理变化的基础上[12],进一步发现纯合型小鼠初期听力表现为中度耳聋,各频听力部分保留,后随周龄逐渐下降,并明确了内耳病理学的具体变化:血管纹中间细胞和毛细血管周围驻留的巨噬样-黑素细胞(Perivascular-resident macrophagelike melanocytes,PVM)的减少,毛细血管减少,基底膜外毛细胞的缺失。
该模型家系内纯合突变个体同时表现出皮肤毛色白化伴耳聋,杂合型个体表现出皮肤毛色的局部异常不伴耳聋,且二者虹膜颜色均正常(图1),其毛色分布表型与人类斑驳病表现相似。色素分布异常和耳聋两种性状同时受到Kit基因的调控,色素异常表型为显性遗传,而耳聋表型为隐性遗传。家系内不同配繁方式的野生型小鼠与家系外野生型小鼠听力变化之间在听力成熟后无明显差异,家系内杂合型和野生型小鼠听力变化之间亦无明显差异(图2、3)。说明家系内野生型小鼠及杂合型小鼠听力正常,听力表型遗传稳定。纯合型小鼠听力自形成初期已表现为全频中度听力下降,并随周龄渐进性下降(图3,4所示)。听力表型与已报道的W(s)、W(v)小鼠及W(s)大鼠的听力变化相似[9,10,14,15]。但我们注意到纯合小鼠听力低频(click、4kHz)及高频(24kHz、32kHz)早于 中 频(8kHz、16kHz)表现出随周龄下降,而8kHz、16kHz听力在16W时最大刺激无法引出(仅1只纯合型小鼠,结果未显示),其听力下降的变化与外毛细胞顶转和底转异常表现重于中转相符;而对于这一现象还需待进一步的研究。这可能与听力形成过程中耳蜗黑素细胞来源的细胞的迁移、分化等有关,而迁移的多少可能与听力损失的程度相关。我们的研究观察到纯合型小鼠血管纹中间细胞及PVM均显著减少或缺失,且毛细血管明显减少,血管纹三层细胞结构紊乱(图7、8)。耳蜗血管纹的黑素细胞是由神经嵴细胞迁移并分化来的[16,17],既往包括W(s)、W(v)小和W(s)大鼠的研究证实Kit突变可干扰神经嵴来源的黑素细胞的发育迁移,导致中间细胞数量减少,并引起EP幅值下降或缺失,出现感音神经性耳聋[9,10,14,15]。这与我们观察到的KitF856S模型纯合小鼠内耳病变一致,可能说明致病机制有一定的相似性。PVM最初被认为是巨噬细胞,但在后续的研究中发现该细胞不同于经典的巨噬细胞,还同时表达多种黑素细胞标志物,是一种混合类型的细胞,其受到局部组织环境中有害因素刺激时可产生黑色素[18,19]。而黑色素在组织稳态中发挥重要的免疫作用包括利用缓冲钙调节钙离子平衡,清除重金属、外来蛋白和脂质,并促进抗氧化活性[20,21]。同时PVM作为巨噬细胞,亦在免疫防御和修复中发挥作用[22,23]。由此可见PVM在耳蜗血管纹中的作用比我们之前理解的要更多。此外PVM和内皮细胞之间的紧密连接和信号传导对于维持完整的血迷路屏障及其正常功能都极为重要[24,25]。而在之前的研究报道中,并未对PVM进行深入的研究,W(s)大鼠研究中曾报道突变体毛细血管网的广泛性破坏,可能导致了内耳的缺血缺氧[9],这也许与我们观察注意到的PVM的减少有潜在的关系,PVM的减少和缺失可能是Kit突变致聋的另一个重要因素。纯合型小鼠基底膜外毛细胞或其纤毛部分缺失,考虑到毛细胞和血管纹的依存关系,可能是由于血管纹的异常而导致的进行性变化[26]。
结合以上讨论,我们推测Kit突变导致KitF856S突变小鼠耳聋的机制可能有以下两点:第一,Kit突变导致了血管纹中间细胞的减少甚至缺失,可能无法形成正常的EP完成机-电传导,导致耳聋。第二,Kit突变有可能影响了PVM的迁移和分化,导致血管纹毛细血管的减少或发育不良,破坏了血迷路屏障功能,导致血管纹各层组织缺血缺氧,加剧边缘细胞、基底细胞之间细胞连接(紧密连接、缝隙连接)的异常,进一步破坏了血管纹的功能。以上两点可能共同导致了毛细胞的凋亡及结构异常(纤毛消失)。
据Ruan等人报道的该模型纯合型小鼠产出较低,207只中仅有12只突变白鼠产出[12],我们在家系扩繁中遇到了同样的问题,从F2代开始杂合配杂合方式的纯合型小鼠产出率为11.5%(6/52),低于预期的25%,但具体原因不详。我们推测可能是纯合型小鼠可能有其他系统的病变,有一定的胚胎致死率,后续我们也将对于其他器官如:肾、肠等进行一定的探索研究。由于纯合突变个体数量有限,我们对于KIT基因突变导致耳聋的时空规律探索还有欠缺,KIT基因突变导致毛细胞凋亡与血管纹异常及可能存在的功能异常之间的相互关系还需进一步研究。
综上所述,KitF856S小鼠模型耳聋的病理机制是血管纹的结构异常、中间细胞及PVM的减少和外毛细胞的凋亡。该模型可以作为KIT基因突变致聋的病理机制和分子机制研究的可靠动物模型。
