褪黑素抗人晶状体上皮细胞焦亡作用及其机制
2022-06-09杨鑫刘旭辉孟佳方梦园张凤妍
杨鑫 刘旭辉 孟佳 方梦园 张凤妍
郑州大学第一附属医院眼科,郑州450052
白内障是老年人视力下降和致盲的首要原因,其发病机制尚不明确。人晶状体上皮细胞(human lens epithelium cells,HLECs)位于晶状体前表面,在维持晶状体内环境稳定方面发挥重要作用。当HLECs处于氧化应激状态时,可产生大量活性氧簇(reactive oxygen species,ROS),诱导HLECs发生焦亡,进而诱发白内障。由此可见,预防HLECs焦亡可以延缓白内障的发生和发展。褪黑素是由松果体合成分泌的一种吲哚类内分泌激素。体外实验证实,褪黑素具有抗氧化功效,对人视网膜色素上皮细胞具有保护作用。另有研究显示,褪黑素通过减少ROS水平使小鼠角膜上皮细胞免受氧化损伤。近年来研究证实,褪黑素可通过抑制NLRP3炎性小体活化抑制大鼠视网膜神经元焦亡。目前,尚未有褪黑素对HLECs焦亡作用机制的报道。本研究拟探讨褪黑素对HO诱导HLECs焦亡的抑制作用及其抗氧化机制。
1 材料与方法
1.1 材料
1.1.1
细胞来源 原代HLECs购自上海中乔新舟生物科技有限公司。1.1.2
主要试剂及仪器 内皮细胞培养基(endothelial cell medium,ECM)(上海中乔新舟生物科技有限公司);Vitamin E(上海阿拉丁生化科技股份有限公司);核转录因子E2相关因子2短发夹RNA(nuclear factor erythroid 2-related factor 2 short hairpin RNA,shNrf2)慢病毒包装(沈阳万类生物科技有限公司);褪黑素(美国Sigma公司);ROS检测试剂盒(上海碧云天生物技术有限公司);乳酸脱氢酶(lactic dehydrogenase,LDH)测定试剂盒(南京建成生物科技有限公司);人白细胞介素1β(interleukin-1β,IL-1β)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒、IL-18 ELISA试剂盒(杭州联科生物技术股份有限公司);全蛋白提取试剂盒、核蛋白和浆蛋白提取试剂盒、兔抗人Nrf2一抗(WL02135)、兔抗人核苷酸结合寡聚化结构域样受体家族pyrin结构域蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)一抗(WL02635)、兔抗人凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a C-terminal caspase recruitment domain,ASC)一抗(WL02462)、兔抗人caspase-1 p20一抗(WL02996a)、山羊抗兔IgG-HRP二抗(WLA023)(沈阳万类生物科技有限公司);兔抗人GSDMD-N一抗(ab215203)(英国Abcam公司);CO培养箱(HF-90,上海力申科学仪器有限公司);倒置相差显微镜(IX53,日本Olympus公司);流式细胞仪(NovoCyte,美国ACEC公司);酶标仪(ELX-800,美国BioTek公司)。1.2 方法
1.2.1
细胞分组及处理 HLECs接种至ECM中,待细胞生长状态良好后分为5个组,其中正常对照组细胞正常培养基培养48 h;模型对照组细胞在正常培养基条件下培养24 h后,加入100 μmol/L HO继续培养24 h;褪黑素组细胞于终浓度1×10mol/L褪黑素的培养基中预处理24 h后,加入终浓度100 μmol/L HO继续培养24 h;维生素E组和维生素E溶剂组细胞于含终浓度100 μmol/L 维生素E或相应体积溶剂(甲醇)培养基中预处理24 h后,加入终浓度100 μmol/L的HO继续培养24 h。为进一步探讨褪黑素保护HLECs的作用机制,用shNrf2慢病毒转染对数期HLECs,然后将细胞分为7个组:正常对照组细胞以正常培养基培养120 h;模型对照组细胞在正常培养基条件下培养96 h后,加入终浓度100 μmol/L HO培养24 h;shNrf2阴性对照组和shNrf2组细胞分别用shNrf2阴性对照和shNrf2慢病毒转染24 h后,弃去培养基上清,更换为完全培养基继续培养72 h后,加入终浓度100 μmol/L HO培养24 h;褪黑素组细胞在正常培养基条件下培养72 h后,用终浓度1×10mol/L 褪黑素处理24 h,然后加入终浓度100 μmol/L HO继续培养24 h;褪黑素+Nrf2阴性对照组和褪黑素+shNrf2组细胞分别用shNrf2阴性对照或shNrf2慢病毒转染24 h后,弃去培养基上清,更换为完全培养基,继续培养48 h,再用终浓度1×10mol/L褪黑素处理24 h,加入终浓度100 μmol/LHO继续培养24 h。1.2.2
倒置相差显微镜观察各组细胞焦亡情况 将细胞以5×10/孔接种在6孔板中,然后参照1.2.1方法用不同药物处理细胞。药物处理相应时间后,倒置相差显微镜下观察细胞的焦亡情况。1.2.3
ELISA法检测细胞培养上清液中IL-1β及IL-18含量 收集各组细胞培养上清,每组设3个重复,300×g
离心10 min去除沉淀物,然后严格按照IL-1β和IL-18 ELISA试剂盒说明书依次加入100 μl细胞培养上清液、50 μl IL-1β/IL-18抗体、室温孵育2 h后,每孔加入300 μl洗涤液洗涤;每孔依次加入100 μl辣根过氧化物酶标记的链霉亲和素、100 μl TMB、100 μl终止溶液后,测定450 nm最大吸收波长和570 nm参考波长下的吸光度(A
)值,校准后的A
值为450 nm的测定值减去570 nm的测定值。分别将人IL-1β、IL-18标准品按试剂盒说明书稀释成相应的浓度梯度,然后以标准品浓度为横坐标,校准A
值为纵坐标绘制标准曲线。最后根据标准曲线计算各组细胞培养上清液中IL-1β、IL-18相应的浓度。1.2.4
比色法检测细胞培养上清液中LDH活性 收集各组细胞培养上清液,每组设置3个重复,600×g
离心10 min去除沉淀物,参照LDH测定试剂盒说明书在空白孔、标准孔、测定孔、对照孔中分别加入相应工作液,混匀,室温静置5 min,设定检测波长为450 nm,使用酶标仪测定A
值。计算LDH活性[μmol/(min·L)]=(样本A
值-对照A
值)/(标准品A
值-空白A
值)×0.2×1 000;其中0.2为标准品浓度(μmol/ml)。1.2.5
流式细胞术检测细胞中ROS含量 将5×10个细胞接种于6孔板中,每组设置3个重复,分组处理后,弃去培养基,用磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤细胞2次。分别加入1 ml的DCFH-DA稀释液(用培养基1∶ 1 000稀释)混匀,置于37 ℃恒温培养箱内孵育20 min,每隔5 min颠倒混匀一次。用PBS洗涤细胞3次,充分去除未进入细胞内的DCFH-DA。最后用500 μl PBS重悬细胞后,流式细胞仪检测细胞中的荧光强度。1.2.6
Western blot法检测细胞中Nrf2、NLRP3、ASC、caspase-1 p20、GSDMD-N蛋白的表达 收集各组细胞,每组设置3个重复,弃去培养基,预冷PBS漂洗3次,在6孔板中每孔加入核蛋白和浆蛋白提取试剂盒中的抽提试剂或蛋白裂解液(含1 % PMSF的RIPA裂解液),4 ℃条件下离心半径=10 cm,12 000 r/min离心10 min,收集上清分别提取细胞核蛋白和总蛋白物,BCA法测定蛋白浓度。以SDS-PAGE凝胶电泳分离蛋白,并湿法转印至PVDF膜;将转印好的PVDF膜用质量分数5 %的脱脂奶粉室温封闭1 h;分别加入Nrf2(1∶ 500)、NLRP3(1∶ 500)、ASC(1∶ 500)、caspase-1 p20(1∶ 500)、GSDMD-N(1∶ 1 000)一抗,在4 ℃条件下孵育过夜;TBST缓冲液洗膜4次,每次5 min;置于HRP标记的山羊抗兔二抗(1∶ 5 000)中37 ℃孵育45 min,TBST缓冲液洗膜6次,每次5 min;ECL化学发光液显色,用凝胶图像处理系统(Gel-Pro-Analyzer)软件分析目标条带的灰度值,以Histone H3作为核蛋白Nrf2内参,β-actin作为NLRP3、ASC、caspase-1 p20、GSDMD-N内参,计算各目的蛋白的相对表达量。绘图时将正常对照组各蛋白表达量进行归一化处理,其他组的各蛋白数值为相对于正常对照组的比值。1.3 统计学方法
采用SPSS 20.0统计学软件进行统计分析。计量资料经Kolmogorov-Smirnov检验符合正态分布,以表示。组间数据经Levene检验证实方差齐(均P
>0.05)。各组间计量资料总体差异比较采用单因素方差分析,组间两两比较采用LSD-t
检验,P
<0.05为差异有统计学意义。2 结果
2.1 各组细胞培养上清液中IL-18、IL-1β浓度及LDH的活性浓度比较
表1 各组细胞培养上清液IL-18、IL-1β浓度及LDH活性比较(x±s)Table 1 Comparison of the expression level of IL-18,IL-1β and LDH activity amongfive groups (x±s)组别样本量LDH[μmol/(min·L)]IL-1β (pg/ml)IL-18 (pg/ml)正常对照组392.34±13.82a18.37±2.60a185.00±28.31a模型对照组3340.47±49.6162.28±8.73687.18±115.40褪黑素组3151.99±23.95a30.72±4.96a313.11±32.60a维生素E溶剂组3328.27±64.1466.06±11.49701.32±129.82维生素E组3174.78±29.92a33.56±4.01a352.30±53.22aF值22.3925.6223.44P值<0.05<0.05<0.05 注:与模型对照组比较,aP<0.05(单因素方差分析,LSD-t检验) LDH:乳酸盐脱氢酶;IL:白细胞介素 Note:Compared with model control group,aP<0.05 (One-way ANOVA,LSD-t test) LDH:lac-tate dehydrogenase;IL:interleukin

图2 各组蛋白Western blot表达电泳图 1:正常对照组;2:模型对照组;3:维生素E溶剂组;4:维生素E组;5:褪黑素组 Nrf2:核转录因子E2相关因子2;NLRP3:核苷酸结合寡聚化结构域样受体家族pyrin结构域蛋白3;ASC:凋亡相关斑点样蛋白 Figure 2 Electrophoretogram of different proteins by Western blot 1:normal control group;2:model control group;3:vitamin E solvent group;4:vitamin E group;5:melatonin group Nrf2:nuclear factor erythroid 2-related factor 2;NLRP3:nucleotide-binding oligomerization domain-like receptor protein 3;ASC:apoptosis-associated speck-like protein containing a C-terminal caspase recruitment domain
各组间IL-18、IL-1β浓度及LDH活性总体比较,差异均有统计学意义(F
=23.44、25.62、22.39,均P
<0.05)。与正常对照组相比,模型对照组细胞培养上清液中IL-18及IL-1β浓度及LDH的活性均显著升高(P
<0.05);与模型对照组相比,褪黑素组和维生素E组IL-18、IL-1β浓度及LDH的活性均降低,差异具有统计学意义(P
<0.05)(表1)。2.2 各组细胞ROS含量比较
正常对照组、模型对照组、褪黑素组、维生素E溶剂组、维生素E组细胞ROS荧光强度分别为8 292.33±653.03、18 310.33±1 248.01、13 040.67±1 550.66、19 546.67±1 288.84、12 593.67±1 677.06,总体比较差异有统计学意义(F
=35.62,P
<0.05)。正常对照组、褪黑素组和维生素E组中ROS荧光强度明显低于模型对照组,差异均有统计学意义(均P
<0.05)(图1)。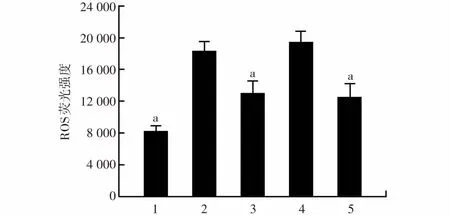
图1 各组细胞中ROS荧光强度比较 F=35.62,P<0.05.与模型对照组比较,a P<0.05(单因素方差分析,LSD-t检验,n=3) 1:正常对照组;2:模型对照组;3:褪黑素组;4:维生素E溶剂组;5:维生素E组Figure 1 Comparison of ROS level among various groups F=35.62,P<0.05.Compared with model control group,a P<0.05 (One-way ANOVA,LSD-t test,n=3) 1:normal control group;2:model control group;3:melatonin group;4:vitamin E solvent group;5:vitamin E group
2.3 各组细胞焦亡相关蛋白表达量比较
各组细胞中Nrf2、NLRP3、ASC、caspase-1 p20、GSDMD-N蛋白相对表达量总体比较差异有统计学意义(F
=42.64、54.17、71.45、91.26、55.34,均P
<0.05)。模型对照组细胞中Nrf2、NLRP3、ASC、caspase-1 p20、GSDMD-N蛋白相对表达量显著高于正常对照组,与模型对照组相比,褪黑素组和维生素E组细胞中Nrf2蛋白相对表达量显著升高,NLRP3、ASC、caspase-1 p20、GSDMD-N蛋白相对表达量显著降低,差异均有统计学意义(均P
<0.05)(图2、表2)。2.4 各细胞转染组焦亡形态
正常对照组细胞大小均匀,连接紧密,呈长梭形,无焦亡细胞。模型对照组及shNrf2阴性对照组多数细胞肿胀膨大,有气泡状突出物状典型细胞焦亡特征。与模型对照组相比,褪黑素组焦亡细胞数量减少,shNrf2组细胞焦亡数量增多。褪黑素+shNrf2组焦亡细胞数较shNrf2组减少(图3)。
表2 各组细胞焦亡相关蛋白相对表达量比较(x±s)Table 2 Comparison of relative expression levels of pyroptosis-related protein amongvarious groups (x±s)组别样本量Nrf2NLRP3ASCCaspase-1 p20GSDMD-N正常对照组31.00±0.00a1.00±0.00a1.00±0.00a1.00±0.00a1.00±0.00a模型对照组32.28±0.345.26±0.565.60±0.647.32±0.734.47±0.48褪黑素组34.24±0.44a2.63±0.29a1.67±0.27a2.17±0.29a1.66±0.21a维生素E溶剂组32.20±0.375.17±0.585.57±0.586.84±0.724.37±0.50维生素E组33.73±0.38a3.82±0.40a3.04±0.39a3.74±0.40a2.50±0.38aF值42.6454.1771.4591.2655.34P值<0.05<0.05<0.05<0.05<0.05 注:与模型对照组比较,aP<0.05(单因素方差分析,LSD-t检验) Nrf2:核转录因子E2相关因子2;NLRP3:核苷酸结合寡聚化结构域样受体家族pyrin结构域蛋白3;ASC:凋亡相关斑点样蛋白 Note:Compared with model control group,aP<0.05(One-way ANOVA,LSD-t test) Nrf2:nu-clear factor erythroid 2-related factor 2;NLRP3:nucleotide-binding oligomerization domain-like recep-tor protein 3;ASC:apoptosis-associated speck-like protein containing a C-terminal caspase recruit-ment domain

图3 各细胞转染组倒置相差显微镜图(×100,标尺=200 μm) 红色箭头示焦亡细胞 A:正常对照组 B:模型对照组 C:shNrf2阴性对照组 D:shNrf2组 E:褪黑素组 F:褪黑素+shNrf2阴性对照组 G:褪黑素+shNrf2组Figure 3 Observation of cells by phase-contrast microscopy (×100,bar=200 μm) Red arrows indicated pyroptotic cells A:normal control group B:model control group C:shNrf2 negative control group D:shNrf2 group E:melatonin group F:melatonin+Nrf2 negative control group G:melatonin+shNrf2 group
2.5 各细胞转染组培养上清液中IL-18、IL-1β质量浓度及LDH活性比较
各组细胞培养上清液中IL-18、IL-1β质量浓度及LDH活性总体比较差异均有统计学意义(F
=63.28、65.40、58.55,均P
<0.05);与模型对照组及shNrf2阴性对照组比较,shNrf2组细胞培养上清液中IL-18、IL-1β质量浓度及LDH活性升高,褪黑素+Nrf2阴性对照组IL-18、IL-1β质量浓度及LDH活性下降,差异有统计学意义(均P
<0.05);与褪黑素+shNrf2阴性对照组比较,褪黑素+shNrf2组细胞培养上清液中IL-18、IL-1β质量浓度及LDH活性均升高,差异有统计学意义(均P
<0.05)(表3)。2.6 各细胞转染组ROS含量比较
shNrf2组ROS荧光强度为24 100.67±1 298.17,显著高于模型对照组的19 120.00±1 867.73及shNrf2阴性对照组的19 077.00±2 031.08,差异均有统计学意义(F
=32.93,均P
<0.05);褪黑素+shNrf2组细胞中ROS的荧光强度为17 651.33±1 850.69,显著高于褪黑素+Nrf2阴性对照组的12 803±1 561.60,差异有统计学意义(P
<0.05)(图4)。2.7 各细胞转染组焦亡相关蛋白表达比较
各细胞转染组Nrf2、NLRP3、ASC、caspase-1 p20、GSDMD-N蛋白相对表达量总体比较差异均有统计学意义(F
=94.80、65.69、70.56、77.88、39.29,均P
<0.05)。与模型对照组和shNrf2阴性对照组比较,shNrf2组Nrf2蛋白相对表达量明显降低,NLRP3、ASC、caspase-1 p20、GSDMD-N蛋白相对表达量明显升高,差异均有统计学意义(均P
<0.05);与褪黑素+shNrf2阴性对照组相比,褪黑素+shNrf2组NLRP3、ASC、caspase-1 p20、GSDMD-N蛋白相对表达量显著升高,差异均有统计学意义(均P
<0.05)(图5,表4)。表3 各细胞转染组IL-1β、IL-18浓度及LDH活性比较(x±s)Table 3 Comparison of the expression level of IL-1β,IL-18 and LDH activity amongvarious groups (x±s)组别样本量LDH[μmol/(min·L)]IL-1β(pg/ml)IL-18(pg/ml)正常对照组382.13±13.40a16.19±2.35a172.12±18.19a模型对照组3317.30±37.1770.86±7.40716.78±84.29shNrf2阴性对照组3321.760±43.1367.70±9.37710.40±103.39shNrf2组3556.01±53.36ab119.02±11.99ab1 339.14±148.04ab褪黑素组3158.08±23.06a35.92±4.95a332.67±59.30a褪黑素+shNrf2阴性对照组3162.43±26.95ab30.89±3.84ab329.31±40.18ab褪黑素+shNrf2组3279.04±29.70c59.03±6.40c658.74±69.07cF值58.5565.4063.28P值<0.05<0.05<0.05 注:与模型对照组比较,aP<0.05;与shNrf2阴性对照组比较,bP<0.05;与褪黑素+shNrf2阴性对照组比较,cP<0.05(单因素方差分析,LSD-t检验) LDH:乳酸盐脱氢酶;IL:白细胞介素;shNrf2:Nrf2短发夹RNA Note:Compared with model control group,aP<0.05;compared with shNrf2 negative control group,cP<0.05;compared with melatonin+shNrf2 negative control group,cP<0.05(One-way ANOVA,LSD-t test) LDH:lactate dehydrogenase;IL:interleukin;shNrf2:Nrf2 short hairpin RNA

图5 各组蛋白电泳图 1:正常对照组;2:模型对照组;3:shNrf2阴性对照组;4:shNrf2组;5:褪黑素组;6:褪黑素+shNrf2阴性对照组;7:褪黑素+shNrf2组 Nrf2:核转录因子E2相关因子2;NLRP3:核苷酸结合寡聚化结构域样受体家族pyrin结构域蛋白3;ASC:凋亡相关斑点样蛋白Figure 5 Electrophoretogram of different proteins 1:normal control group;2:model control group;3:shNrf2 negative control group;4:shNrf2 group;5:melatonin group;6:melatonin+shNrf2 negative control group;7:melatonin+shNrf2 group Nrf2:nuclear factor erythroid 2-related factor 2;NLRP3:nucleotide-binding oligomerization domain-like receptor protein 3;ASC:apoptosis-associated speck-like protein containing a C-terminal caspase recruitment domain
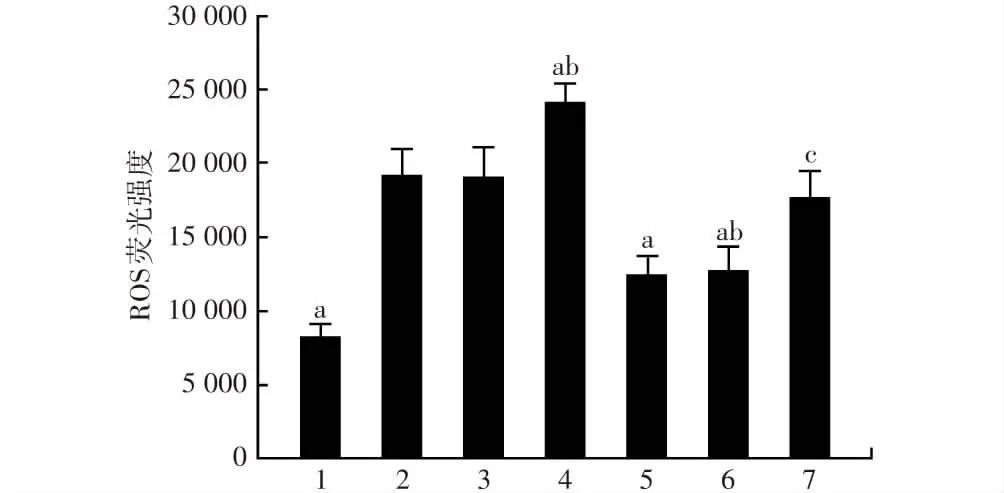
图4 各细胞转染组ROS荧光强度的比较 F=32.93,P<0.05.与模型对照组比较,a P<0.05;与shNrf2阴性对照组比较,b P<0.05;与褪黑素+shNrf2阴性对照组比较,c P<0.05 (单因素方差分析,LSD-t检验,n=3) 1:正常对照组;2:模型对照组;3:shNrf2阴性对照组;4:shNrf2组;5:褪黑素组;6:褪黑素+shNrf2阴性对照组;7:褪黑素+shNrf2组Figure 4 Comparison of ROS fluorescence intensity among various groups F=32.93,P<0.05.Compared with model control group,a P<0.05;compared with shNrf2 negative control group,b P<0.05;compared with melatonin+shNrf2 negative control group,c P<0.05 (One-way ANOVA,LSD-t test,n=3) 1:normal control group;2:model control group;3:shNrf2 negative control group;4:shNrf2 group;5:melatonin group;6:melatonin+shNrf2 negative control group;7:melatonin+shNrf2 group
3 讨论
多项研究表明,HLECs的氧化损伤对年龄相关性白内障的发病起着重要的作用,细胞内氧化代谢产物增加会对细胞产生毒性作用,引起细胞焦亡。有研究发现,HO诱导的氧化应激会促进HLECs焦亡从而导致白内障的形成。
褪黑素是经典的抗氧化药物,对角膜炎、白内障、青光眼等眼部疾病具有一定的防治作用。但其抑制HLECs焦亡的作用尚不明确。维生素E是高效的抗氧化剂和自由基清除剂,常作为抗氧化剂的阳性对照。本研究采用HO诱导的HLECs氧化损伤模型模拟白内障发病机制,以维生素E为阳性对照,系统评价褪黑素抗氧化损伤和焦亡的功效,并研究其可能的作用机制。
ROS是氧化还原反应的产物,由其引起的氧化应激被认为是细胞损伤和白内障形成的主要机制。褪黑素可以降低视网膜色素上皮细胞中ROS含量,缓解氧化应激引起的病理损伤。本研究结果也显示,与模型对照组相比,褪黑素组和维生素E组细胞中ROS水平明显下降,提示褪黑素能抵抗HO诱导的HLECs氧化损伤,对HLECs具有保护作用。
表4 各细胞转染组焦亡相关蛋白相对表达量的比较(x±s)Table 4 Comparison of the relative expression level of pyroptosis-related proteins among different cell transfection groups (x±s)组别样本量Nrf2NLRP3ASCCaspase-1 p20GSDMD-N正常对照组31.00±0.00a1.00±0.00a1.00±0.00a1.00±0.00a1.00±0.00a模型组32.61±0.382.83±0.396.12±0.605.74±0.663.65±0.42shNrf2阴性对照组32.42±0.273.07±0.376.14±0.685.66±0.713.71±0.47shNrf2组30.72±0.09ab6.44±0.65ab8.72±0.84ab7.44±0.72ab5.02±0.52ab褪黑素组35.52±0.53a2.03±0.31a2.64±0.33a1.87±0.26a1.99±0.31a褪黑素+shNrf2阴性对照组35.56±0.55ab1.83±0.22ab2.53±0.36ab1.88±0.19ab2.01±0.31ab褪黑素+shNrf2组31.87±0.27c2.93±0.34c4.43±0.44c2.60±0.31c2.64±0.35cF值94.8065.6970.5677.8839.29P值<0.05<0.05<0.05<0.05<0.05 注:与模型对照组比较,aP<0.05;与shNrf2阴性对照组比较,bP<0.05;与褪黑素+shNrf2阴性对照组比较,cP<0.05(单因素方差分析,LSD-t检验) Nrf2:核转录因子E2相关因子2;NLRP3:核苷酸结合寡聚化结构域样受体家族pyrin结构域蛋白3;ASC:凋亡相关斑点样蛋白;shNrf2:Nrf2短发夹RNA Note:Compared with model control group,aP<0.05;compared with shNrf2 negative control group,bP<0.05;compared with melatonin+shNrf2 negative control group,cP<0.05 (One-way ANOVA,LSD-t test) Nrf2:nuclear factor erythroid 2-related factor 2;NLRP3:nucleotide-binding oli-gomerization domain-like receptor protein 3;ASC:apoptosis-associated speck-like protein containing a C-terminal caspase recruitment domain;shNrf2:Nrf2 short hairpin RNA
细胞焦亡是一种新的细胞程序性、伴有炎性因子参与的死亡方式。Caspase-1是介导细胞焦亡的关键蛋白,活化的Caspase-1切割GSDMD,诱导细胞焦亡,使LDH、IL-1β、IL-18分泌到胞外,加重炎症反应。NLRP3炎症小体由Caspase-1前体与NLRP3通过接头蛋白ASC组成,参与糖尿病性视网膜病变、葡萄膜炎等眼科疾病的发病过程,与白内障的进展也存在一定关联。正常生理状态下,细胞质中的Nrf2与Keap1结合并处于相对抑制状态。当细胞发生氧化应激时,Nrf2转移至细胞核内与抗氧化反应原件(ARE)结合,激活下游抗氧化基因的转录,发挥抗氧化功效。此外,Nrf2可减少NLRP3炎性小体的激活,是抑制细胞焦亡的关键分子之一。HO会诱导细胞发生氧化应激,使Nrf2移位至细胞核,导致细胞核中Nrf2的表达应激性上调。本研究发现,HO处理使细胞中Nrf2应激性上调,同时NLRP3炎性小体的释放增加。褪黑素处理进一步增加细胞核中Nrf2的表达,抑制NLRP3炎性小体的激活。氧化应激状态下沉默Nrf2显著促进细胞中NLRP3炎症小体的激活,说明Nrf2负调控HLECs细胞中NLRP3的表达,可能在调控细胞焦亡中发挥关键作用。
大量研究表明,褪黑素能通过激活Nrf2通路抑制内质网应激,缓解细胞氧化应激水平。本研究发现用褪黑素预处理可显著上调HO诱导细胞核中Nrf2的表达,抑制NLRP3、ASC、caspase-1 p20、GSDMD-N蛋白表达,降低LDH活性,减少IL-1β、IL-18炎性因子的释放,表明褪黑素对HO诱导HLECs细胞氧化应激及焦亡具有抑制作用。为进一步验证褪黑素是否通过激活Nrf2参与调控HLECs的氧化应激及焦亡水平,本研究设计挽救实验,采用shNrf2慢病毒转染下调Nrf2表达,发现沉默Nrf2显著减弱了褪黑素的抗氧化及抗焦亡作用。Ma等研究也发现,褪黑素处理可逆转因Nrf2沉默而导致的成骨细胞死亡,提出褪黑素可通过激活Nrf2通路改善骨质疏松症。以上研究结果均提示,Nrf2参与了褪黑素对氧化应激状态下抗HLECs焦亡作用。
本研究表明,褪黑素抑制HO诱导的HLECs氧化应激损伤及细胞焦亡,其作用机制可能是通过激活Nrf2抑制ROS的产生及NLRP3炎性小体的活化,减少LDH活性以及IL-1β、IL-18炎症因子的释放,抑制caspase-1依赖的HLECs焦亡,进而发挥对HLECs的保护作用,为基于HLECs的白内障防治提供了新的思路。
利益冲突
所有作者均声明不存在任何利益冲突作者贡献声明
杨鑫:酝酿和设计实验、实施研究、采集数据、分析和解释数据、撰写文章;刘旭辉、孟佳:实施研究、采集数据、分析和解释数据;方梦园:实施研究、采集数据、数据统计分析;张凤妍:酝酿和设计实验、对文章进行指导及定稿