miR-15a对高糖诱导人晶状体上皮细胞氧化应激损伤的促进作用及其机制
2022-06-09南安超南建茹刘亚东刘向玲
南安超 南建茹 刘亚东 刘向玲
郑州大学第二附属医院眼科,郑州 450014
糖尿病性白内障(diabetic cataract,DC)是除糖尿病视网膜病变外,糖尿病患者致盲的又一重要因素。DC患者晶状体混浊进展快,晶状体体积较正常人明显增大,目前临床上主要通过手术治疗DC,但并发症发生率较高。因此,深入研究DC发病机制,寻找有效防治途径至关重要。晶状体上皮细胞(lens epithelial cells,LECs)的氧化应激损伤是高糖环境下晶状体混浊的主要原因之一。氧化应激是指机体受到刺激后,产生大量活性氧簇(reactive oxygen species,ROS),超出机体对其的清除速度,导致ROS等氧自由基在体内或细胞内蓄积,从而引起组织损伤的过程。微小RNA(microRNA,miRNA)是非编码RNA,能特异性识别靶基因的3'-非翻译区(3'-untranslated region,3'-UTR),通过与靶基因完全或部分互补结合,导致靶基因的降解或抑制其翻译。近年来的研究发现,多种miRNA在LECs的氧化应激损伤中发挥作用,参与白内障的发生和发展。miR-15a是miRNA家族成员,其在白内障患者LECs中呈异常高表达,且能诱导LECs凋亡。Cho等报道,miR-15a是糖尿病性黄斑水肿患者房水中差异表达的miRNA之一。但miR-15a与DC发生和发展的关系尚不明确。本研究拟检测DC患者LECs中miR-15a的表达情况,并探讨miR-15a对高糖环境下LECs抗氧化应激能力的影响及其可能的作用机制,为DC的发病机制及治疗靶点研究提供实验依据。
1 材料与方法
1.1 材料
1.1.1
组织标本及细胞来源 收集2018年5月至2019年10月于郑州大学第二附属医院进行超声乳化白内障摘出术的DC患者共26例26眼晶状体前囊膜组织标本作为DC组,其中男10例10眼,女16例16眼,年龄61~82岁,平均(70.35±4.56)岁;同时收集郑州大学第二附属医院健康供体26例26眼透明晶状体前囊膜组织作为正常对照组,其中男11例11眼,女15例15眼,年龄61~84岁,平均(69.73±4.49)岁。2个组晶状体前囊膜组织来源人群年龄和性别比例比较差异均无统计学意义(均P
>0.05)。永生型人LECs HLEC-B3细胞株(中科院上海细胞库)。1.1.2
主要试剂及仪器 DMEM培养基、胎牛血清(fetal bovine serum,FBS)、总抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、还原型谷胱甘肽(glutathone,GSH)、丙二醛(malondialdehyde,MDA)检测试剂盒(上海碧云天生物技术有限公司);miR-15a抑制剂、miR-15a对照(上海吉玛基因公司);Lipofectamine2000、2',7'-二氯荧光黄双乙酸盐(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针(美国Sigma公司);Trizol总RNA抽提试剂盒、CCK-8试剂盒(杭州四季青公司);兔抗人沉默信息调节蛋白1(silent information regulator 1,SIRT1)一抗(703368)、兔抗人叉头转录因子3a(forkhead transcription factor 3a,FOXO3a)一抗(PA5-104701)、兔抗人p53一抗(MA5-12557)、山羊抗兔辣根过氧化物酶标记的IgG(H+L)二抗(A32731)(美国Invitrogen公司);Annexin V FITC/PI凋亡试剂盒(美国BD公司);荧光素酶报告基因检测试剂盒(美国Abcam公司)。免疫荧光显微镜(日本Olympus公司);酶标仪(美国Biorad公司);实时荧光定量PCR仪(美国Applied Biosystems公司);紫外分光光度计(德国Eppendorf公司);流式细胞仪(美国BD公司)。1.2 方法
1.2.1
晶状体前囊膜的收集 (1)DC组晶状体前囊膜 DC患者行超声乳化白内障摘出术过程中,常规连续环形撕囊后,取出直径5.5~6.5 mm前囊膜,双蒸水冲洗后,分成2份,置入冻存管中于-80 ℃保存备用。(2)正常对照组晶状体前囊膜 无菌条件下环形剪下完整角膜,在手术显微镜下剪开眼球,清除晶状体悬韧带、房水、玻璃体及黏附血液等成分,完整取出透明晶状体,从透明晶状体前部旁中心环形撕取前囊膜中央及周边5.5 mm×5.5 mm范围的前囊膜,双蒸水分离,清除晶状体皮质,PBS冲洗后,分成2份,置于冻存管中于-80 ℃保存备用。本研究经郑州大学第二附属医院伦理委员会审核批准(批文号:ZDEFY201803160023),研究对象均签署知情同意书。1.2.2
实时荧光定量PCR法检测晶状体前囊膜组织中miR-15a表达 取冻存的DC组和正常对照组晶状体前囊膜组织各1份标本于液氮预冷的研钵中研磨成粉末,加1 ml Trizol试剂,参照Trizol总RNA抽提试剂盒说明书提取总RNA,并逆转录为cDNA。取2 μl模板cDNA进行PCR扩增,U6引物:正向序列为5'-GCTTAGCTTCGATCGGCTAA-3',反向序列为5'-GCTTAGCTAGGCCCTACCAC-3';miR-15a引物:正向序列为5'-CGTTTCGATTGCCATTACGC-3',反向序列为5'-GCTTTAGGCTAGCCATGCTT-3'。实验所用引物由生工生物工程(上海)股份有限公司合成。扩增条件:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,共35个循环;72 ℃总延伸6 min。以U6为内参照,采用2相对定量法计算miR-15a的相对表达量。实验独立重复3次。1.2.3
Western blot法检测晶状体前囊膜组织中SIRT1蛋白的表达 取剩余冻存的DC组和正常对照组晶状体前囊膜组织各1份,剪切成小块,称质量,装入1 ml玻璃匀浆器中,按每20 mg组织100~200 μl的比例加入蛋白裂解液,在冰水中匀浆裂解1 min,14 000×g
离心5 min,取上清,检测蛋白浓度。取蛋白样品加入SDS-PAGE凝胶加样孔进行电泳,并转移至PVDF膜,用质量分数5%脱脂奶粉室温封闭2 h,TBST温和洗膜3 min,加入SIRT1(1∶ 500)或β-actin(1∶ 800)一抗,4 ℃孵育过夜,TBST洗涤3次,每次10 min,加入对应二抗(1∶ 1 000),室温下孵育1 h,TBST洗涤3次,每次10 min,加入配制好的ECL发光液,避光孵育5 min,化学发光凝胶成像仪中采集图片信息。采用Image pro plus 6.0软件进行条带灰度分析,以β-actin为内参照,计算SIRT1蛋白相对表达量。实验独立重复3次。1.2.4
HLEB-3细胞氧化应激模型的制备 将冻存的HLEB-3细胞解冻、复苏,使用含体积分数10%FBS的DMEM培养基重悬细胞并接种于96孔板中,将细胞置于37 ℃、体积分数5% CO培养箱内培养,每2天换液1次,细胞融合近80%时,更换为不含FBS的DMEM培养基并分别加入终浓度为0、10、20和50 mmol/L葡萄糖,每个浓度设置6个复孔,于培养箱中继续培养24 h。光学显微镜下观察细胞形态学改变。1.2.5
细胞转染 取对数期HLEB-3细胞以2×10/孔的密度接种于6孔板,将细胞分为miR-15a对照组和miR-15a抑制剂组,按照转染试剂Lipofectamine2000说明书分别转染miR-15a对照和miR-15a抑制剂,每组设置6个复孔,转染细胞8 h后,将各组细胞转移至含50 mmol/L葡萄糖的完全培养基继续培养。1.2.6
流式细胞术检测各组细胞凋亡率 取不同浓度葡萄糖以及各转染组培养24 h的HLEB-3细胞,胰蛋白酶消化,预冷PBS洗涤2次,离心半径10 cm,2 000 r/min离心并弃上清,将细胞重悬于200 μl结合缓冲液中,加入5 μl Annexin V-FITC混匀,室温条件下避光反应15 min,继续加入300 μl结合缓冲液,上样前加入5 μl PI,于1 h内采用流式细胞仪检测细胞凋亡率。左下象限为活细胞,左上象限为死亡细胞,右上象限为晚期凋亡细胞,右下象限为早期凋亡细胞,细胞凋亡率=早期凋亡率+晚期凋亡率。实验独立重复3次。将于50 mmol/L葡萄糖条件下培养24 h的各转染组细胞,采用上述方法检测细胞凋亡率。实验独立重复3次。1.2.7
DCFH-DA荧光探针法检测各组细胞内源性ROS含量 将细胞以1×10/孔的密度接种于96孔板,用不同浓度葡萄糖培养24 h,吸去培养液,加入10 μmol/L DCFH-DA荧光探针溶液,培养箱中孵育20 min,预冷的PBS洗涤细胞,采用多功能酶标仪检测荧光强度值,用激光扫描共聚焦显微镜拍照,设置激发光波长为485 nm,发射光波长为530 nm。实验独立重复3次。取50 mmol/L葡萄糖条件下培养24 h的各转染组细胞,采用上述方法计算细胞内ROS含量。实验独立重复3次。1.2.8
试剂盒检测各组细胞T-AOC、SOD、GSH-Px、GSH活性及MDA浓度 取不同浓度葡萄糖培养24 h的细胞以及50 mmol/L葡萄糖条件下培养24 h的各转染组细胞,采用相应试剂盒说明书中的步骤,以铁还原法检测细胞中T-AOC活性,以黄嘌呤氧化酶法检测SOD活性,以二硫代二硝基苯甲酸法检测GSH-Px和GSH活性,以硫代巴比妥法检测MDA浓度。实验独立重复3次。1.2.9
实时荧光定量PCR法检测各组细胞内miR-15a表达 取不同浓度葡萄糖培养24 h的细胞,采用1.2.2方法提取并计算miR-15a的相对表达量。实验独立重复3次。1.2.10
Western blot法检测各组细胞内SIRT1、FOXO3a、p53蛋白表达 收集不同浓度葡萄糖培养24 h的细胞,RIPA裂解液提取总蛋白,按照1.2.3方法进行Western blot检测,其中SIRT1(1∶ 500)、FOXO3a(1∶ 500)、p53(1∶ 1 000)、β-actin(1∶ 800)一抗4 ℃孵育过夜,二抗(1∶ 1 000)室温下孵育1 h。以β-actin为内参照,计算各目的蛋白相对表达量。实验独立重复3次。取50 mmol/L葡萄糖培养24 h的各转染组细胞,以上述方法检测细胞内SIRT1、FOXO3a、p53蛋白的相对表达量。实验独立重复3次。1.2.11
miR-15a靶基因预测及双荧光素酶报告基因分析 为了确定miR-15a在HLEB-3细胞中发挥生物学功能的靶向作用点,利用miRanda、TargetScan数据库预测miR-15a的潜在靶基因,其中SIRT1在miR-15a的3'UTR上有结合位点。将对数期细胞以2×10/孔的密度接种于24孔板,以Renilla荧光素酶质粒(100 ng/孔)转染作为对照,用Lipofectamine2000将荧光素酶报告载体[SIRT1-3'-UTR-野生型(wild type,WT)或SIRT1-3'UTR-突变型(mutant type,MUT)]与miR-15a对照和抑制剂共转染至细胞。细胞转染24 h,用双荧光素酶报告基因检测试剂盒测定荧光素酶活性。实验独立重复3次。1.3 统计学方法
采用SPSS 19.0统计学软件进行统计分析。计量资料经Shapiro-Wilk检验呈正态分布,以表示,组间数据经Levene检验方差齐。不同浓度葡萄糖条件下细胞各检测指标差异总体比较采用单因素方差分析,多重比较采用LSD-t
检验。miR-15a对照组和miR-15a抑制剂组间各检测指标差异比较采用独立样本t
检验。P
<0.05为差异有统计学意义。2 结果
2.1 各组晶状体前囊膜组织中miR-15a和SIRT1的表达比较
正常对照组中miR-15a相对表达量明显低于DC组,差异有统计学意义(t
=12.231,P
<0.001)。正常对照组SIRT1蛋白条带灰度明显强于DC组,2个组间SIRT1蛋白相对表达量比较,差异有统计学意义(t
=8.964,P
<0.001)(图1,表1)。
图1 各组晶状体前囊膜组织中SIRT1蛋白表达电泳图 DC组SIRT1蛋白条带强度较正常对照组明显减弱 DC:糖尿病性白内障;SIRT1:沉默信息调节蛋白1Figure 1 Electropherogram of SIRT1 protein in the anterior lens capsule The SIRT1 protein band intensity was significantly weakened in DC group in comparison with normal control group DC:diabetic cataract;SIRT1:silent information regulator 1
表1 2个组miR-15a和SIRT1蛋白相对表达量比较(x±s)Table 1 Comparison of relative expression levels of miR-15a and SIRT1 protein between two groups (x±s)组别样本量miR-15a相对表达量SIRT1蛋白相对表达量正常对照组30.21±0.020.89±0.09DC组30.96±0.100.31±0.05t值12.2318.964P值<0.001<0.001 注:(独立样本t检验) miR:微小RNA;SIRT1:沉默信息调节蛋白1;DC:糖尿病性白内障 Note:(Independent samples t test) miR:microRNA;SIRT1:silent information regulator 1;DC:diabetic cataract
2.2 不同浓度葡萄糖处理细胞形态学改变
0 mmol/L葡萄糖处理的HLEB-3细胞大小均一,边缘光滑,细胞贴壁紧密。随着葡萄糖浓度的增加,细胞形态变得不规则,细胞皱缩,贴壁松弛,细胞边缘呈毛刺样突起(图2)。

图2 不同浓度葡萄糖处理细胞形态学观察(×200,标尺=100 μm) 0 mmol/L葡萄糖处理的细胞形状规则,数量较多,随着浓度的增加,细胞形状发生改变,数量减少 A:0 mmol/L B:10 mmol/L C:20 mmol/L D:50 mmol/LFigure 2 Morphological observation of HLEB-3 cells after treatment of different concentrations of glucose (×200,bar=100 μm) Cells treated with 0 mmol/L glucose were in regular shape and the number was large.With the increase of glucose concentration,the shape of cells changed and the number decreased A:0 mmol/L B:10 mmol/L C:20 mmol/L D:50 mmol/L
表2 不同浓度葡萄糖处理细胞中miR-15a、SIRT1、FOXO3a和p53蛋白相对表达量比较(x±s)Table 2 Comparison of relative expression levels of miR-15a,SIRT1,FOXO3a and p53 proteins in HLEB-3 cells after treatment of different concentrations of glucose (x±s)葡萄糖浓度样本量miR-15a相对表达量SIRT1蛋白相对表达量FOXO3a蛋白相对表达量p53蛋白相对表达量0 mmol/L30.21±0.050.89±0.120.18±0.040.10±0.0210 mmol/L30.43±0.07a0.65±0.08a0.32±0.03a0.31±0.03a20 mmol/L30.62±0.04ab0.41±0.06ab0.51±0.08ab0.46±0.05ab50 mmol/L30.82±0.11abc0.17±0.03abc0.66±0.04abc0.57±0.06abcF值38.90445.53450.77167.135P值<0.001<0.001<0.001<0.001 注:与0 mmol/L葡萄糖比较,aP<0.05;与10 mmol/L葡萄糖比较,bP<0.05;与20 mmol/L葡萄糖比较,cP<0.05(单因素方差分析,LSD-t检验) miR:微小RNA;SIRT1:沉默信息调节蛋白1;FOXO3a:叉头转录因子3a Note:Compared with 0 mmol/L glucose,aP<0.05;compared with 10 mmol/L glucose,bP<0.05;compared with 20 mmol/L glucose,cP<0.05 (One-way ANOVA,LSD-t test) miR:microRNA;SIRT1:silent information regulator 1;FOXO3a:forkhead transcription factor 3a
2.3 不同浓度葡萄糖处理细胞内miR-15a及SIRT1、FOXO3a和p53蛋白表达比较
细胞中miR-15a相对表达量随着葡萄糖浓度的增加而增加,总体比较差异有统计学意义(F
=38.904,P
<0.001)。细胞中FOXO3a和p53蛋白条带相对灰度值随着葡萄糖浓度的增加而增强,SIRT1蛋白条带相对灰度值随着葡萄糖浓度的增加而减弱;各不同浓度葡萄糖条件下细胞中FOXO3a、p53和SIRT1蛋白相对表达量总体比较差异均有统计学意义(F
=50.771、67.135、45.534,均P
<0.001)。各不同浓度葡萄糖条件下细胞中miR-15a、FOXO3a、p53和SIRT1相对表达量两两比较,差异均有统计学意义(均P
<0.05)(图3,表2)。2.4 不同浓度葡萄糖处理细胞凋亡率比较
0、10、20和50 mmol/L葡萄糖处理细胞的凋亡率分别为(3.02±0.47)%、(10.20±0.91)%、(13.32±2.01)%和(25.40±1.46)%,总体比较差异有统计学意义(F
=13.311,P
<0.001);随着葡萄糖浓度增加,细胞凋亡率升高,组间比较差异均有统计学意义(均P
<0.05)(图4)。2.5 不同浓度葡萄糖处理细胞内ROS表达比较
0、10、20和50 mmol/L葡萄糖处理细胞内源性ROS荧光强度分别为42.12±10.32、92.43±15.65、153.65±17.43和218.65±24.83,总体比较差异有统计学意义(F
=11.320,P
<0.001);随着葡萄糖浓度增加,ROS荧光强度随之增强,组间比较差异均有统计学意义(均P
<0.05)(图5)。2.6 不同浓度葡萄糖处理细胞T-AOC、SOD、GSH-Px活性和MDA浓度比较
不同浓度葡萄糖处理细胞T-AOC、SOD、GSH-Px活性和MDA浓度总体比较差异均有统计学意义(F
=178.410、182.238、133.766、191.744,均P
<0.001);随着葡萄糖浓度增加,细胞产生T-AOC、SOD、GSH-Px活性下降,MDA浓度升高,组间比较差异均有统计学意义(均P
<0.05)(表3)。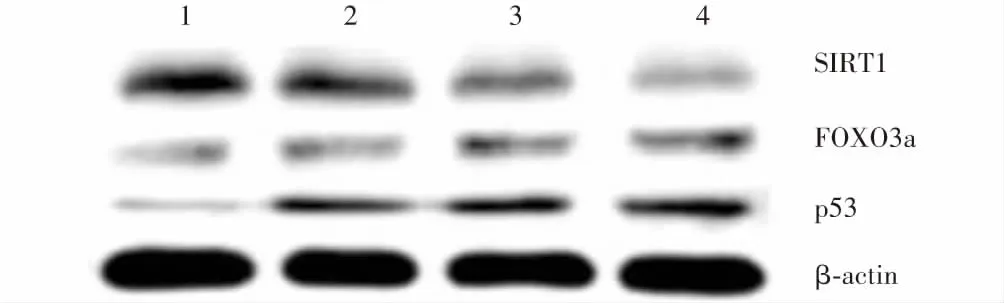
图3 各组不同浓度葡萄糖处理细胞中SIRT1、FOXO3a和p53表达电泳图 随着葡萄糖浓度升高,细胞中FOXO3a和p53蛋白条带逐渐增强,SIRT1蛋白条带逐渐减弱 SIRT1:沉默信息调节蛋白1;FOXO3a:叉头转录因子3a 1:0 mmol/L葡萄糖;2:10 mmol/L葡萄糖;3:20 mmol/L葡萄糖;4:50 mmol/L葡萄糖Figure 3 Electropherogram of SIRT1,FOXO3a and p53 proteins in cells treated with different concentrations of glucose With the increase of glucose concentration,the intensity of FOXO3a and p53 protein bands increased,and the intensity of SIRT1 protein band decreased SIRT1:silent information regulator 1;FOXO3a:forkhead transcription factor 3a 1:0 mmol/L glucose;2:10 mmol/L glucose;3:20 mmol/L glucose;4:50 mmol/L glucose
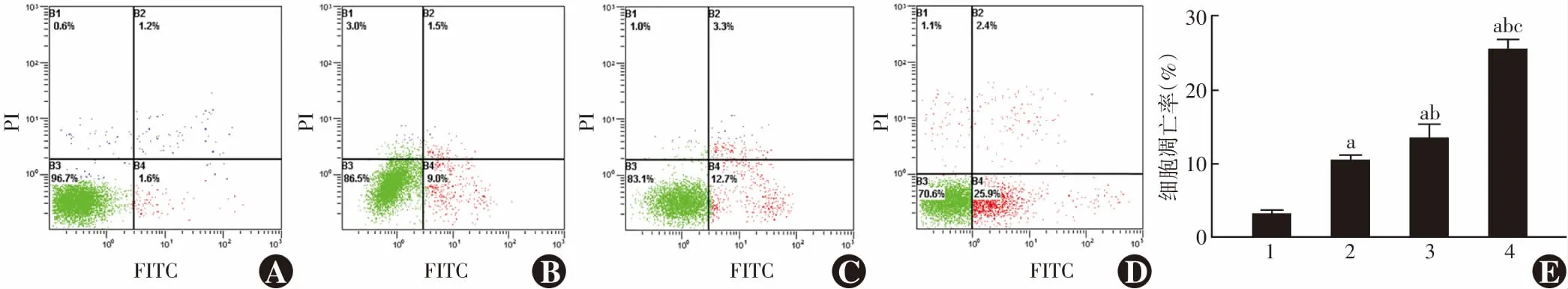
图4 不同浓度葡萄糖处理细胞凋亡率比较 A~D:0、10、20、50 mmol/L葡萄糖处理细胞流式细胞图(FITC/PI) E:细胞凋亡率量化比较 细胞凋亡率随着葡萄糖浓度的增加而升高 与0 mmol/L葡萄糖比较,a P<0.05;与10 mmol/L葡萄糖比较,b P<0.05;与20 mmol/L葡萄糖比较,c P<0.05(单因素方差分析,LSD-t检验,n=3) 1:0 mmol/L葡萄糖;2:10 mmol/L葡萄糖;3:20 mmol/L葡萄糖;4:50 mmol/L葡萄糖Figure 4 Comparison of apoptosis of HLEB-3 cells treated with different concentrations of glucose A-D:Flow cytometry of cells treated with 0,10,20,50 mmol/L glucose (FITC/PI) E:Quantitative comparison of apoptosis rates Apoptosis rate was enhanced with increasing glucose concentration Compared with 0 mmol/L glucose,a P<0.05;compared with 10 mmol/L glucose,b P<0.05;compared with 20 mmol/L glucose,c P<0.05 (One-way ANOVA,LSD-t test,n=3) 1:0 mmol/L glucose;2:10 mmol/L glucose;3:20 mmol/L glucose;4:50 mmol/L glucose

图5 不同浓度葡萄糖处理细胞内ROS表达比较 A~D:0、10、20、50 mmol/L葡萄糖处理细胞荧光染色图(DCFH-DA ×400,标尺=200 μm) 随着葡萄糖浓度的增加,ROS荧光强度随之增强 E:不同浓度葡萄糖处理细胞ROS荧光强度量化比较 与0 mmol/L葡萄糖比较,a P<0.05;与10 mmol/L葡萄糖比较,b P<0.05;与20 mmol/L葡萄糖比较,c P<0.05(单因素方差分析,LSD-t检验,n=3) ROS:活性氧簇 1:0 mmol/L葡萄糖;2:10 mmol/L葡萄糖;3:20 mmol/L葡萄糖;4:50 mmol/L葡萄糖Figure 5 Comparison of ROS expression in HLEB-3 cells after treatment of different concentrations of glucose by DCFH-DA A-D:DCFH-DA staining of HLEB-3 cells treated with 0,10,20,50 mmol/L glucose (×400,bar=200 μm) The ROS fluorescence was enhanced as the glucose concentration increased E:Quantitative comparison of ROS fluorescence intensity Compared with 0 mmol/L glucose group,a P<0.05;compared with 10 mmol/L glucose group,b P<0.05;compared with 20 mmol/L glucose group,c P<0.05 (One-way ANOVA,LSD-t test,n=3) ROS:reactive oxygen species 1:0 mmol/L glucose;2:10 mmol/L glucose;3:20 mmol/L glucose;4:50 mmol/L glucose
表3 不同浓度葡萄糖处理细胞T-AOC、SOD、GSH-Px活性和MDA浓度比较(x±s)Table 3 Comparison of T-AOC,SOD,GSH-Px activities and MDA concentration in HLEB-3 cells after treatment of different concentrations of glucose (x±s)葡萄糖浓度样本量T-AOC活性值[mol/(min·L)]SOD活性值[mol/(min·L)]GSH-Px活性值[mol/(min·L)]MDA浓度(μmol/L)0 mmol/L38.01±0.5287.32±4.21173.10±7.9232.13±1.0310 mmol/L35.32±0.39a65.34±3.11a128.34±8.03a44.92±2.01a20 mmol/L33.22±0.41ab53.02±2.97ab102.31±4.22ab58.31±3.10ab50 mmol/L31.03±0.08abc24.66±2.96abc73.66±3.86abc75.65±2.65abcF值178.410182.238133.766191.744P值<0.001<0.001<0.001<0.001 注:与0 mmol/L葡萄糖比较,aP<0.05;与10 mmol/L葡萄糖比较,bP<0.05;与20 mmol/L葡萄糖比较,cP<0.05(单因素方差分析,LSD-t检验) T-AOC:总抗氧化能力;SOD:超氧化物歧化酶;GSH-Px:谷胱甘肽过氧化物酶;MDA:丙二醛 Note:Compared with 0 mmol/L glucose,aP<0.05;compared with 10 mmol/L glucose,bP<0.05;compared with 20 mmol/L glucose,cP<0.05 (One-way ANOVA,LSD-t test) T-AOC:total-antioxidative capability;SOD:superoxide dismutase;GSH-Px:glutathione peroxidase;MDA:malon-dialdehyde
2.7 各转染组转染效率比较
细胞荧光图显示,miR-15a抑制物组和miR-15a对照组细胞均呈明显绿色荧光,转染成功,转染率分别为90.7%和93.5%(图6)。
2.8 不同转染组细胞凋亡率比较
miR-15a对照组细胞凋亡率为(35.22±2.04)%,明显低于miR-15a抑制剂组的(17.3±1.05)%,差异有统计学意义(t
=10.320,P
<0.001)(图7)。2.9 不同转染组细胞ROS表达比较
miR-15a抑制剂组细胞ROS荧光强度为63.22±7.31,低于miR-15a对照组的135.31±12.33,差异有统计学意义(t
=14.422,P
<0.001)(图8)。2.10
不同转染组细胞T-AOC、SOD、GSH-Px活性和MDA浓度比较miR-15a对照组细胞T-AOC、SOD、GSH-Px活性显著低于miR-15a抑制剂组,差异有统计学意义(t
=10.155、12.616、12.874,均P
<0.001),MDA浓度显著高于miR-15a抑制剂组,差异有统计学意义(t
=14.631,P
<0.001)(表4)。
图6 miR-15a抑制剂组和miR-15a对照组细胞转染荧光图(×200,标尺=50 μm) 各组细胞均呈明显绿色荧光,转染成功率高 A:miR-15a对照组 B:miR-15a抑制剂组Figure 6 Transfection fluorescence of miR-15a inhibitor group and miR-15a NC transfection group (×200,bar=50 μm) Cells in both groups showed green fluorescence with high transfection rate A:miR-15a control group B:miR-15a inhibitor group
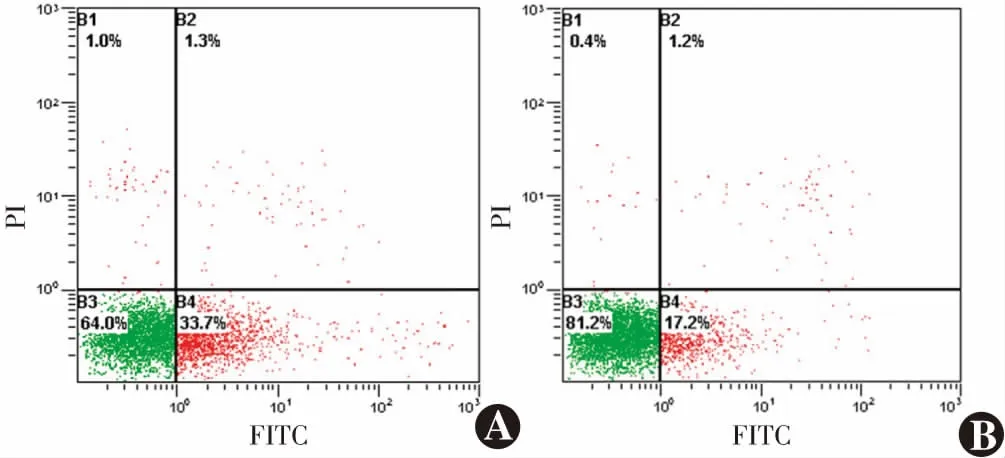
图7 不同转染组流式细胞图(FITC/PI) miR-15a对照组细胞凋亡率较miR-15a抑制剂组明显降低 A:miR-15a对照组 B:miR-15a抑制剂组Figure 7 Flow cytometry of HLEB-3 cells in two transfection groups (FITC/PI) The apoptosis rate of miR-15a control group was significantly lower than that of miR-15a inhibitor group A:miR-15a control group B:miR-15a inhibitor group
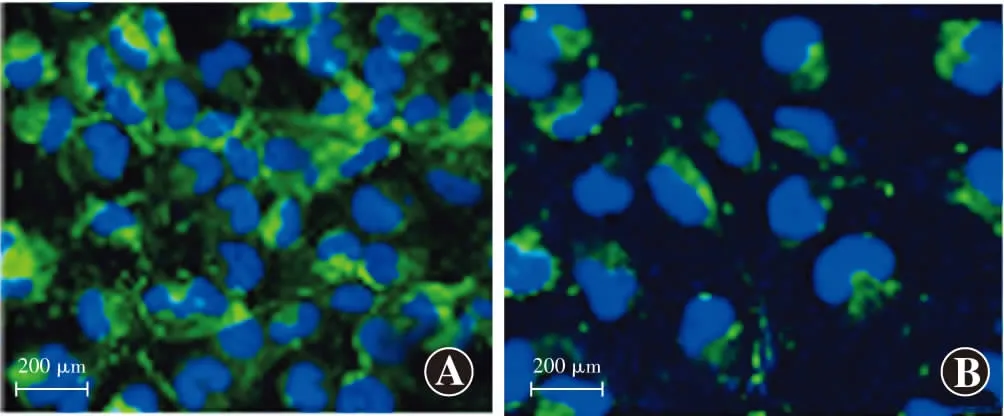
图8 不同转染组细胞内ROS荧光染色图(DCFH-DA ×400,标尺=200 μm) miR-15a抑制剂组细胞ROS荧光微弱,miR-15a对照组细胞ROS荧光较强。DCFH-DA染色呈绿色荧光,细胞核染色呈蓝色荧光(DAPI) A:miR-15a对照组 B:miR-15a抑制剂组Figure 8 Fluorescence staining of ROS expression in cells of two transfection groups (DCFH-DA ×400,bar=200 μm) The ROS fluorescence was weak in miR-15a inhibitor group and strong in miR-15a control group.DCFH-DA staining showed green fluorescence,and nuclei were in blue fluorescence (DAPI) A:miR-15a control group B:miR-15a inhibitor group
2.11
miR-15a靶基因预测miR-15a靶基因预测发现,miR-15a与SIRT1保守位点有高分数结合,SIRT1为miR-15a的一个潜在作用靶点(图9)。双荧光素酶报告系统结果显示,miR-15a对照组SIRT1-3'-UTR-WT报告基因的荧光素酶活性明显低于miR-15a抑制剂组,差异有统计学意义(t
=5.978,P
=0.004),2个组SIRT1-3'-UTR-MUT报告基因的荧光素酶活性差异无统计学意义(t
=0.432,P
=0.688)(表5)。表4 各转染组细胞T-AOC、SOD、GSH-Px活性和MDA浓度比较(x±s)Table 4 Comparison of T-AOC,SOD,GSH-Px activities and MDA concentration of cells between two transfection groups (x±s)组别样本量T-AOC活性值[mol/(min·L)]SOD活性值[mol/(min·L)]GSH-Px活性值[mol/(min·L)]MDA浓度(μmol/L)miR-15a对照组34.04±0.4851.32±2.6694.44±3.5364.76±3.66miR-15a抑制剂组38.32±0.5586.43±4.02158.96±7.9332.17±1.22t值10.15512.61612.87414.631P值0.001<0.001<0.001<0.001 注:(独立样本t检验) T-AOC:总抗氧化能力;SOD:超氧化物歧化酶;GSH-Px:谷胱甘肽过氧化物酶;MDA:丙二醛;miR:微小RNA Note:(Independent samples t test) T-AOC:total-antioxidative capabili-ty;SOD:superoxide dismutase;GSH-Px:glutathione peroxidase;MDA:malondialdehyde;miR:microRNA

图9 miR-15a靶基因预测 生物信息软件检测miR-15a与SIRT1存在潜在结合位点 miR:微小RNA;SIRT1:沉默信息调节蛋白1;UTR:非翻译区;WT:野生型;MT:突变型Figure 9 miR-15a target gene prediction Bioinformatics software detects potential binding sites of miR-15a and SIRT1 miR:microRNA;SIRT1:silent information regulator 1;UTR:untranslated region;WT:wild type;MT:mutant type
表5 miR-15a靶基因预测结果比较(x±s)Table 5 Comparison of target gene prediction of miR-15a (x±s)组别样本量SIRT1-3'-UTR-WT报告基因的荧光素酶活性比值SIRT1-3'-UTR-MUT报告基因的荧光素酶活性比值miR-15a对照组30.52±0.071.38±0.09miR-15a抑制剂组30.97±0.111.41±0.07t值5.9780.432P值0.0040.688 注:(独立样本t检验) miR:微小RNA;SIRT1:沉默信息调节蛋白1;UTR:非翻译区;WT:野生型;MUT:突变型 Note:(Independent samples t test) miR:microRNA;SIRT1:silent information regulator 1;UTR:untranslated region;WT:wild type;MUT:mutant type
2.12
不同转染组HLEB-3细胞SIRT1、FOXO3a和p53蛋白表达比较miR-15a对照组细胞内SIRT1蛋白条带相对灰度弱于miR-15a抑制剂组,FOXO3a和p53蛋白条带相对灰度值均强于miR-15a抑制剂组,各组间SIRT1、FOXO3a、p53蛋白相对表达量比较,差异均有统计学意义(t
=17.134、4.193、6.792,均P
<0.001)(表6,图10)。表6 各转染组细胞SIRT1、FOXO3a、p53蛋白相对表达量比较(x±s)Table 6 Comparison of relative expression levels of SIRT1,FOXO3a and p53 proteins between two transfection groups (x±s)组别样本量SIRT1蛋白FOXO3a蛋白p53蛋白miR-15a对照组30.31±0.060.62±0.080.83±0.15miR-15a抑制剂组30.74±0.110.31±0.100.21±0.05t值17.1344.1936.792P值<0.0010.0140.001 注:(独立样本t检验) SIRT1:沉默信息调节蛋白1;FOXO3a:叉头转录因子3a;miR:微小RNA Note:(Independent samples t test) SIRT1:silent information regulator 1;FOXO3a:forkhead transcription factor 3a;miR:microRNA
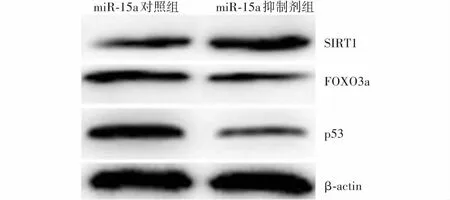
图10 各转染组细胞SIRT1、FOXO3a、p53蛋白表达电泳图 miR-15a对照组细胞内SIRT1蛋白条带强度较miR-15a抑制剂组弱,FOXO3a和p53蛋白条带强度较miR-15a抑制剂组强 miR:微小RNA;SIRT1:沉默信息调节蛋白1;FOXO3a:叉头转录因子3aFigure 10 Electrophoretogram of SIRT1,FOXO3a and p53 proteins in cells The SIRT1 protein band intensity was weaker,and the intensity of FOXO3a and p53 protein bands was stronger in miR-15a control group than miR-15a inhibitor group miR:microRNA;SIRT1:silent information regulator 1;FOXO3a:forkhead transcription factor 3a
3 讨论
近年来,miRNA在白内障发生和发展中的作用越来越受到关注。miR-15a是近年来广泛研究的miRNA,对视网膜病变和白内障的发生有调控作用。石佳等研究发现,miR-15a通过炎症反应和血管生成双重调节作用参与糖尿病视网膜病变的发生。Li等研究发现,hsa-miR-15a在正常LECs中的表达低于年龄相关性白内障患者LECs。Liu等研究发现,miR-15a能影响LECs的增生、凋亡和迁移能力。本研究也发现,miR-15a在DC患者晶状体前囊膜内的表达高于正常晶状体前囊膜,HLEB-3细胞内miR-15a表达量随着葡萄糖浓度的升高而增加,结合文献推测miR-15a可能参与了白内障的发病过程。
高糖环境诱导的LECs发生氧化应激反应是DC患者晶状体混浊的原因之一。LECs内产生大量ROS,同时抗氧化物酶失活,细胞内氧化代谢产物堆积导致细胞毒性损伤,造成细胞凋亡。本研究采用不同浓度的葡萄糖处理HLEB-3细胞,结果显示随着葡萄糖浓度增加,细胞凋亡率升高,同时ROS活性、MDA浓度增加,而SOD、CAT、GSH-Px活性下降。
miR-15a被证实在不同疾病的氧化应激过程中发挥作用。Kamalden等研究发现,miR-15a通过诱导氧化应激损伤加重糖尿病病情;Cao等研究证实,miR-15a可能对高氧诱导的肺氧化应激损伤有调节作用。本研究发现,miR-15a抑制剂组HLEB-3细胞的凋亡率明显低于miR-15a对照组,细胞ROS活性、MDA浓度明显低于miR-15a对照组,而SOD、CAT、GSH-Px的活性明显高于miR-15a对照组,以上结果提示,miR-15a可能是通过抑制HLEB-3细胞的抗氧化应激能力诱导细胞凋亡,继而加重DC患者的病情。
SIRT1能通过组蛋白脱乙酰化作用调节下游p53、FOXO等转录因子的活性,减轻内皮细胞线粒体损伤,减缓内皮细胞氧化应激损伤。Zeng等研究证实,SIRT1在DC小鼠LECs中表达下调;刘鹤楠等研究发现SIRT1在糖尿病大鼠视网膜中表达下调,且随着糖尿病病程延长,其表达量逐渐减少。FOXO3a是FOX家族成员,是SIRT1的非组蛋白底物,SIRT1可使FOXO3a去乙酰化,激活FOXO3a的转录活性并增加其下游靶标的表达,从而调节细胞增生、凋亡和抗氧化能力,最终保护细胞免受氧化应激损伤。有研究证实,高糖处理的LECs中FOXO3a蛋白表达量以剂量和时间依赖性方式升高,FOXO3a可以作为高血糖条件下人LECs氧化应激的生物标志物。p53是SIRT1另一个重要的下游底物,正常情况下,p53处于休眠状态,当细胞处于氧化应激损伤状态,p53被激活,刺激下游靶基因的转录,进而诱导细胞凋亡;而SIRT1能通过p53去乙酰化减少其介导的转录激活,从而抑制细胞凋亡。本研究也发现,随着氧化应激模型中SIRT1表达降低,FOXO3a和p53表达升高。为了进一步探讨miR-15a调控LECs氧化应激损伤的作用机制,本研究采用miRanda、TargetScan数据库筛选SIRT1下游靶向蛋白,发现SIRT1为miR-15a的一个潜在作用靶点;miR-15a抑制剂组HLEB-3细胞的SIRT1蛋白表达明显强于miR-15a对照组,FOXO3a和p53的表达明显弱于miR-15a对照组。以上结果说明在HLEB-3细胞中,miR-15a通过靶向抑制SIRT1的转录,继而上调其下游FOXO3a和p53的表达,导致HLEB-3细胞抗氧化能力的减弱。
综上所述,本研究结果表明miR-15a能抑制高糖诱导下LECs的抗氧化应激损伤能力,这种作用可能是通过抑制SIRT1表达,从而上调下游底物FOXO3a和p53活性,加重细胞凋亡而实现的。
利益冲突
所有作者均声明不存在利益冲突作者贡献声明
南安超:实验设计和实施、文章撰写;南建茹、刘亚东:采集和分析数据;刘向玲:文章校对及修改