基于体外分区囊袋模型的不同类型人工晶状体对晶状体上皮细胞迁移的抑制作用
2022-06-09廉飞玥李阳姜凌峰沈皓月赵江月严肖啸于佳明秦宇
廉飞玥 李阳 姜凌峰 沈皓月 赵江月 严肖啸 于佳明 秦宇
中国医科大学附属第四医院眼科 辽宁省晶状体学重点实验室,沈阳110005
后发性白内障(posterior capsular opacification,PCO)是白内障术后严重影响视觉质量的并发症之一,目前主要治疗方式为YAG激光和二次手术。随着患者对术后视觉质量要求的不断提高,激光或手术治疗带来的人工晶状体(intraocular lens,IOL)损伤或移位等并发症逐渐得到重视。已有研究表明,360°连续直角边缘IOL能有效抑制晶状体上皮细胞(lens epithelial cells,LECs)向后囊膜迁移,而不同360°连续直角边缘IOL的PCO发生率存在差异。目前,关于不同360°连续直角边缘IOL在PCO预防中作用的体外实验研究仍然较少,其中一部分原因可能在于囊袋模型构建的限制。早期囊袋模型是由动物眼球囊袋及人晶状体囊袋构建,除囊袋来源受限外,模型的稳定性也较差。近年来,使用细胞培养小室构建PCO体外囊袋模型的新方法出现,但该类模型尚无法准确模拟术后晶状体囊内IOL与前、后囊膜的位置关系,缺乏对囊袋不同部位LECs状态的反映,这些问题也是PCO预防研究的关键。本研究拟设计体外分区囊袋模型,为现有体外囊袋模型存在的问题提出可能的解决方案。同时,本研究拟使用体外分区囊袋模型比较目前常用的3种类型360°连续直角边缘IOL对LECs迁移的抑制作用,为IOL改良以预防PCO提供新的参考和依据。
1 材料与方法
1.1 材料
1.1.1
细胞来源 人LECs细胞系SRA01/04购于ATCC细胞库,经过细胞STR验证。1.1.2
IOL类型 使用3种一片式、光学部光滑无雕刻、后表面360°连续直角边缘设计的IOL:平台板式袢HydroSmart IOL、C型袢HydroSmart IOL和C型补偿袢Hydrophobic IOL,其中平台板式袢HydroSmart和C型袢HydroSmart光学设计为双等凸0°袢夹角,C型补偿袢Hydrophobic为后凸型。1.1.3
主要试剂及仪器 Transwell小室(REF3422,美国Corning公司);细胞爬片(WHB24CS、WHB48CS,上海卧宏生物科技有限公司);人源Ⅳ型胶原(C7521)、转化生长因子β(transforming growth factor-β,TGF-β)(GF113)、二甲基亚砜(dimethyl sulfoxide,DMSO)(CAS-67685)(美国Sigma公司);胎牛血清(fetal bovine serum,FBS)(FBSSA500-S,澳大利亚AusGeneX公司);DMEM高糖培养液(SH30021)、青-链霉素双抗(SV-30010)(美国HyClone公司);苏木素染液(MB9798-2)、伊红染液(MAO164)(大连美仑生物技术有限公司)。荧光照相显微镜、解剖显微镜(日本Olympus公司);凝胶成像及分析系统(美国Alpha Iromotech公司);低温超速离心机(美国Thermo公司);多功能酶标仪(德国Berthold公司)。1.2 方法
1.2.1
体外分区囊袋模型构建及细胞培养 将Ⅳ型胶原均匀涂布于小室迁移膜上底面中央5 mm直径范围。于37 ℃湿润环境中静置8~24 h,直至形成稳定的胶原膜;同样的方法制备8 mm和14 mm胶原膜细胞爬片,构建体外分区囊袋模型。体外分区囊袋模型可分为前囊膜区(小室下表面区)和后囊膜区(爬片区),后囊膜区又可分为后囊膜边缘区(14 mm爬片区)和后囊膜袢光学部移行区(8 mm爬片区)(图1)。将SRA01/04细胞培养于含体积分数10% FBS、100 U/ml(U为商品单位)青霉素和100 mg/ml链霉素的DMEM培养液中,于37 ℃、体积分数5% CO培养箱中常规培养,待细胞达75%融合时以质量分数0.25%胰蛋白酶消化细胞并传代。调整细胞密度约5×10/ml,均匀接种于Transwell小室上底面和细胞爬片的周围区域,培养6~8 h待细胞贴壁后,向小室中加入10 ng/ml的TGF-β,植入C型袢HydroSmart IOL作为模型组;并设置未植入IOL的Transwell小室作为对照组,细胞按同样密度均匀接种于小室上底面及下室对应爬片的周围区域。各组细胞分别于37 ℃、5% CO细胞培养箱中培养48 h,进行后续实验。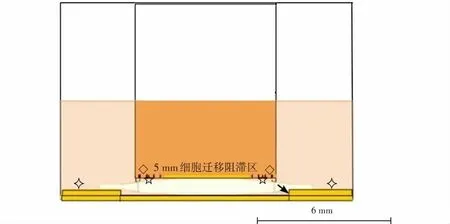
图1 体外分区囊袋模型示意图(标尺=6 mm) ◇:小室上底面晶状体上皮细胞培养区;☆:迁移至小室下表面的晶状体上皮细胞;⟡:细胞爬片周围区域;↑:8 mm及14 mm细胞爬片Figure 1 The diagrammatic sketch of in vitro capsular bag model (bar=6 mm) ◇:Lens epithelial cells on the upper surface of the chamber;☆:Lens epithelial cells that migrated to the lower surface of the chamber;⟡:Area around cell slides;↑:8 mm and 14 mm cell slides
1.2.2
倒置显微镜下观察体外分区囊袋模型早期PCO病理表现 体外培养细胞48 h,将体外分区囊袋模型Transwell小室、8 mm及14 mm细胞爬片拆分后各自放入含有DMEM培养液的24孔板中,倒置显微镜下观察各区细胞分布,并观察早期Sommering环和小型Elschning珍珠样小体等PCO特征性病理表现。1.2.3
苏木精-伊红染色观察体外分区囊袋模型细胞形态变化 体外培养细胞48 h,吸除Transwell小室培养孔细胞培养液及各爬片培养孔内细胞培养液,磷酸盐缓冲液(phosphate buffer solution,PBS)浸洗2次;取上室下表面及下室细胞爬片上的细胞,质量分数4%多聚甲醛固定20 min,PBS轻柔浸洗;苏木素染液浸染15~20 min,无菌水浸洗1次,伊红浸染3~5 min,无菌水浸洗去除杂色;光学显微镜下观察细胞纤维化状态并拍照。1.2.4
实验分组处理 根据IOL类型将实验分为平台板式袢HydroSmart组、C型袢HydroSmart组和C型补偿袢Hydrophobic组,将相应类型IOL分别植入体外分区囊袋模型中,同时设置不植入IOL的体外分区囊袋模型作为空白对照组。参照1.2.1方法进行细胞接种和培养。1.2.5
Transwell法检测IOL前囊膜区细胞迁移 各组细胞培养48 h,移除模型上室及下室细胞培养液,PBS浸洗30 s,于模型上室加入250 μl含5% FBS的新鲜培养液,下室加入500 μl含15% FBS的新鲜培养液,并置于37 ℃、5% CO细胞培养箱中继续培养10 h;吸除小室培养液,用棉签拭去上室上底面细胞,4%多聚甲醛固定后行苏木精-伊红染色。随机选取前囊膜区3个等距视野作为计数区域(图2A),倒置显微镜下拍照,采用ImageJ软件计数迁移细胞;每组设置5个平行对照,计数单位面积为500 μm×400 μm,每张照片重复计数3次,取各组细胞计数的平均值作为最终细胞计数结果。前囊膜细胞迁移抑制率=(空白对照组前囊膜区单位面积细胞数-IOL组前囊膜区计数区域单位面积细胞数)/空白对照组前囊膜区单位面积细胞数×100%。1.2.6
细胞排斥区分析法检测IOL后囊膜袢光学部移行区细胞迁移 各组细胞培养48 h,移除后囊膜区原细胞培养液、Transwell小室上室及IOL,PBS浸洗培养孔后加入不含血清的新鲜培养液,置于37 ℃、5% CO细胞培养箱中继续培养24 h;取各组模型体系后囊膜区8 mm细胞爬片于新的24孔板细胞培养孔中,PBS浸洗、4%多聚甲醛固定,行苏木精-伊红染色。选取后囊膜袢光学部移行区2个对称区域作为计数区域(图2B),倒置显微镜下拍照,采用ImageJ软件进行迁移细胞计数;每组设置5个平行对照,计数区域单位面积为1 500 μm×1 200 μm,每张照片重复计数3次,取平均值作为最终细胞计数结果。后囊膜细胞迁移抑制率=(空白对照组后囊膜袢光学部移行区单位面积细胞数-IOL组后囊膜袢光学部移行区单位面积细胞数)/空白对照组后囊膜袢光学部移行区单位面积细胞数×100%。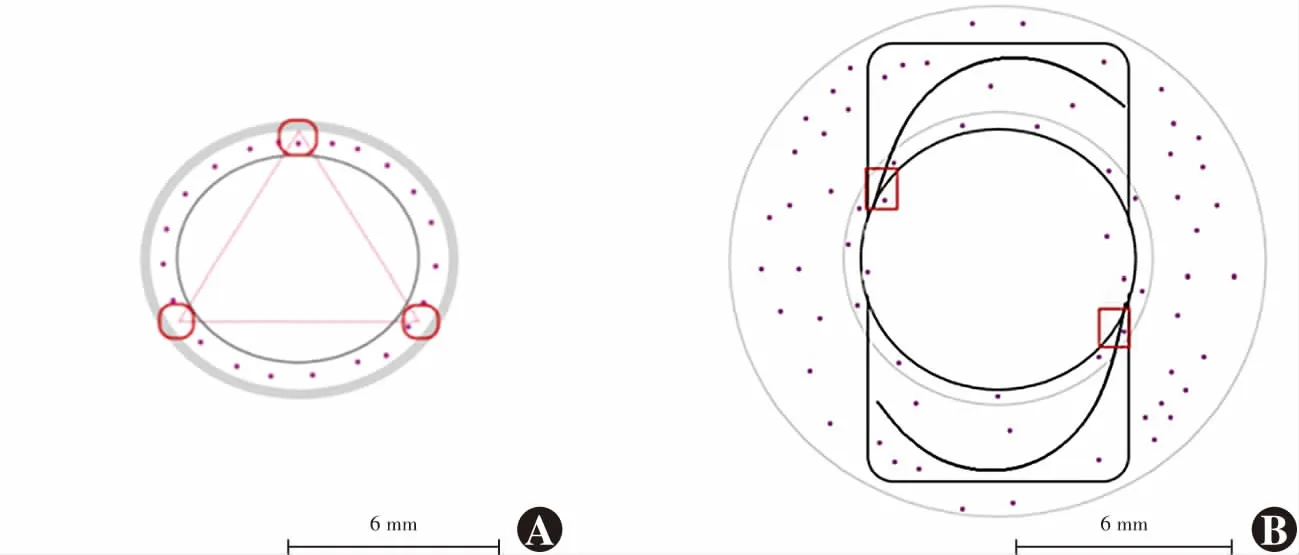
图2 体外分区囊袋模型计数区域示意图(标尺=6 mm) 红色标记框内为计数区域 A:前囊膜区计数区域 计数单位面积为500 μm×400 μm B:后囊膜袢光学部移行区计数区域 计数单位面积为1 500 μm×1 200 μmFigure 2 Cell counting areas in the in vitro capsular bag model (bar=6 mm) Areas within red boxes were cell counting areas A:Anterior capsule Cell counting area of 500 μm×400 μm B:Optical area of posterior capsule Cell counting area of 1 500 μm×1 200 μm
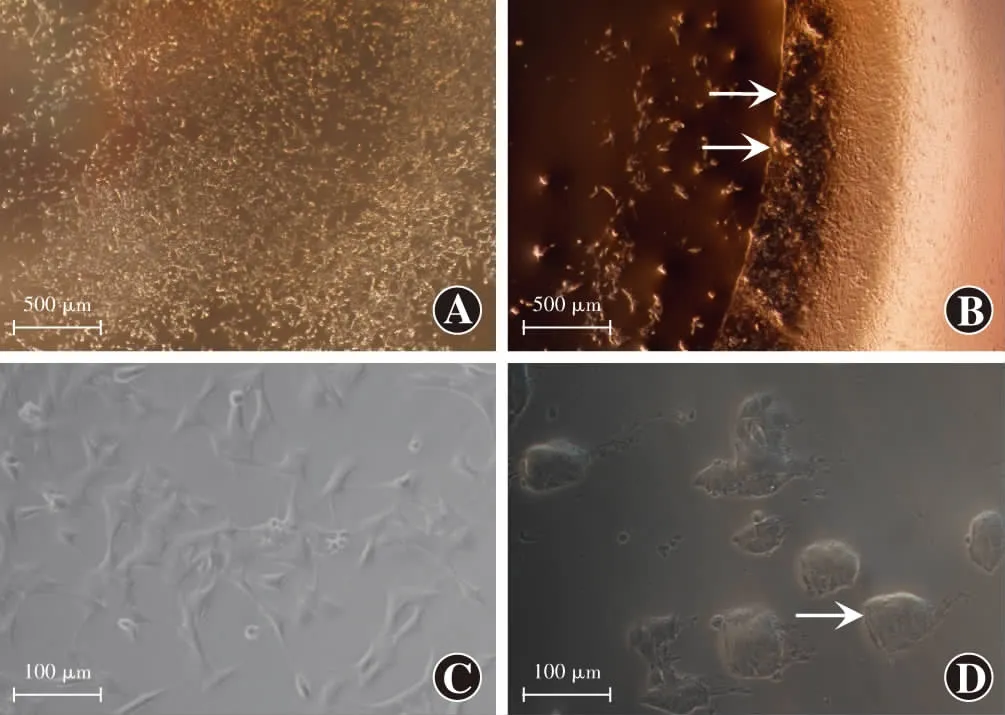
图3 模型组与对照组体外分区囊袋模型对比观察 A:对照组(标尺=500 μm) B:模型组(标尺=500 μm) 可见早期Soemmering环形态(箭头) C:对照组细胞形态高倍镜图(标尺=100 μm) D:模型组细胞形态高倍镜图(标尺=100 μm) 可见小型Elschnig珍珠样小体(箭头)Figure 3 Morphological observation of model group and control group A:Control group (bar=500 μm) B:Model group (bar=500μm) Soemmering ring (arrow) in the early phase was observed C:High magnification image of control group (bar=100 μm) D:High magnification image of model group (bar=100 μm) Small Elschnig pearls (arrow) were found
1.3 统计学方法
采用GraphPad Prism 8.0.2软件进行统计分析。本研究中定量资料经Skenwness-Kurtosis检验符合正态分布,以表示。各组细胞迁移抑制率总体差异比较采用单因素方差分析,组间两两比较采用LSD-t
检验。P
<0.05为差异有统计学意义。2 结果
2.1 体外分区囊袋模型验证
培养48 h后,倒置显微镜下观察可见模型组后囊膜区细胞主要分布于后囊膜边缘,迁移至IOL下方的细胞数目较少;后囊膜边缘区可见类似早期Soemmering环的形态,并可见由后囊膜边缘区向后囊膜中央迁入的不具有典型LECs结构、相对于人LECs体积较大的小型Elschnig珍珠样小体形态。对照组下室对应区域未见类似形态改变(图3)。
2.2 体外分区囊袋模型细胞形态改变
苏木精-伊红染色结果显示,模型组小室下表面前囊膜区可见细胞的细胞质红染,呈梭形、纺锤形,而对照组细胞呈三角形、长方形、椭圆形等;模型组后囊膜区可见迁移的细胞,细胞呈纤维状,胞质较少,对照组下室对应区域可见细胞的细胞质较丰富且形态多样(图4)。
2.3 各组前囊膜区迁移细胞数目及细胞迁移抑制率比较
平台板式袢HydroSmart组、C型袢Hydrosmart组、C型补偿袢Hydrophobic组和空白对照组前囊膜区迁移细胞数总体比较,差异有统计学意义(F
=1 287.00,P
<0.001),其中平台板式袢HydroSmart组、C型袢Hydrosmart组、C型补偿袢Hydrophobic组迁移至前囊膜区的细胞数目明显少于空白对照组,C型补偿袢Hydrophobic组迁移细胞数目明显多于平台板式袢HydroSmart组和C型袢Hydrosmart组,差异均有统计学意义(均P
<0.05)(图5,表1)。各IOL组前囊膜区细胞迁移抑制率总体比较差异有统计学意义(F
=11.12,P
<0.001),其中C型补偿袢Hydrophobic组迁移抑制率明显低于平台板式袢HydroSmart组和C型袢Hydrosmart组,差异均有统计学意义(均P
<0.01)(表2)。2.4 各组后囊膜袢光学部移行区迁移细胞数及细胞迁移抑制率比较
各组后囊膜袢光学部移行区细胞计数总体比较差异有统计学意义(F
=4 018.00,P
<0.001),其中平台板式袢HydroSmart组、补偿袢Hydrophobic组和C型袢Hydrosmart组迁移细胞计数依次增加,各组间比较差异均有统计学意义(均P
<0.001)(图5,表3)。各IOL组移行区细胞迁移抑制率总体比较差异有统计学意义(F
=87.04,P
<0.001),其中平台板式袢HydroSmart组、补偿袢Hydrophobic组和C型袢Hydrosmart组细胞迁移抑制率依次降低,组间差异均有统计学意义(均P
<0.001)(表4)。
图4 体外分区囊袋模型各分区细胞苏木精-伊红染色观察 A:模型组前囊膜区细胞(标尺=50 μm) 细胞质红染,呈梭形、纺锤形 B:对照组前囊膜区细胞(标尺=50 μm) 细胞呈三角形、长方形、椭圆形 C:模型组后囊膜区细胞(标尺=100 μm) 细胞呈纤维状,细胞质较少 D:对照组后囊膜区细胞(标尺=100 μm) 细胞质较丰富、形态多样Figure 4 Morphological observation of cells by hematoxylin and eosin staining in the in vitro capsular bag model A:Cells in the anterior capsule of model group (bar=50 μm) Cytoplasm showed red staining,fusiform and spindle-shaped B:Cells in the anterior capsule of control group (bar=50 μm) Cells were triangular,rectangular,and oval C:Cells in the posterior capsule of model group (bar=100 μm) Cells were fibrous with little cytoplasm D:Cells in the posterior capsule of control group (bar=100 μm) Cells were with abundant cytoplasm and had diverse shapes
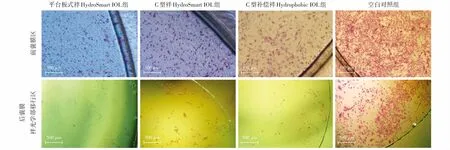
图5 各组体外分区囊袋模型前、后囊膜计数区域细胞苏木精-伊红染色(前囊膜区:标尺=100 μm;后囊膜袢光学部移行区:标尺=500 μm)Figure 5 Hematoxylin and eosin staining of cells in cell counting areas of the anterior capsule and posterior capsule (Anterior capsule:bar=100 μm;Optical area of the posterior capsule:bar=500 μm)
表1 各组体外分区囊袋模型前囊膜区迁移细胞数比较(x±s)Table 1 Comparison of the number of migrating cells in the anterior capsule among different groups (x±s)组别样本量迁移细胞数目空白对照组15236.70±40.02C型补偿袢Hydrophobic组1534.47±10.80aC型袢HydroSmart组1524.67±9.80ab平台板式袢HydroSmart组1518.80±5.53abF值1 287.00P值<0.001 注:与空白对照组比较,aP<0.001;与C型补偿袢Hydrophobic组比较,bP<0.05(单因素方差分析,LSD-t检验) Note:Compared with blank control group,aP<0.001;compared with C-compensation-loop Hydrophobic group,bP<0.05 (One-way ANO-VA,LSD-t test)
表2 各IOL组体外分区囊袋模型前囊膜区细胞迁移抑制率比较(x±s,% )Table 2 Comparison of cell migration inhibition rate in the anterior capsule among different groups (x±s,% )组别样本量细胞迁移抑制率C型补偿袢Hydrophobic组1586.27±4.54C型袢HydroSmart组1589.76±3.10a平台板式袢HydroSmart组1592.02±1.94aF值11.12P值<0.001 注:与C型补偿袢Hydrophobic组比较,aP<0.01(单因素方差分析,LSD-t检验) IOL:人工晶状体 Note:Compared with C-compensation-loop Hydrophobic group,aP<0.01(One-way ANOVA,LSD-t test) IOL:intraocular lens
表3 各组体外分区囊袋模型后囊膜袢光学部移行区迁移细胞数比较(x±s)Table 3 Comparison of the number of migrating cells in the optical area of the posterior capsule among different groups (x±s)组别样本量迁移细胞数目空白对照组10568.60±82.53C型补偿袢Hydrophobic组10121.30±12.01aC型袢HydroSmart组10162.20±16.38ab平台板式袢HydroSmart组1056.43±9.00abcF值4 018.00P值<0.001 注:与空白对照组比较,aP<0.001;与C型补偿袢Hydrophobic组比较,bP<0.001;与C型袢HydroSmart组比较,cP<0.001(单因素方差分析,LSD-t检验) Note:Compared with blank control group,aP<0.001;compared with C-compensation-loop Hydrophobic group,bP<0.001;compared with C-loop HydroSmart group, cP<0.001(One-way ANOVA,LSD-t test)
表4 各IOL组体外分区囊袋模型后囊膜袢光学部移行区细胞迁移抑制率比较(x±s,%)Table 4 Comparison of cell migration inhibition rate in the optical area of the posterior capsule among different groups (x±s,%)组别样本量细胞迁移抑制率C型补偿袢Hydrophobic组1078.43±3.48C型袢HydroSmart组1070.14±5.35a平台板式袢HydroSmart组1091.60±3.65abF值87.04P值<0.001 注:与C型补偿袢Hydrophobic组比较,aP<0.001;与C型袢Hydr-oSmart组比较,bP<0.001(单因素方差分析,LSD-t检验) IOL:人工晶状体 Note:Compared with C-compensation-loop Hydrophobic group,aP<0.001;compared with C-loop HydroSmart group, bP<0.001(One-way ANOVA,LSD-t test) IOL:intraocular lens
3 讨论
PCO是白内障手术IOL植入后重要的并发症之一,其特征性改变为形成Elschnig珍珠样小体和Soemmering环。LECs绕过前囊膜边缘或由晶状体囊赤道部向后囊膜光学部中心区域迁移是PCO的早期改变,发生这一变化的主要原因是术后血-房水屏障破坏,大量细胞因子和炎性因子涌入前房和晶状体囊内,导致LECs异常迁移。目前常见的生物囊袋模型和细胞孔室模型稳定性较差,且无法反映前后囊膜与IOL间的位置关系,关于PCO体外囊袋模型的构建与评估目前尚未形成统一的标准。体外分区囊袋模型利用Ⅳ型胶原形成的胶原膜构建一个48 h内相对稳定的囊内微环境,从而更好地模拟人LECs、晶状体囊膜及IOL间的相互作用,实现了对晶状体囊不同部位的分区模拟,有助于更精准、高效地探讨不同设计特点的新型IOL对PCO的预防和治疗作用,为IOL预防PCO的相关研究提供了一种新方法。尽管如此,体外分区囊袋模型依然有很大的局限性,例如该模型尚无法模拟术后液体环境中细胞因子等的动态变化,下一步可以在模型中增加一个梯度缓释系统。另外,体外分区囊袋模型目前只能用于评估PCO早期细胞的迁移,尚无法体现更长期的病理改变,如囊膜皱缩等,未来可以通过选择更多新型材料,如玻璃胶原膜等来代替现有模型中的胶原膜,既保持了体外分区囊袋模型的稳定性,也更好地模拟了晶状体囊,从而实现长期的研究观察。
目前关于IOL改良预防PCO的研究主要可以分为材质、形状设计及药物浸润,本研究主要讨论IOL的材质与形状设计,根据材质分为HydroSmart型和Hydrophobic型,根据IOL袢的设计特点分为平台板式袢和C型袢,根据袢光学部移行区设计特点分为双等凸球面和补偿袢。有临床研究结果显示,Hydrophobic型IOL能有效预防PCO的发生。近年来,一些新型材质IOL也被证明能有效预防PCO的发生。而对近几年出现的HydroSmart型IOL预防PCO作用的研究仍较少。本研究结果表明,平台板式袢HydroSmart型IOL在LECs迁移抑制中的作用优于C型袢HydroSmart型IOL及C型补偿袢Hydrophobic型IOL。本研究在体外分区囊袋模型中观察到HydroSmart型IOL在细胞培养过程中有一定程度的体积增大,这可能钝化了IOL后表面的直角边缘,但使其与囊膜的贴合度更好,这可能是导致细胞迁移抑制率较其他材质IOL高的原因。同时,本研究发现平台板式袢IOL和C型补偿袢IOL相对于C型袢IOL对人LECs向后囊膜中央区迁移有更强的抑制作用。近年研究表明圆盘中空袢IOL、后表面雕刻IOL及可调节折叠IOL能有效预防PCO;但也有研究结果显示不同IOL袢的数目和形状对PCO的预防作用差异无统计学意义。结合本研究结果,我们有理由认为增加IOL袢边缘与晶状体囊袋的接触面积、减少IOL袢光学部移行区与袢边缘区的连接以及增加IOL与囊袋接触的摩擦力可能会增强IOL对PCO的抑制作用,这也为将来更多新型IOL的设计提供了方向。
综上,本研究成功建立一种体外分区囊袋模型,并且通过体外实验结果证实,与C型袢HydroSmart IOL、C型补偿袢Hydrophobic IOL相比,平台板式袢HydroSmart IOL更有利于抑制LECs向前后囊膜的迁移。本研究结果仍需进一步结合临床研究进行验证和完善。
利益冲突
本研究曾受到蔡司、高视远望和眼力健公司的资助,所有作者均声明不存在其他利益冲突作者贡献声明
廉飞玥:实施研究、论文撰写;李阳:实施研究;姜凌峰、沈皓月、严肖啸:数据整理、统计分析;赵江月、于佳明:论文修改;秦宇:酝酿和设计实验、研究指导、论文修改及定稿