对草地贪夜蛾有嗅觉生理活性的玉米和水稻挥发物组分
2022-06-07陈萍刘丹丹修小鉴于晶侯茂林
陈萍 刘丹丹 修小鉴 于晶 侯茂林



摘要 入侵我国的草地贪夜蛾Spodoptera frugiperda (J. E. Smith)严重为害玉米但极少为害水稻。本研究旨在明确对草地贪夜蛾有嗅觉生理活性的玉米和水稻挥发物组分。笼罩试验表明,草地贪夜蛾偏好在玉米上产卵,触角切除后在玉米上的产卵量下降。采用动态顶空吸附法收集玉米和水稻挥发物,利用气相色谱-触角电位联用仪(GC-EAD)和气相色谱-质谱联用仪(GC-MS)定性确定挥发物中活性组分,发现玉米和水稻挥发物中分别有12种和10种能引起草地贪夜蛾嗅觉反应的活性组分,分属于绿叶气味、萜类物质、脂肪族化合物、芳香族化合物。其中,8种组分为玉米和水稻共有,4种玉米特有,2种水稻特有。采用触角电位仪测定草地贪夜蛾对不同浓度挥发物组分的触角电位反应(EAG),发现EAG反应随浓度(0.1~100 μg/μL)增大而增强,但对某些组分的EAG反应在一定浓度后趋于稳定。癸醛、壬醛、反-2-己烯醛、反-2-己烯醇能引起草地贪夜蛾强烈的EAG反应。综上所述,玉米和水稻挥发物中对草地贪夜蛾有嗅觉生理活性的组分存在差异,这为进一步明确草地贪夜蛾对玉米和水稻的产卵选择行为奠定基础。
关键词 草地贪夜蛾;植物挥发物;触角;触角电位;GC-EAD
中图分类号: S433.4
文献标识码: A
DOI: 10.16688/j.zwbh.2021133
Abstract The fall armyworm (FAW), Spodoptera frugiperda, invaded China in 2019, severely damaging corn while rarely occurring on rice. This study aimed to determine corn and rice volatile components that elicit olfactory responses in FAW. Cage tests showed that, FAW preferred corn over rice for oviposition, and the egg production reduced when the antennae were excised. Active components were separated and identified by gas chromatography-electroantennographic detection (GC-EAD) and gas chromatography-mass spectrometry (GC-MS) from the volatiles of corn and rice collected by dynamic headspace adsorption. There were 12 and 10 olfaction-active components in corn and rice volatiles, respectively, which belonged to green leaf volatiles, terpenoids, aliphatic, or aromatic compounds. Among the active components, eight components were shared in corn and rice, four and two components were specific to corn and rice, respectively. The electroantennogram (EAG) responses of FAW to most active volatile components increased with increasing concentrations from 0.1 to 100 μg/μL but were saturated at certain concentrations in some components. Decanal, nonanal, (E)-2-hexenal and (E)-2-hexen-1-ol induced the strongest EAG responses. In conclusion, the active volatile components that could elicit olfactory responses in FAW differed between corn and rice. These results provide a foundation for further clarification of the oviposition preference behavior of FAW.
Key words Spodoptera frugiperda;plant volatiles;antenna;EAG;GC-EAD
草地貪夜蛾Spodoptera frugiperda (J. E. Smith)自2019年1月入侵我国后迅速蔓延,其迁飞远、为害重、食性广、难防治的特点极大地威胁着我国农业生产安全[1]。根据寄主适应性及为害范围,草地贪夜蛾分为玉米品系和水稻品系[2-3]。入侵我国的草地贪夜蛾为玉米品系[4],其严重为害玉米但极少为害水稻,这种为害特点与其对玉米和水稻的寄主选择性有关[5-6]。
植食性昆虫主要通过嗅觉来识别和选择寄主植物。植物挥发性有机化合物(volatile organic compounds,VOCs)在其中发挥重要作用[7-8]。草地贪夜蛾是多食性害虫,可为害多种禾本科、豆科、菊科植物,如玉米、甘蔗、水稻、棉花、大豆、花生等[9]。触角电位技术(electroantennogram,EAG)和气相色谱-触角电位联用技术(gas chromatography-electroantennographic detection,GC-EAD)的广泛应用促进了植食性昆虫寄主选择的化学生态学机制的研究[10]。针对草地贪夜蛾的寄主植物选择性及其机制,研究者已经开展了较多工作。在未受害玉米和虫害玉米的挥发物之间,草地贪夜蛾幼虫偏好虫害玉米挥发物,玉米挥发物芳樟醇对草地贪夜蛾6龄幼虫具有引诱性[11];与幼虫相反,草地贪夜蛾交配雌蛾则偏好未受害玉米挥发物[12]。草地贪夜蛾雄蛾对寄主植物挥发物的触角电位反应比雌蛾更强烈[13],乙酸叶醇酯、β-芳樟醇、吲哚等能引起交配雌蛾的嗅觉反应[14],雄蛾对1-己醇、己醛、顺-3-己烯醇等反应强烈[15]。但是,草地贪夜蛾对玉米和水稻挥发物的嗅觉反应缺乏比较分析。
本研究在测定草地贪夜蛾对玉米和水稻产卵选择的基础上,利用GC-EAD、GC-MS鉴定玉米和水稻挥发物中能引起草地贪夜蛾嗅觉反应的活性组分,并测定EAG反应值与活性组分标准品浓度之间的关系,为进一步阐明草地贪夜蛾对玉米和水稻产卵选择行为与挥发物之间的关系奠定基础。
1 材料与方法
1.1 供试草地贪夜蛾与植物
草地贪夜蛾于2019年9月采自云南德宏玉米田。在温度(27±5)℃、相对湿度(75±5)%、光周期L∥D=16 h∥8 h条件下,草地贪夜蛾1、2龄幼虫饲以玉米苗、3龄后采用人工饲料[16]单头饲养直至化蛹。同日羽化的雌、雄蛾配对接入养虫盒(直径11.5 cm, 高6 cm)中,用蘸有10%蜂蜜水的脱脂棉块补充营养。选取配对3 d后飞行活跃且触角完整的雌蛾进行产卵选择、GC-EAD和EAG试验。
试验所用水稻品种为‘TN1’(中国水稻研究所提供,农业农村部桂林作物有害生物科学观测试验站扩繁)、玉米品种为‘玉米王602’(市售,广西荃鸿种业发展有限公司生产)。水稻苗20日龄时移栽至塑料圆桶(口径19 cm,底径13 cm,高17 cm)中,每桶4穴,每穴3株;玉米播种于同规格塑料圆桶中,每桶4穴,每穴3粒。水稻苗移栽后15 d(15 DAT)左右、玉米苗长至12日龄以后用于挥发物收集和产卵选择试验。
1.2 草地贪夜蛾的产卵选择
产卵选择试验在通风良好的实验室内进行。选取玉米和水稻各一桶,各保留10株长势均匀的玉米苗和稻苗,分别放置在80目笼罩(50 cm×50 cm×50 cm)对角线的两角,在笼罩中央悬挂浸渍10%蜂蜜水的脱脂棉球,18:00每笼罩接入触角完整或齐基部切除触角的10头已配对雌蛾。48 h后移除雌蛾,计数玉米和水稻植株上的卵粒数。每笼罩为1次重复,每个触角处理重复4次。
1.3 玉米和水稻挥发物收集及其样品制备
采用动态顶空吸附法收集玉米和水稻挥发物。玉米苗和水稻苗洗净根部,每6株玉米苗或每10株水稻苗放入盛有蒸馏水的锥形瓶中,瓶口用封口膜扎紧后放入集气缸(高60 cm,直径20 cm)内。挥发物收集装置用乳胶软管连接成回路:大气采样仪(QC-1B,北京劳动保护研究所)出气口→活性炭→变色硅胶→流量计(300 mL/min)→集气缸→吸附柱→大气采样仪进气口。吸附柱(长7 cm,口径0.9 cm)内填充100 mg PorapakTMQ吸附剂(80~100目,Waters公司,美国),在200℃下活化30 min后使用。
挥发物收集装置预抽气1.5 h除杂后于20:00开始采集挥发物,共采集12 h。采样结束后用1 mL正己烷洗脱吸附剂,并用旋转蒸发仪将洗脱液浓缩至500 μL备用。
1.4 草地贪夜蛾的嗅觉反应及活性组分的筛选和鉴定
采用GC-EAD测定草地贪夜蛾对植物挥发物的嗅觉反应。GC-EAD采用Agilent 7890 B气相色谱仪,色谱柱为Agilent DB-5MS(长30 m,内径0.25 mm,膜厚0.25 μm)。柱箱升温程序为:起始温度40℃保留5 min;以8℃/min上升至200℃,保留2 min;以6℃/min升温至260℃,保持2 min。进样口温度为260℃,检测器温度为300℃。触角电位仪(Syntech公司,荷兰)由IDAC 4数据采集控制器、CS-55刺激气流控制器、TC-02控温装置、显微操作台、单端电极、金属笼罩等组成。
离体触角和玻璃电极的制备。沿基部切下草地贪夜蛾雌蛾触角并切除末端1 mm。将两根玻璃毛细管(长10 cm,外径1.2 mm,内径0.9 mm,Sutter公司,美国)尖端口径调节至与触角粗细相当,灌装0.1 mol/L KCl溶液制得玻璃电极。触角电位仪的Ag-AgCl金属丝分别插入两根玻璃电极内,将离体触角端部和基部分别滑入玻璃电极,并使触角处于正对气流出口1 cm处。
GC-EAD测试。EAD基线稳定后进样1 μL挥发物洗脱液,开始进行信号记录。触角电位信号被信号采集放大器放大,经转换器转换后用GcEad 2014 v 1.2.5软件进行数据分析。每次测试1根触角,玉米和水稻挥发物各重复5次。
挥发物组分分析。采用GCMS-QP2010 Plus(岛津公司,日本)对玉米和水稻挥发物洗脱液进行分析。色谱柱和升温程序同GC-EAD。MS条件:溶剂延迟4 min,EI离子源,电子能量70 eV,离子源温度230℃,接口温度250℃,扫描范围50~550 amu。每次不分流进样1 μL洗脱液,经GCMS solution v 2 软件进行数据采集与再解析。比对GC-EAD和GC-MS图像,通过谱库NIST 14.0对引起草地贪夜蛾触角电位反应的挥发物组分初步鉴定,并根据化合物标准品谱图进一步定性。
1.5 草地贪夜蛾对挥发物活性组分标准品的EAG反应
以正己烷为溶剂,将筛选出的玉米和水稻挥发物活性组分标准品(表1)配制成0.1、1、10、50、100 μg/μL浓度梯度的供试溶液。吸取10 μL溶液均匀滴在滤纸(长5 cm,宽0.5 cm)上,滤纸放入巴斯德管内(口径0.7 cm,长22 cm)并接至EAG气流系统(持续气流量为1 L/min)。每次测试刺激触角0.5 s,每两次刺激间隔30 s以上,标准品溶液按浓度由低到高进行测试。测试标准品溶液前后均用10 μL正己烷刺激触角做空白对照。各标准品溶液每次测试1根触角,重復6根触角。利用Syntech公司提供的EAGPro 2.0软件进行数据记录与分析,触角电位相对反应值计算公式如下:
EAG相对反应值=样品反应值-对照反应值对照反应值。
1.6 数据分析
所有数据均采用Excel 2016和SPSS 23.0软件进行分析。利用Mann-Whitney U检验分析草地贪夜蛾在玉米和水稻上产卵量的差异显著性;采用单因素方差分析(One-way ANOVA)检验植物挥发物标准品浓度对草地贪夜蛾雌蛾EAG反应影响的显著性,采用Tukey multiple range test检测标准品不同浓度梯度间EAG反应的差异显著性。
2 结果与分析
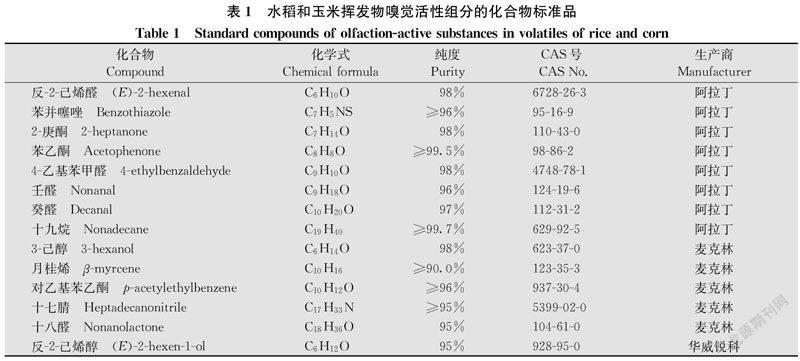
2.1 草地贪夜蛾雌蛾的产卵选择
在有选择条件下的笼罩试验中,触角完整的草地贪夜蛾雌蛾显著偏好在玉米上产卵(Z=-2.309,P=0.021)(图1a);触角切除后,草地贪夜蛾仍偏好在玉米上产卵(Z=-2.021,P=0.043)(图1b)。但是,与触角完整的雌蛾相比,触角被切除的雌蛾在玉米上的产卵量显著减少(Z=-2.309,P=0.021)(图1c)、而在水稻上的產卵量不存在显著差异(Z=-1.732,P= 0.083)(图1d)。
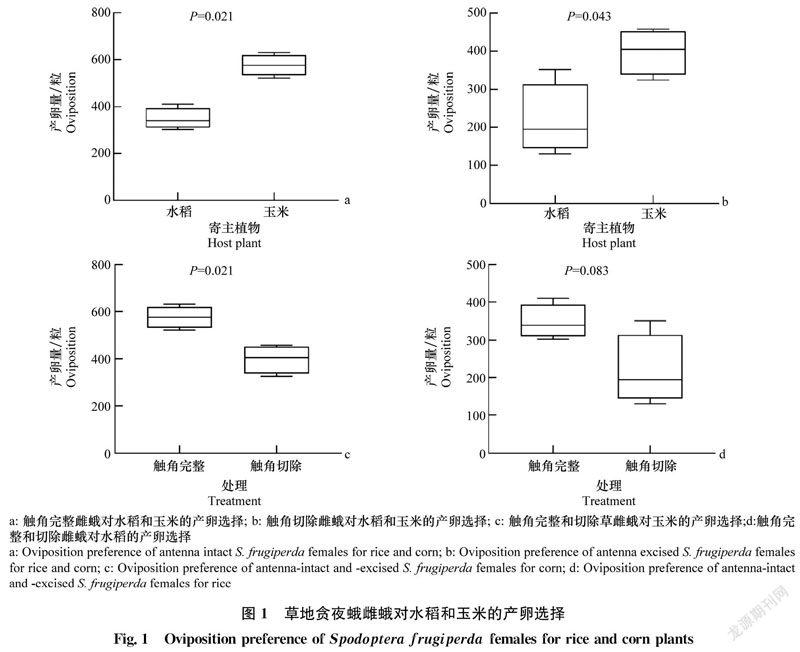
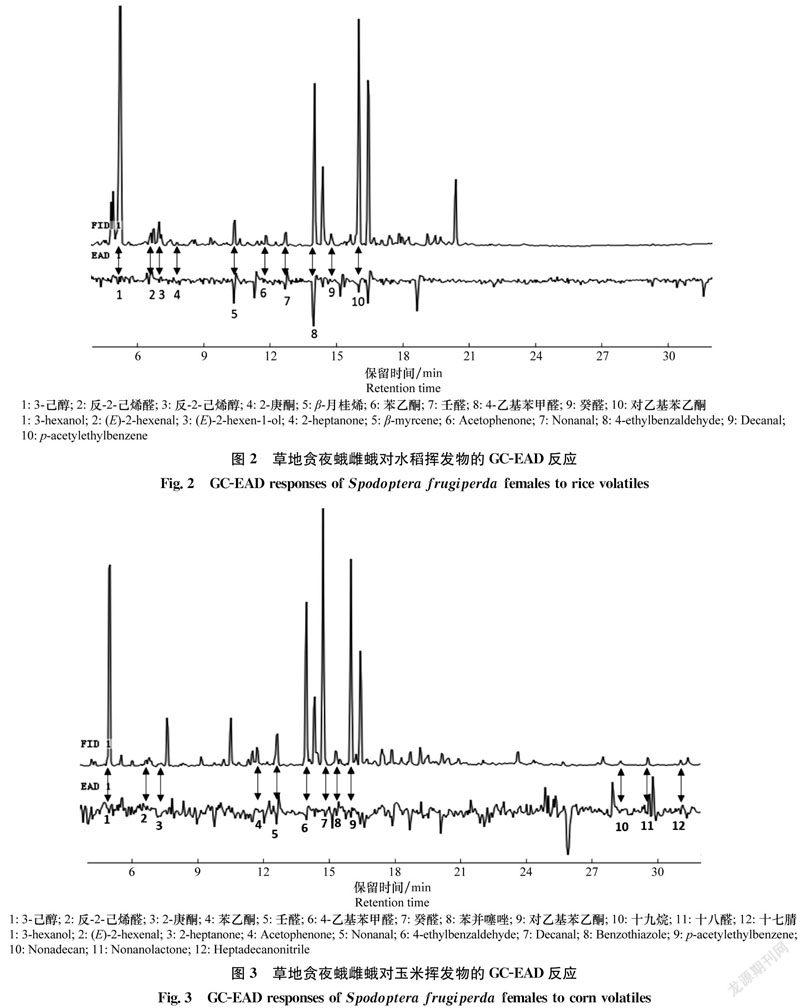
2.2 草地贪夜蛾雌蛾对水稻和玉米挥发物的GC-EAD反应
草地贪夜蛾雌蛾对水稻和玉米挥发物的GC-EAD反应分别如图2和图3所示。水稻和玉米挥发物中能引起草地贪夜蛾GC-EAD反应的活性组分分别有10和12种。
水稻和玉米挥发物活性组分可分为绿叶气味、萜类物质、脂肪族化合物(醇类、醛类、酮类、腈类、烃类)、芳香族化合物4类。其中绿叶气味化合物包括3-己醇、反-2-己烯醛和反-2-己烯醇,萜类物质为β-月桂烯,脂肪族化合物包括壬醛、癸醛、2-庚酮、十八醛、十七腈、十九烷,芳香族化合物包括苯乙酮、4-乙基苯甲醛、苯并噻唑和对乙基苯乙酮。
水稻和玉米共有的挥发物活性组分有8种,包括3-己醇、反-2-己烯醛、2-庚酮、苯乙酮、壬醛、4-乙基苯甲醛、癸醛、对乙基苯乙酮;水稻挥发物的特有活性组分为反-2-己烯醇和β-月桂烯;玉米挥发物的特有活性组分为苯并噻唑、十九烷、十八醛、十七腈。
2.3 草地贪夜蛾雌蛾对挥发物活性组分标准品的EAG反应
利用玉米和水稻挥发物筛选鉴定出的14种能引起草地贪夜蛾嗅觉反应的活性物质标准品(表1)进行EAG反应测定,发现EAG反应与标准品浓度之间呈“S”形关系曲线(图4~6)。在0~50 μg/μL浓度范围内,草地贪夜蛾对各活性组分的EAG响应值不断上升;在> 50 μg/μL浓度时,草地贪夜蛾对大部分活性组分的EAG响应值不再显著增大(3-己醇、反-2-己烯醛、2-庚酮除外),甚至下降。
草地贪夜蛾对玉米和水稻共有挥发物活性组分的EAG响应峰值普遍较高(图4),从大到小依次为癸醛2.76 mV(100 μg/μL)>壬醛2.02 mV(50 μg/μL)>反-2-己烯醛1.69 mV(100 μg/μL)> 4-乙基苯甲醛1.33 mV(50 μg/μL)> 2-庚酮1.27 mV(100 μg/μL)>3-己醇0.91 mV(100 μg/μL)> 对乙基苯乙酮0.85 mV(100 μg/μL)>苯乙酮0.71 mV(50 μg/μL)。草地贪夜蛾对玉米特有挥发物活性组分(图5)苯并噻唑、十九烷、十八醛、十七腈的EAG响应峰值均小于1.0 mV,对水稻特有挥发物活性组分(图6)的EAG响应峰值分别为反-2-己烯醇1.58 mV(50 μg/μL)、β-月桂烯0.71 mV(100 μg/μL)。
在0.1~100 μg/μL浓度梯度内,绿叶气味化合物中反-2-己烯醛(图4)的EAG响应峰值最大,脂肪族化合物中癸醛(图4)的EAG响应峰值最大;芳香族化合物中4-乙基苯甲醛(图4)的EAG响应峰值最大。
3 讨论
本研究表明,触角完整的草地贪夜蛾偏好在玉米上产卵,这与入侵我国的草地贪夜蛾严重为害玉米而较少在水稻上为害的现象一致。巴吐西等发现草地贪夜蛾对玉米的产卵偏好同样强于小麦[17],说明草地贪夜蛾对玉米选择性较强。触角是昆虫重要的嗅觉器官,除此之外昆虫的下颚须、下唇须及翅、足、生殖器上也分布有嗅觉感器[18]。本试验发现触角切除雌蛾在玉米上的产卵量比触角完整雌蛾的产卵量少,表明触角缺失引起了草地贪夜蛾利用气味定位寄主的能力下降;另外,切除触角的人为创伤也会对试虫造成一定的影响。而对于触角完整雌蛾,寄主植物挥发物可激发怀卵雌蛾的趋性飞行和着落行为,进而增加产卵几率[19]。
本研究定性确定了玉米和水稻挥发物中对草地贪夜蛾雌蛾具有嗅觉生理活性的共有组分。其中,反-2-己烯醛、2-庚酮、壬醛、癸醛、反-2-己烯醇等也是玉米和水稻吸引亚洲玉米螟Ostrinia furnacalis[20]和稻纵卷叶螟Cnaphalocrocis medinalis [21]的活性组分。本试验中,草地贪夜蛾雌蛾对癸醛和壬醛EAG反应强烈,其他鳞翅目昆虫中也观察到类似现象。壬醛能引起马铃薯块茎蛾Phthorimaea operculella已交配雌蛾强烈的EAG反应[22];壬醛和癸醛同样引起已交配亚洲玉米螟雌蛾明显的EAG 反应[20]。由此推测,壬醛和癸醛可能与草地贪夜蛾产卵选择有关。
本研究在玉米和水稻挥发物中检测到各自对草地贪夜蛾雌蛾有嗅觉活性的特有组分。玉米中存在的特有活性组分苯并噻唑能引诱橘小实蝇Bactrocera dorsalis雌虫产卵[23]。水稻中的特有活性组分月桂烯对兴安落叶松鞘蛾Coleophora obducta有驱避作用[24];另一种组分反-2-己烯醇对褐飞虱Nilaparvata lugens有驱避效应[25],与1-己醇和顺-3-己烯醇的混合物对云杉八齿小蠹Ips typographus有显著的驱避效果[26],与反-2-己烯醛和矿物油的混配物能有效驱避暗梗天牛Arhopalus tristis并抑制其产卵[27]。这些特有组分对草地贪夜蛾的行为效应需要进一步验证。另外,单一挥发物组分引起的植食性昆虫的行为反应往往与植物挥发物整体所引起的行为反应有差异[28],需要考察活性组分之间的协同作用。
草地贪夜蛾雌蛾的EAG反应与活性组分的浓度有关,但对某些活性组分的EAG反应存在饱和值。钟永志等发现草地贪夜蛾雌蛾对10 μg/μL氧化芳樟醇EAG响应值低于1 μg/μL氧化芳樟醇[29],Carroll等发现草地贪夜蛾幼虫更偏好高浓度芳樟醇[11]。说明草地贪夜蛾对植物挥发物的感受性和选择性存在剂量相关性。
本研究确定了能引起草地贪夜蛾雌蛾嗅觉反应的玉米与水稻挥发物活性组分,并明确了草地贪夜蛾对这些组分EAG反应的浓度梯度关系,但是草地贪夜蛾的寄主选择应是基于对寄主化学指纹图谱的感知,本文结果为深入研究混合组分的EAG反应及其对草地贪夜蛾寄主选择行为的调控作用奠定基础。
参考文献
[1] 郭井菲, 何康来, 王振营. 草地贪夜蛾的生物学特性、发展趋势及防控对策[J]. 应用昆虫学报, 2019, 56(3): 361-369.
[2] PASHLEY D P, JOHNSON S J, SPARKS A N. Genetic population structure of migratory moths: the fall armyworm (Lepidoptera: Noctuidae) [J]. Annals of the Entomological Society of America, 1985, 78(6): 756-762.
[3] PASHLEY D P. Host-associated genetic differentiation in fall armyworm (Lepidoptera: Noctuidae): a sibling species complex? [J]. Annals of the Entomological Society of America, 1986, 79(6): 898-904.
[4] 张磊, 靳明辉, 张丹丹, 等. 入侵云南草地贪夜蛾的分子鉴定[J]. 植物保护, 2019, 45(2): 19-24.
[5] 邱良妙, 刘其全, 杨秀娟, 等. 草地贪夜蛾对水稻和玉米的取食和产卵选择性与适合度[J]. 昆虫学报, 2020, 63(5): 604-612.
[6] 吴孔明. 中国草地贪夜蛾的防控策略[J]. 植物保护, 2020, 46(2): 1-5.
[7] 杜家纬. 植物-昆虫间的化学通讯及其行为控制[J]. 植物生理学报, 2001, 27(3): 193-200.
[8] 戴建青, 韩诗畴, 杜家纬. 植物挥发性信息化学物质在昆虫寄主选择行为中的作用[J]. 环境昆虫学报, 2010, 32(3): 407-414.
[9] MONTEZANO D G, SPECHT A, SOSA-GMEZ D R, et al. Host plants of Spodoptera frugiperda (Lepidoptera: Noctuidae) in the Americas [J]. African Entomology, 2018, 26(2): 286-301.
[10]孔祥波, 王睿, 高偉, 等. 气相色谱与触角电位检测器联用技术及其应用[J]. 昆虫知识, 2001, 38(4): 304-309.
[11]CARROLL M J, SCHMELZ E A, MEAGHER R L, et al. Attraction of Spodoptera frugiperda larvae to volatiles from herbivore-damaged maize seedlings [J]. Journal of Chemical Ecology, 2006, 32(9): 1911-1924.
[12]SIGNORETTI A G C, PEAFLOR M F G V, BENTO J M S. Fall armyworm, Spodoptera frugiperda (J. E. Smith) (Lepidoptera: Noctuidae), female moths respond to herbivore-induced corn volatiles [J]. Neotropical Entomology, 2012. 41(1): 22-26.
[13]MALO E A, CASTREJONGOMEZ V R, CRUZLOPEZ L, et al. Antennal sensilla and electrophysiological response of male and female Spodoptera frugiperda (Lepidoptera: Noctuidae) to conspecific sex pheromone and plant odors [J]. Annals of the Entomological Society of America, 2004, 97(6):1273-1284.
[14]PINTO-ZEVALLOS D M, STRAPASSON P, ZARBIN P H G. Herbivore-induced volatile organic compounds emitted by maize: electrophysiological responses in Spodoptera frugiperda females [J]. Phytochemistry Letters, 2016, 16: 70-74.
[15]MALO E A, MEDINA-HERNANDEZ N, VIRGEN A, et al. Electroantennogram and field responses of Spodoptera frugiperda males (Lepidoptera: Noctuidae) to plant volatiles and sex pheromone [J]. Folia Entomologica Mexicana, 2002, 41(3): 329-338.
[16]王世英, 朱启绽, 谭煜婷, 等. 草地贪夜蛾室内人工饲料群体饲养技术[J]. 环境昆虫学报, 2019, 41(4): 742-747.
[17]巴吐西, 张云慧, 张智, 等. 草地贪夜蛾对小麦和玉米的产卵选择性及其种群生命表[J]. 植物保护, 2020, 46(1): 17-23.
[18]DE BRUYNE M, CLYNE P J, CARLSON J R. Odor coding in a model olfactory organ: the Drosophila maxillary palp [J]. Journal of Neuroscience, 1999, 19(11): 4520-4532.
[19]张庆贺, 姬兰柱. 植食性昆虫产卵的化学生态学[J]. 生态学杂志, 1994, 13(6): 39-43.
[20]蒋兴川, 谢兴伟, 董文霞, 等. 甘蔗和玉米不同生育时期叶片挥发物组成及其对亚洲玉米螟的电生理活性[J]. 植物保护, 2014, 40(3): 10-19.
[21]SUN Xiao, LIU Zhuang, ZHANG Aijun, et al. Electrophysiological responses of the rice leaf folder, Cnaphalocrocis medinalis, to rice plant volatiles [J/OL]. Journal of Insect Science, 2014, 14: 70. DOI: 10.1093/jis/14.1.70.
[22]李祥, 张小娇, 肖春, 等. 不同性别和交配状态的马铃薯块茎蛾对马铃薯挥发物的触角电位反应[J]. 中国农业科学, 2021, 54(3): 547-555.
[23]KAMALA JAYANTHI P D, KEMPRAJ V, AURADE R M, et al. Specific volatile compounds from mango elicit oviposition in gravid Bactrocera dorsalis females [J]. Journal of Chemical Ecology, 2014, 40(3): 259-266.
[24]严善春, 杨慧, 高璐璐, 等. 落叶松挥发物及7种药剂对兴安落叶松鞘蛾嗅觉和产卵反应的影响[J]. 林业科学, 2008, 44(12): 83-87.
[25]周强, 徐涛, 张古忍, 等. 虫害诱导的水稻挥发物对褐飞虱的驱避作用[J]. 昆虫学报, 2003, 46(6): 739-744.
[26]ZHANG Qinghe, SCHLYTER F, ANDERSON P. Green leaf volatiles interrupt pheromone response of spruce bark beetle, Ips typographus [J]. Journal of Chemical Ecology, 1999, 25(12): 2847-2861.
[27]SUCKLING D M, GIBB A R, DALY J M, et al. Behavioral and electrophysiological responses of Arhopalus tristis to burnt pine and other stimuli [J]. Journal of Chemical Ecology, 2001, 27(6): 1091-1104.
[28]BRUCE T J, WADHAMS L J, WOODCOCK C M. Insect host location: a volatile situation [J]. Trends in Plant Science, 2005, 10(6): 269-274.
[29]钟永志, 谢明惠, 林璐璐, 等. 草地贪夜蛾对氧化芳樟醇的趋性[J]. 植物保护, 2020, 46(4): 178-180.
(責任编辑:杨明丽)
