抑制喉癌细胞瞬时受体电位M7表达对细胞生物学行为的影响及其机制
2022-06-06王慧敏王银鑫李艳峰袁东杰卢振民
王慧敏,崔 粲,王银鑫,李艳峰,袁东杰,卢振民
喉癌是头颈部最常见的恶性肿瘤之一,在头颈部肿瘤中发病率居第三位[1]。目前,喉癌的诊疗已经取得了长足进展,对于早期喉癌,手术和放疗具有较好的临床治疗效果;但对于大多数进展期喉癌,临床上仍缺乏有效的治疗方法,患者预后并未获得显著改善[2]。瞬时受体电位M7(transient receptor potential melastatin subfamily member 7,TRPM7)为TRPM家族成员,兼有离子通道功能和激酶活性,参与调控细胞生长、凋亡和发育[3-4]。已有研究[5]显示,TRPM7在肺癌组织中表达水平异常升高,并与较晚的临床分期密切相关;另有研究[6]通过体外实验证实沉默TRPM7可以抑制卵巢癌细胞的上皮-间质转化(epithelial-mesenchymal transition,EMT)过程和迁移。但目前TRPM7与喉癌的关系尚不清楚。本研究旨在通过使用短发夹RNA(short hairpin RNA,shRNA)沉默TRPM7基因表达,并探讨其对喉癌TU212细胞生物学特性的影响及其机制。
1 材料与方法
1.1 主要试剂与仪器TRPM7-shRNA及shRNA-NC真核质粒载体购自上海吉玛制药技术有限公司;RPMI-1640培养基(货号:PM150110P)购自武汉普诺赛生命科技有限公司;丙二醛(malondialdehyde,MDA)检测试剂盒(货号:A003-1)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(货号:A001-3-1)购自南京建成生物工程研究所;乳酸脱氢酶(lactic dehydrogenase,LDH) 酶联免疫吸附法(ELISA)检测试剂盒(货号:fk-m00605)购自上海樊克生物科技有限公司;Lipofectamine 2000(货号:11668)购自美国Invitrogen公司;JC-1检测试剂盒(货号:M8650)购自北京索莱宝公司;Transwell小室(货号:3421)购自美国Corning公司;TRPM7、Bax、Bcl-2、caspase-3、cleaved caspase-3、E-cadherin、N-cadherin、Vimentin一抗均购自美国CST公司;ABI 7500 RT-PCR系统购为美国Applied Biosystems产品;FACsCalibur流式细胞仪为美国BD公司产品。
1.2 细胞培养与转染人喉癌细胞系TU212由中国科学院上海细胞库提供。将TU212细胞株使用含10% FBS的RPMI-1640培养基置于37 ℃、5%CO2培养箱中培养,待细胞生长汇合率达85%以上传代培养。TRPM7特异性shRNA及阴性对照由上海吉玛制药设计,TRPM7-shRNA1、TRPM7-shRNA2、TRPM7-shRNA3靶序列分别为5′-GGTGTTCCCAGAAAGGC AA-3′、5′-AACCGGAGGTCAGGTCGAAAT-3′和5′-AA GCAGAGTGACCTGGTAGAT-3′。采用Lipofectamine 2000分别将TRPM7-shRNA1、TRPM7-shRNA2、TRPM7-shRNA3、shRNA-NC质粒载体和空载体转染TU212细胞,分别记为TRPM7-shRNA1、TRPM7-shRNA2、TRPM7-shRNA3组、shRNA-NC组和Control组。
1.3 RT-PCR检测TRPM7 mRNA表达收集转染48 h后各组TU212细胞,使用TRIzol试剂提取总RNA,测定RNA浓度和纯度后,用反转录试剂盒合成cDNA,用PCR仪进行扩增,按照试剂盒操作方法检测各组细胞TRPM7 mRNA表达水平,采用2-ΔΔCt法计算TRPM7 mRNA相对表达量。引物序列如下:TRPM7(F:5′-TCCTCAAATCAGGGCATCTT-3′,R:5′-TCTTCCACAGCAAACCACTG-3′);β-actin(F:5′-AAGGATTCCTATGTCGGC-3′,R:5′-CTTCATGATGGAGTTGAAGGT-3′)。
1.4 氧化应激标志物MDA、SOD及LDH水平检测转染48 h后,收集各组TU212细胞的培养上清液,离心后使用ELISA法检测上清液中LDH含量水平,使用比色法检测培养上清液中MDA含量及SOD活性,操作严格按照试剂盒说明进行。
1.5 克隆形成实验检测细胞增殖能力转染48 h后,将各组TU212细胞以含10% FBS的培养基配成单细胞悬液后以100个/孔密度接种于6孔板中,放入温度为37 ℃、CO2浓度为5%的培养箱中培养,每2 d更换新鲜培养基,于培养2周后培养板中出现肉眼可见克隆时,终止培养。依次使用中性甲醇固定、结晶紫染色后拍照,并在显微镜下计数大于50个细胞的克隆数。
1.6 JC-1法检测线粒体膜电位改变转染48 h后,TU212细胞以不含EDTA的胰蛋白酶消化后离心、PBS冲洗,重悬于含10%胎牛血清的RPMI-1640培养基中,然后用5 mg/ml JC-1在37 ℃黑暗条件下染色20 min;PBS清洗除去多余游离染料后,使用流式细胞仪上机检测。
1.7 Transwell实验检测细胞侵袭待各组TU212细胞转染48 h后,常规消化后以无血清培养液调整细胞密度为1×105个/ml,取200 μl细胞悬液加入铺好Matrigel基质胶的上室,24孔板下室内加入500 μl含10% FBS的培养液。培养48 h后用结晶紫对侵至小室下层的细胞进行染色并计数。
1.8 Western blot检测蛋白表达BCA法定量蛋白样品后,取40 μg蛋白经SDS-PAGE电泳转印至PVDF膜,5%脱脂牛奶室温封闭2 h,以β-actin为内参,分别加入TRPM7、Bax、Bcl-2、caspase-3、cleaved caspase-3、E-cadherin、N-cadherin、Vimentin一抗4 ℃孵育过夜,TBST洗膜3次;最后加二抗室温下孵育2 h,ECL法显色。采用Image J软件分析蛋白条带灰度值。

2 结果
2.1 干涉TRPM7基因序列的筛选和优化转染后,与Control组比较,TRPM7-shRNA1、TRPM7-shRNA2和TRPM7-shRNA3组的TRPM7 mRNA和蛋白表达水平均下降(F=160.10、209.56,P<0.05),其中以TRPM7-shRNA1组干扰效果最好,因此选择TRPM7-shRNA1进行后续功能实验。见图1。
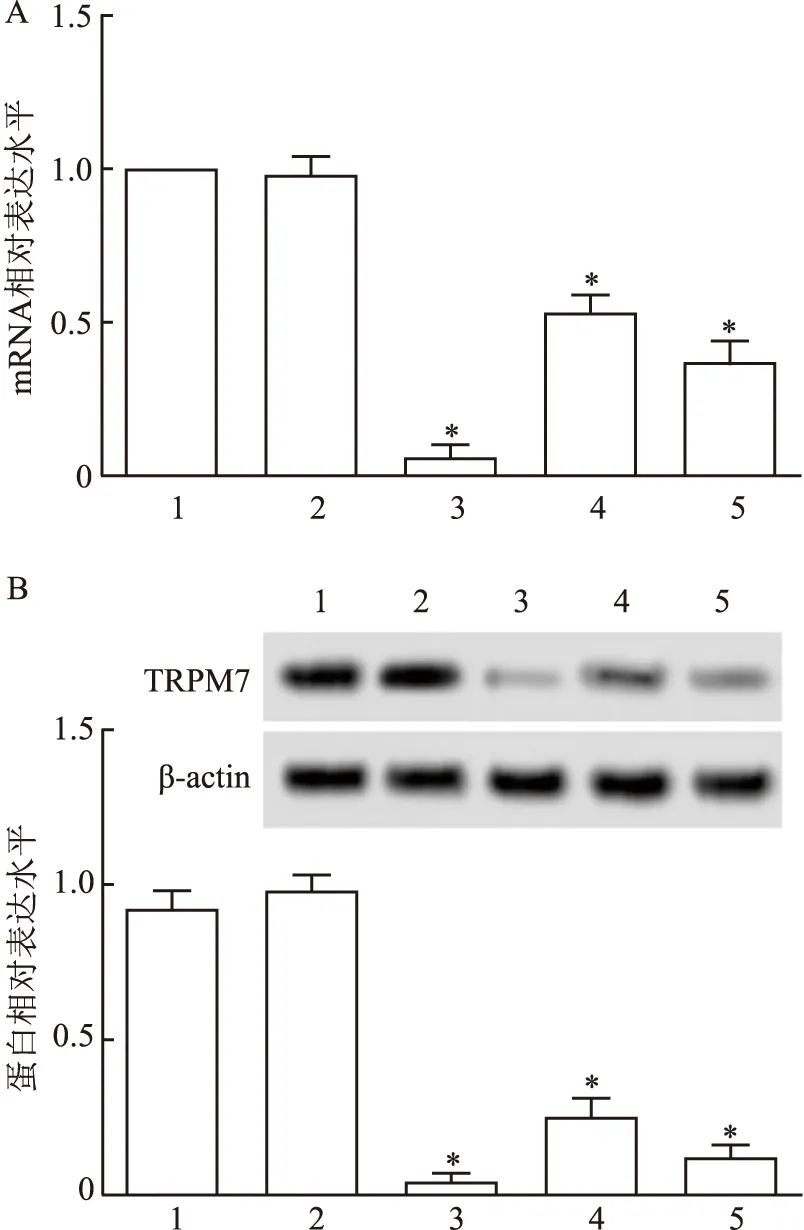
图1 干涉TRPM7基因序列的筛选和优化A:RT-PCR检测shRNA对TU212细胞TRPM7 mRNA表达的干扰效率;B:Western blot检测shRNA对TU212细胞TRPM7蛋白表达的干扰效率;1:Control组;2:shRNA-NC组;3:TRPM7-shRNA1组;4:TRPM7-shRNA2组;5:TRPM7-shRNA3组;与Control组比较:*P<0.05
2.2 敲低TRPM7对TU212细胞氧化应激水平的影响3组细胞上清液中SOD水平见图2;与Control组比较,TRPM7-shRNA1组细胞上清液中SOD水平下降(F=19.76,P<0.05),而MDA和LDH水平均升高(F=19.89、24.10,P<0.05)。

图2 敲低TRPM7对TU212细胞氧化应激水平的影响A:各组TU212细胞上清液中SOD水平;B:各组TU212细胞上清液中MDA水平;C:各组TU212细胞上清液中LDH水平;1:Control组;2:shRNA-NC组;3:TRPM7-shRNA1组;与Control组比较:*P<0.05
2.3 敲低TRPM7对TU212细胞增殖的影响CCK-8检测结果显示,24 h时三组TU212细胞增殖倍数比较差异无统计学意义(F=0.472,P>0.05),随着培养时间延长,在48、72、96 h时,TRPM7-shRNA1组细胞增殖倍数较Control组增加(F=11.84、21.17、20.18,P<0.05);克隆形成实验结果显示,与Control组比较,TRPM7-shRNA1组克隆形成率降低(F=51.32,P<0.05)。见图3。

图3 敲低TRPM7对TU212细胞增殖的影响A:CCK-8实验检测TU212细胞增殖;克隆形成实验检测TU212细胞体外增殖能力;B:平板克隆形成实验检测TU212细胞体外克隆形成能力 ×100;a:Control组;b:shRNA-NC组;c:TRPM7-shRNA1组;与Control组比较:*P<0.05
2.4 敲低TRPM7对TU212细胞线粒体膜电位及凋亡相关蛋白表达的影响JC-1法检测显示,与Control组比较,TRPM7-shRNA1组线粒体膜电位下降,去极化细胞占比增加(F=227.46,P<0.05),见图4。Western blot实验结果显示,凋亡标志物c-Myc蛋白表达在TRPM7-shRNA1组下调(F=39.41,P<0.05),Bax/Bcl-2、cleaved caspase-3/caspase-3比值在TRPM7-shRNA1组增加(F=246.22、30.96,P<0.05),见图5。

图4 敲低TRPM7对TU212细胞线粒体膜电位及凋亡相关蛋白表达的影响A:JC-1法检测TU212细胞线粒体膜电位改变;B:JC-1染红或绿的细胞百分比直方图;1:Control组;2:shRNA-NC组;3:TRPM7-shRNA1组

图5 敲低TRPM7对TU212细胞凋亡相关蛋白表达的影响A:Western blot检测TU212细胞Bax、Bcl-2、caspase-3、cleaved caspase-3、c-Myc蛋白表达;B:Bax/Bcl-2、cleaved caspase-3/caspase-3、c-Myc蛋白表达直方图;1:Control组;2:shRNA-NC组;3:TRPM7-shRNA1组;与Control组比较:*P<0.05
2.5 敲低TRPM7对TU212细胞侵袭的影响Transwell实验结果显示,与Control组比较,TRPM7-shRNA1组细胞侵袭数减少(F=23.61,P<0.05);Western blot实验结果显示,E-cadherin在TRPM7-shRNA1组表达上调(F=76.63,P<0.05),而N-cadherin、Vimentin蛋白表达下调(F=6.35、45.93,P<0.05)。见图6。

图6 敲低TRPM7对TU212细胞侵袭的影响A:Transwell实验检测TU212细胞侵袭能力 ×200;B:Western blot检测TU212细胞E-cadherin、N-cadherin、Vimentin蛋白表达;1:Control组;2:shRNA-NC组;3:TRPM7-shRNA1组;与Control组比较:*P<0.05
3 讨论
TRPM7是一种非选择性的离子通道,是调控细胞内Ca2+、Mg2+的关键通道。TRPM7广泛表达于各种类型的组织中,尤其是在心脏、骨骼和脂肪组织中,其在细胞生长、细胞死亡和发育等众多生理过程中发挥重要作用[7]。既往报道[8]中,TRPM7的缺失导致骨髓B细胞和人成骨细胞的生长抑制。另有研究[9]表明,与正常前列腺细胞相比,在前列腺癌细胞中TRPM7的表达增加,通过抑制TRPM7可抑制前列腺癌细胞迁移和侵袭。此外,多项研究[10-12]证实TRPM7基因的表达与包括卵巢癌、乳腺癌、鼻咽癌等在内的多种癌症相关。考虑到TRPM7在癌变中的重要作用,本研究采用shRNA敲低喉癌TU212细胞的TRPM7基因表达,以观察下调TRPM7表达对TU212细胞生物学特性的影响。为了防止脱靶效应,本实验设计了3对shRNA序列干扰TRPM7表达,转染后通过RT-PCR和Western blot检测证实3对shRNA干扰序列均能特异、高效地下调TRPM7的表达,并在后续实验中选择其中干扰效果最好的TU212-shRNA1进行相关功能实验。
肿瘤细胞的增殖和凋亡异常使得恶性肿瘤能异常生长[13]。本研究中,敲低TRPM7表达明显抑制了喉癌TU212细胞的增殖和集落形成能力。以往研究[14]表明,TRPM7在肿瘤的增殖、生长中发挥重要调控作用,其机制可能与TRPM7对胞内Ca2+、Mg2+的水平调节有关,Ca2+、Mg2+的内流进一步激活与增殖、生长相关信号通路进而促进细胞向G1/S和G2/M期过渡。研究[15]表明,TRPM7还与细胞凋亡密切相关,TRPM7过表达的细胞则凋亡更加明显。细胞凋亡是由凋亡相关基因控制的程序性死亡过程,以线粒体凋亡通路最为经典。在线粒体凋亡途径中,caspase-3、Bax、Bcl-2是重要的凋亡相关蛋白,其中Bax为促凋亡蛋白,而Bcl-2为抗凋亡蛋白,当线粒体通路被氧化应激等细胞凋亡信号激活时,Bax等促凋亡蛋白表达上调,并通过改变线粒体外膜的通透性,引起膜电位下降及细胞色素C的释放[16]。此外,细胞凋亡的途径依赖于caspase-3的激活,其为细胞凋亡的最终执行者。本研究中,敲低TRPM7表达后,TU212细胞的氧化应激水平明显增加,表现为SOD水平下降和MDA、LDH水平升高;另外,通过JC-1法检测到线粒体膜电位水平显著下降,与此同时,Western blot检测到caspase-3剪切体水平和Bax/Bcl-2比值显著升高。根据以上结果认为在TU212细胞中敲低TRPM7表达影响了喉癌细胞氧化应激水平和凋亡通路,从而诱导TU212细胞经线粒体途径凋亡。
向正常组织浸润及侵袭为恶性肿瘤的基本特征,亦为影响预后的关键因素。在肿瘤的侵袭和转移中,EMT为关键的起始环节,其中调节上皮细胞黏附连接的相关分子被一些连接灵活性较大的分子所取代,从而导致细胞分离和运动性增强,肿瘤细胞更易于侵入血管,并穿过血管壁外渗形成继发性转移灶[17]。本研究中敲低TRPM7表达后,TU212细胞表现出的侵袭性明显减弱;与此同时,TU212细胞的EMT过程被抑制,表现为E-cadherin上调,而N-cadherin、Vimentin下调。在卵巢癌的研究[6]中,TRPM7表达上调与卵巢癌高水平的EMT过程相关,并与卵巢癌患者较短的生存时间相关,并且通过体外实验证实敲低TRPM7削弱了钙信号,并抑制PI3K/AKT激活,从而减弱EMT过程。但是TRPM7在喉癌中是否通过同样的机制调控细胞侵袭和EMT过程有待进一步研究。
综上所述,敲低TRPM7增加喉癌TU212细胞氧化应激水平,抑制其增殖、侵袭,并通过线粒体途径诱导细胞凋亡。推测TRPM7作为促癌因子在喉癌的恶性生物学行为中具有重要作用,可能是喉癌的潜在治疗靶点。
