低氧促进肺腺癌A549细胞迁移的机制*
2022-06-01金家豪赵宝生刘玉珍
金家豪,赵宝生,刘玉珍△
(1.新乡医学院第一附属医院胸外科,2.新乡医学院第一附属医院生命科学研究中心,河南 卫辉 453100)
肺癌是我国发病率和死亡率均居第一位的对人类健康和生命威胁最大的恶性肿瘤之一[1]。近年来,中国肺癌的发病率逐年升高,尽管目前外科手术和放化疗技术已取得显著进展,并且靶向药物也在不断更新,但由于肺癌病程进展快加之其高转移性,导致肺癌患者五年生存率普遍较低[2]。目前对肺腺癌转移缺乏有效治疗方法,因此阐明肺腺癌细胞在低氧条件下迁移的机制对于治疗肺腺癌、提高患者生存率十分必要。
肿瘤细胞远高于普通细胞的能量需求注定了其具有特殊的能量代谢途径。与正常细胞相比,肿瘤组织的能量供应更依赖于增加内源性脂质的生成[3],脂质代谢在肿瘤细胞的发生发展过程中发挥重要作用[4]。低氧影响脂肪酸代谢,通过调控多个相关酶改变肿瘤细胞代谢进程[5]。低氧对于肺癌的进展尤其是转移具有重要的影响[6],低氧的直接效应因子HIF-1α在肺癌组织的坏死区域含量高[3]并被证实与肿瘤转移的不良预后相关[7],ACC1是脂肪酸合成的限速酶,本课题组的前期研究发现低氧处理肺腺癌A549细胞会促进其迁移并上调ACC1表达,影响EMT相关蛋白E-cadherin与Vimentin的表达[8],但低氧如何调控ACC1并促进A549细胞迁移,相关机制尚不明确。本研究旨在探讨低氧在肺腺癌细胞中上调ACC1表达的机制及低氧通过上调ACC1促进肺腺癌细胞迁移的机制。本研究通过使用HIF-1α抑制剂及RNA干扰技术先后抑制HIF-1α作用,并分别敲低ACC1、SREBP-1,观察低氧对于A549细胞迁移的影响,进一步探讨低氧促进A549细胞迁移的分子机制,为探索肺腺癌新的治疗靶点提供新的理论依据。
1 材料与方法
1.1 材料
人肺腺癌细胞A549购于上海吉凯基因化学技术有限公司。采用含10%胎牛血清、100 U/ml 青链霉素、100 mg/ml 青链霉素的DMEM培养基,置于37℃、5% CO2、饱和湿度培养箱内培养。
1.2 主要试剂和抗体
胎牛血清(fetal bovine serum,FBS)购自Clark,DMEM培养基购自Coming;青链霉素购自北京索莱宝科技有限公司,慢病毒ACC1-shRNA及对照shRNA由上海吉玛基因生物公司合成;PX-478购自美国 APExBIO 公司,LA购自碧云天,Transwell小室购自美国Corning公司;用以敲减SREBP-1的si-RNA序列(5'-CUCCUGCUUGAGUUUCUGGTT-3')由上海吉玛基因公司合成,PCR试剂盒QuantiNova® Reverse Transcription Kit与QuantiNova® SYBR® Green PCR Kit购自QIAGEN公司,兔源单克隆抗体E-cadherin(1∶1 000)购自CST公司,兔源多克隆抗体ACC1(1∶1 000)购自CST公司,兔源多克隆抗体Vimentin(1∶1 000)、SREBP-1(1∶1 000)抗体购自万类生物技术有限公司,兔源多克隆抗体HIF-1α(1∶1 000)购自Proteintech公司,兔源多克隆抗体β-actin(1∶1 000)购自武汉博士德公司。辣根过氧化物酶标记的山羊抗兔IgG(1∶8 000)二抗购于北京鼎国昌盛生物技术有限公司,P0018M超敏化学发光试剂盒(enhanced chemiluminescence,ECL)购自上海碧云天生物技术公司。
1.3 主要仪器
低氧小室购自STEMCELL(Catalog # 27310),SW-CJ-2D层流超净台购自中国苏州净化公司,Scientific1385生物安全柜购自美国Thermo公司,55i DS-Filc倒置显微镜及成像系统购自日本Nikon公司,QuantStudioTM实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)系统购自美国Life technologies公司,Multiskan Spectrum酶标仪购自美国Thermo公司,蛋白电泳、转印仪均购自美国Bio-Rad公司。
1.4 细胞培养
将A549接种在含10%胎牛血清和1%青链霉素的DMEM培养皿中,置于37℃、5% CO2的培养箱内培养,每2.5 d传代一次,细胞呈单层贴壁生长。
1.5 慢病毒转染
常规培养细胞,获得2小皿(每皿2×105cells)A549细胞。37℃培养箱培养36 h,取出待用。取1.5 ml 离心管2个,各加入500 μl DMEM完全培养基及500 μl DMEM基本培养基,分别加入Polybrene各1.6 μl,关掉风机,EP管中加入提前分装好的ACC1-shRNA及对照shRNA,混匀静置5 min,打开风机。用PBS冲洗细胞2遍,每皿加入1 ml病毒,放入37℃恒温培养箱。6 h后每皿各加1 ml DMEM完全培养基,次日每皿加嘌呤霉素4 μl,待细胞长满后检测ACC1是否敲低。数次筛选后培养出稳定敲低ACC1的A549细胞系。
1.6 siRNA转染方法
细胞接种于小皿中,待融合度达到35%后进行转染。采用Lipo 2000细胞转染试剂盒,按照说明书进行转染。设置对照组(NC,空白细胞)与敲减组,细胞转染48 h后,进行后续Transwell细胞迁移实验及蛋白质免疫印迹实验。
1.7 Transwell细胞迁移实验
将Transwell小室放入24孔板内,用不含胎牛血清的培养基制备细胞悬液,调整浓度为2 × 105cells/ml,取200 μl(含细胞数4×104)加入Transwell上室,24孔板下室加入600 μl含胎牛血清的培养基,将常氧对照组置于37℃培养箱中培养24 h,将低氧组24孔板放入5% O2的专用低氧装置中,置于37℃培养箱中培养24 h后取出小室;采用4%的多聚甲醇固定15 min后0.1%结晶紫染色8 min,棉签擦去上室内的细胞。显微镜下每孔选取5个视野在10倍镜下进行拍照计数,取平均值表示细胞的迁移数目;同样方法检测亚油酸(LA)处理后sh-NC及sh-ACC1组迁移的变化。
1.8 Western blot法检测相关蛋白的表达
检测低氧处理以及低氧处理并加入HIF-1α抑制剂PX-478(25 μmol)后A549细胞HIF-1α、SREBP-1、ACC1、E-cadherin、Vimentin蛋白表达变化,检测常氧及低氧条件下分别给予sh-NC与sh-ACC1的A549细胞以LA(20 μmol)处理后E-cadherin与Vimentin蛋白表达变化;将处于对数生长期的细胞按照分组进行处理36 h,用放射免疫沉淀法(RIPA)裂解细胞后提取细胞总蛋白,通过 BCA 法测定蛋白浓度(根据BCA试剂盒说明书进行操作)。以每组30 μg的等量蛋白样品上样,用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电脉(SDS-PAGE)分离蛋白,转膜,再用5%的脱脂奶粉在常温下封闭1 h,加入ACC1、E-cadherin、Vimentin等一抗4℃过夜,用TBST洗膜后(10 min × 3次),加入辣根过氧化物酶标记兔抗 IgG (1∶8 000)室温摇床上孵育1 h,再洗膜30 min,除去未结合的二抗,最后根据说明书按照1∶1配置ECL工作液,用凝胶成像仪成像;利用计算机软件Image J(版本号:V1.48)进行灰度值分析。
1.9 实时荧光PCR检测相关mRNA的表达
分别收集经常氧,5%O2,常氧 + PX-478(25 μmol)及5% O2+ PX-478(25 μmol)处理24 h后的A549细胞,采用Trizol法提取细胞总RNA,通过QUANT逆转录试剂盒将总RNA逆转录为cDNA。所需引物由吉凯基因公司合成,引物序列见表1。采用QuantStudioTMRT-qPCR系统,以SYBR1法检测ACC1与SREBP-1表达水平,β-actin作为内参,得到扩增曲线和Ct值,应用2-ΔΔCt法分析基因相对表达量。基因相对表达量=2-ΔΔCt,其中ΔΔCt=(待测组目的基因平均Ct值-待测组管家基因平均Ct值)-(对照组目的基因平均Ct值-对照组管家基因平均Ct值)。
1.10 低氧小室低氧处理细胞
按照说明书进行,具体步骤简要如下:打开低氧小室的进气口和出气口,将进气端口Tygon® 管连接到含有5% O2-5% CO2-90% N2混合气的气源,以20 L/min的速度吹扫腔室5 min,随后在断开气源的同时迅速关闭进气口与出气口环形夹,密封腔室后置于常规的CO2培养箱中培养24 h。低氧处理结束后,将低氧小室取出,打开出气口环形夹时若能听到“噗”的放气声音,说明小室未漏气,低氧处理成功。
1.11 统计学处理
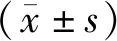
2 结果
2.1 低氧通过HIF-1α对A549细胞迁移的影响
常氧及5% O2分别处理A549细胞,Western blot 检测到A549细胞低氧处理后上调HIF-1α与ACC1表达(P均<0.01);与常氧组相比,Transwell实验显示低氧处理促进A549细胞迁移(175.0±7.3vs245.0±11.2,P<0.01);给予A549细胞低氧并给予HIF-1α抑制剂PX-478(25 μmol),与低氧组相比,加入HIF-1α抑制剂PX-478(25 μmol)后,抑制低氧对A549细胞的促迁作用(245.0±11.2vs203.0±10.3,P<0.05,图1,表2)。

Fig. 1 The effect of hypoxia on the migration of A549 cells via HIF-1α
2.2 低氧通过HIF-1α对A549细胞SREBP-1 mRNA水平与ACC1 mRNA水平的影响
常氧及5% O2分别处理A549细胞;PCR检测到低氧处理后A549 细胞ACC1 mRNA上升(P<0.05),SREBP-1 mRNA上升(P<0.01);低氧并使用PX-478处理A549细胞24 h后,A549细胞ACC1 mRNA水平较低氧对照组下降(P<0.05),SREBP-1 mRNA水平较低氧对照组下降(P<0.01,表3)。
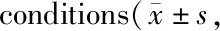
Tab. 2 The expression levels of HIF-1α and ACC1 determined by Western blot analyses under hypoxia and inhibition HIF-1α n=3)
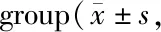
Tab. 3 Comparison of ACC1 and SREBP-1 mRNA in A549 cells in each n=3)
2.3 低氧通过HIF-1α对SREBP-1、ACC1及EMT相关蛋白E-cadherin、Vimentin变化的影响
使用常氧及5% O2分别处理A549细胞;与常氧对照组相比,低氧上调A549细胞ACC1与SREBP-1蛋白表达(P均<0.05),E-cadherin蛋白表达下降(P<0.01),Vimentin蛋白表达上升(P<0.05);低氧并给予A549细胞以HIF-1α抑制剂PX-478(25 μmol)处理,ACC1和SREBP-1蛋白水平均较低氧对照组下降(P均<0.05);E-cadherin蛋白表达上升(P<0.01),Vimentin蛋白表达下降(P<0.05,图2,表4)。

Fig. 2 Representative bands of HIF-1α,SREBP-1,ACC1,E-cadherin and Vimentin expressions after inhibiting HIF-1α in A549 cells
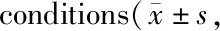
Tab. 4 The expression levels of HIF-1α,SREBP-1,ACC1,E-cadherin and Vimentin detected by Western blot analyses under hypoxia and inhibition HIF-1α n=3)
2.4 低氧通过SREBP-1对A549细胞的迁移及ACC1表达的影响
转染si-RNA获得敲低SREBP-1的A549细胞;与常氧组相比,Transwell实验显示si-SREBP-1组细胞迁移数较对照组减少(223±11vs137±6,P<0.01);给予si-SREBP-1组低氧处理,与低氧对照组相比si-SREBP-1组细胞迁移数减少(351±11vs153±9,P<0.01),与常氧对照组相比差异无统计学意义(153±9vs137±6,P>0.05);Western blot检测到si-SREBP-1组较常氧组相比,ACC1与Vimentin蛋白表达下降,E-cadherin蛋白表达上升(P均<0.01);低氧处理si-SREBF-1组后,与低氧对照组相比,ACC1蛋白表达下降,E-cadherin蛋白表达上升(P均<0.01),Vimentin蛋白表达下降(P<0.05,图3,表5)。
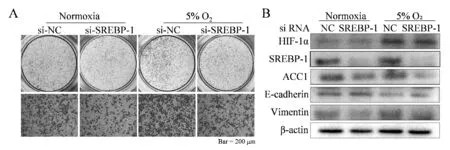
Fig. 3 The effect of si-RNA transfection to knock down SREBP-1 on the migration of A549 cells under normoxia and 5% O2 conditions
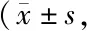
Tab. 5 The expression levels of HIF-1α,SREBP-1,ACC1,E-cadherin and Vimentin detected by Western blot analyses under normoxia and 5% O2 conditions after si-RNA transfection to knock down SREBP-1 n=3)
2.5 低氧通过ACC1调控LA对A549细胞迁移的影响
转染慢病毒获得敲低ACC1的A549细胞;敲低ACC1后A549细胞在常氧和5% O2条件下迁移细胞数差异无统计学意义(99±10.6vs80±6.43,P>0.05);5% O2条件下Vimentin与E-Cadherin蛋白表达较常氧组差异无统计学意义(P>0.05);低氧处理敲低ACC1的A549细胞并给予LA(25 μmol),A549细胞的迁移数较低氧组上升(134±14vs79±6,P<0.05)且Vimentin蛋白表达较低氧组增加(P均<0.05),E-Cadherin蛋白表达较低氧组下降(P<0.01,图4,图5,表6)。
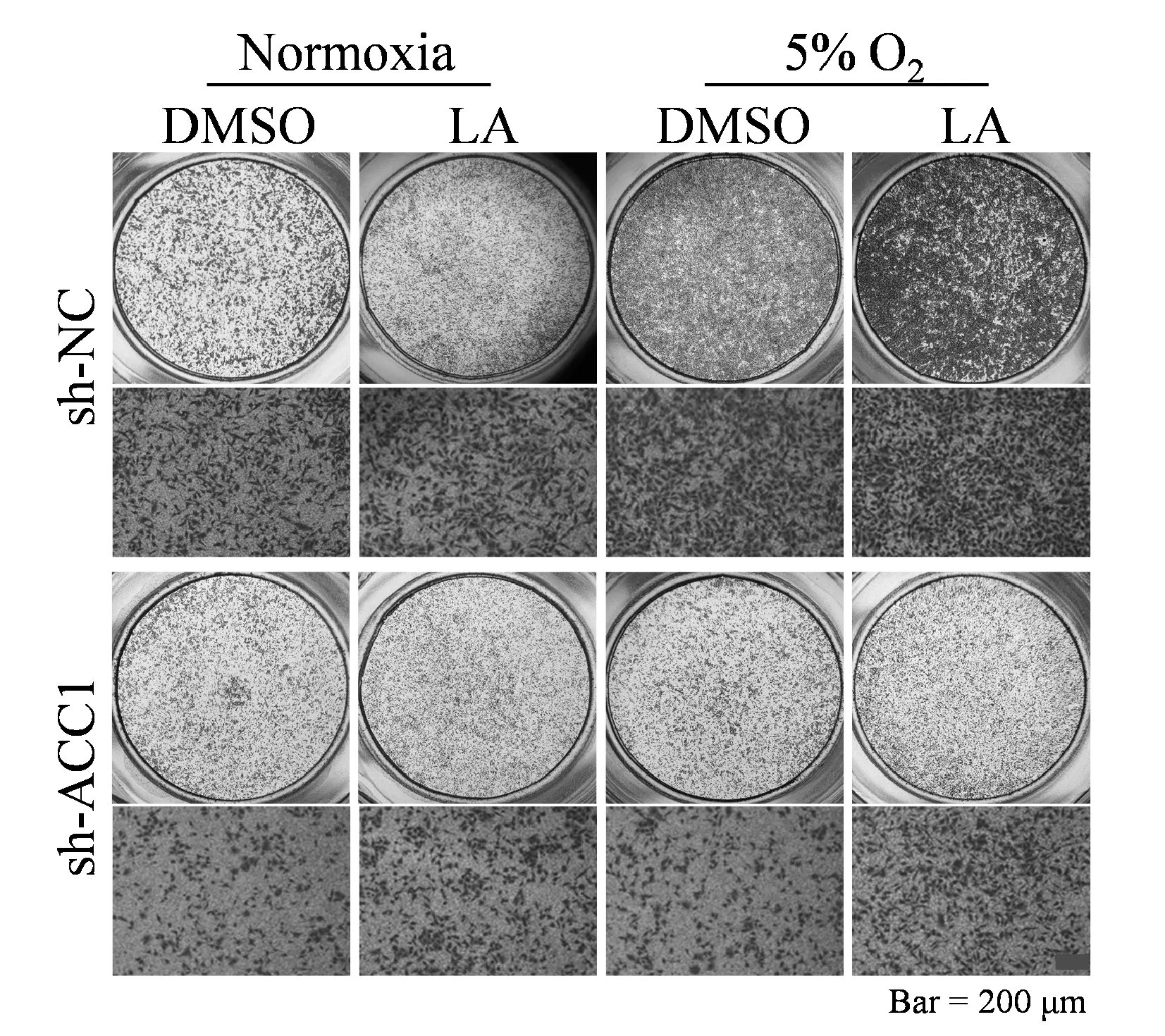
Fig. 4 The effect of LA on the migration of A549 cells that knockdown of ACC1 under normoxia and hypoxic conditions (Scale=200 μm)
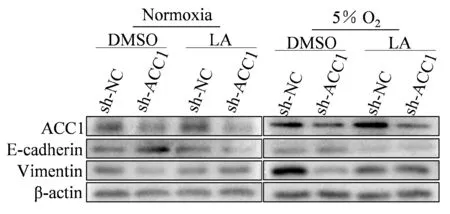
Fig. 5 Representative bands of ACC1,E-cadherin and Vimentin expressions in A549 cells that knockdown of ACC1 and supplement LA under normoxia and hypoxia conditions n=3)
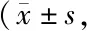
Tab. 6 The expression levels of ACC1,E-cadherin and Vimentin detected by Western blot analyses in A549 cells that knockdown of ACC1 and supplement LA under normoxia and hypoxia conditions n=3)
3 讨论
实体肿瘤由于氧扩散障碍、肿瘤微血管系统异常等因素,导致肿瘤细胞处于一种难以纠正的低氧环境,称为肿瘤低氧微环境[9]。肿瘤低氧微环境影响包括血管生成、能量代谢、肿瘤迁移在内的多种生物学行为[10]。研究发现,肿瘤细胞在低氧微环境中的代谢重编程,其与脂质代谢的改变及肿瘤细胞的迁移有密切联系,但其机制尚不清晰[11,12]。本课题组在前期的研究中,通过Transwell实验检测到低氧可促进A549细胞迁移,Western blot检测到低氧处理A549细胞后ACC1蛋白表达上升,同时使E-Cadherin蛋白表达下降,Vimentin蛋白表达上升,该结果证实低氧通过上调ACC1促进肺腺癌A549细胞迁移及EMT转化[8],但具体机制不明。
HIF-1α是肿瘤低氧微环境中调控肿瘤进展的重要转录因子,其在低氧条件下结合HIF-1β形成转录复合体,结合许多基因启动子的HRE序列,调节包括能量代谢与浸润转移在内的多种肿瘤生物学行为。研究报道,HIF-1α在低氧条件下可以增加丙酮酸激酶-2、磷酸激酶-1、葡萄糖转运蛋白-1(glucose transporter 1,GLUT1)和乳酸脱氢酶A(lactate dehydrogenase A,LDHA)基因的表达,促进肿瘤细胞糖类的代谢,促进细胞的生长与转移[13,14]。本课题组前期研究发现低氧处理A549细胞促进其迁移,同时RT-qPCR检测到ACC1 mRNA的上升,Western blot检测到ACC1蛋白水平表达的增加,而HIF-1α在低氧条件下降解减少引起其含量相对增多。由此推测,ACC1在低氧条件下转录水平的上调可能与HIF-1α有密切联系。为验证该假设,本实验使用HIF-1α抑制剂处理A549细胞并给予低氧处理,结果显示使用HIF-1α抑制剂后低氧对A549细胞的促迁作用减弱,同时RT-qPCR检测到ACC1 mRNA水平较低氧组明显下降,但与常氧组相比差异无统计学意义。Western blot检测到ACC1蛋白表达与低氧组相比下降但与常氧组相比差异无统计学意义。此外,EMT相关蛋白较低氧对照组相比,E-Cadherin表达上升,Vimentin表达下降,即低氧促进EMT的表型被逆转,结果显示低氧通过HIF-1α上调ACC1促进A549细胞迁移。
SREBP-1是细胞内维持脂类代谢稳定的重要因子[15],通过调节与脂肪酸从头合成途径有关基因调节脂类在肿瘤细胞内的代谢[16,17],其中包括ACC1。研究报道,HIF-1α在低氧条件下进入细胞核促进SREBF-1转录[18]。然而关于低氧条件下A549细胞中SREBP-1水平变化及其对ACC1的影响尚不明确。因此本研究检测低氧处理A549细胞后SREBP-1蛋白及mRNA的变化,发现低氧上调SREBP-1蛋白及mRNA水平,并且使用HIF-1α抑制剂后这种促进作用消失。随后,本研究通过转染si-RNA获得敲低SREBP-1的A549细胞,低氧对于该细胞的促迁作用减弱且ACC1表达较对照组明显降低。因此上述结果提示SREBP-1在低氧条件下通过HIF-1α上调ACC1促进A549细胞迁移的过程中发挥作用。敲低SREBP-1能够减弱低氧对于A549细胞的促迁作用,该作用可能与下调ACC1进而影响脂肪酸合成有关。
ACC1是脂肪酸代谢的限速酶[19],文献报道敲除ACC1会抑制肺腺癌细胞的增殖,并且这种作用是以脂肪酸合成为基础[20]。以高脂饮食饲养的小鼠其肺部肿瘤结节明显高于正常饮食组,说明高脂肪饮食有助于癌症细胞的转移[21],提示脂类代谢与肿瘤的发生与转移有密切关系。有研究报道,敲低脂肪酸代谢的另一种关键酶-脂肪酸合成酶(fatty acid synthase,FASN)可以抑制膀胱癌细胞的UMUC3的迁移能力[22]。该结果表明,干预肿瘤细胞的脂肪酸代谢可能影响肿瘤细胞的迁移,然而关于低氧、ACC1和肺腺癌细胞迁移之间的联系则鲜见报道。为进一步探索低氧条件下ACC1与肺腺癌细胞迁移的联系,本课题组在前期研究中给予敲低ACC1的A549细胞以脂肪酸处理,检测A549细胞迁移能力的变化,结果显示补充脂肪酸可部分恢复低氧对于敲低ACC1的A549细胞的促迁作用[8];随后进一步检测该条件下A549细胞处理后EMT相关蛋白的变化,发现EMT相关蛋白E-Cadherin表达下降,Vimentin表达上升,即与低氧促进A549细胞迁移相关的EMT表型得到恢复。因此推测低氧通过HIF-1α/SREBP-1/ACC1途径促进肺腺癌A549细胞迁移可能与脂肪酸合成有关。关于脂肪酸与肿瘤细胞迁移之间的联系,目前认为主要有两个关键点:1)能量合成,2)脂筏合成。肿瘤细胞通过重编程脂代谢途径获取迁移所需能量,同时利用脂肪酸合成迁移所需结构(如脂筏等)[23]。通过干涉HIF-1α/SREBP-1/ACC1途径可能对肺腺癌的进展具有抑制作用。此外,亦有研究报道低氧能够促进乳腺癌细胞MCF-7及胶质瘤细胞U87等多种肿瘤细胞迁移且其机制与EMT有密切联系[24,25],这提示本研究结果可能存在于其他非肺腺癌细胞系中,但具体机制仍有待深入研究。
综上所述,本研究结果显示,低氧能够通过HIF-1α/SREBP-1途径上调肺腺癌A549细胞的ACC1表达进而促进肺腺癌A549细胞迁移,并且这种促进作用与脂肪酸的合成相关。本研究证明低氧通过HIF-1α/SREBP-1/ACC1途径参与肺腺癌细胞的迁移,确定ACC1在肺腺癌细胞迁移中的作用,有助于加深对肺腺癌细胞迁移的分子机制的了解,为肺腺癌的新型靶向治疗提供理论依据,通路所涉及的分子可能成为肺腺癌治疗新的靶点。
