完全弗氏佐剂诱导大鼠慢性骨盆疼痛综合征炎性痛模型的制备*
2022-06-01吴晓玲
徐 畅,吴晓玲,程 凯,李 娜
(北京中医药大学针灸推拿学院,北京100029)
慢性骨盆疼痛综合征(chronic pelvic pain syndrome,CPPS)是男性泌尿生殖系统中的常见病和多发病,约占到前列腺炎的90%以上,主要是由于前列腺受到某些非感染因素刺激而发生的炎症反应[1]。CPPS典型的临床特征为尿频、尿急、排尿困难等排尿异常以及腰、骶神经所支配的会阴部、外生殖器、膀胱及尿道等部位的疼痛不适,严重者还可影响正常性功能,给患者带来极大的精神负担[2]。CPPS的病因、发病机制及病理生理过程十分复杂,可能与自身免疫异常、氧化应激、内分泌失调等多种因素有关[3,4]。因此,为了更好地了解CPPS的发病机制以及找到有效的诊治方法,建立可靠的实验动物模型尤为重要。
基于不同的研究目的,国内外研究者已建立的前列腺炎模型包括自身免疫诱导模型,老龄动物自发模型,激素和去势诱导模型以及化学物质刺激模型等,这些方法的操作难度、成功率以及炎症能维持的时间各不相同,且对模型的检测方法和评价标准也不统一。化学物质刺激法是将角叉菜胶、完全弗氏佐剂(complete Freund’s adjuvant,CFA)、福尔马林等物质直接注射到动物前列腺组织,其操作方便,使用相对广泛。且化学物质诱导的前列腺炎模型不仅能引起无菌性炎症,还可成功模拟盆腔疼痛[5]。因此,本研究采用向大鼠前列腺组织注射化学物质的方法建立CPPS炎性痛模型。炎症性疼痛有急性和慢性之分,如角叉菜胶、福尔马林诱发的炎性反应可在一周后消失,所以多用于制备急性和亚急性炎症模型[6]。CFA诱导的炎症性疼痛可持续2~3周(1~2周以上相当于人类患者的慢性期),且与临床症状最为相关,所以是诱导慢性炎症疾病最经典、稳定的造模药[7,8]。因此,本实验通过向大鼠前列腺腹侧叶注射CFA原液,以建立并评估CPPS慢性炎性痛模型,为CPPS的发病机制及抗炎镇痛治疗提供可靠的动物模型。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠60只,体质量(200±20)g,(由北京维通利华实验动物技术有限公司提供,许可证号[SYXK(京)2016-0006])。大鼠饲养于北京中医药大学良乡校区动物房(23±2)℃,湿度45%~55%,光照/黑暗循环12 h,自由摄食饮水。
1.2 主要仪器与试剂
CFA、青霉素钠(北京百诺威生物科技有限公司);水合氯醛(上海源叶生物科技有限公司);4%固定液(北京酷来搏科技有限公司);苏木精-伊红染色试剂盒(江苏凯基生物技术股份有限公司);热刺痛仪(PL-200,成都泰盟科技有限公司);正置显微镜(德国Leica);EG1150H石蜡包埋机、切片机、摊片机(德国Leica)。
1.3 分组与模型制备
60只SD雄性大鼠按随机数字表法分为空白组,假手术组和模型组,每组20只。参考洪志明[9]等的方法,向大鼠前列腺腹侧叶注射CFA原液0.1 ml以制备CPPS模型。具体操作为:60只SD大鼠适应性饲养7 d后,将假手术组和模型组大鼠称重,以0.35 ml/100 g 10% 水合氯醛溶液腹腔注射麻醉。麻醉满意后,将大鼠仰卧位固定于动物手术台,剃除右下腹部毛发,用75%酒精消毒皮肤,于大鼠腹正中线右侧旁开1 cm的位置做一纵向切口,长约2 cm。分离肌肉、腹膜,先找到膀胱,然后沿着膀胱颈部找到前列腺组织并充分暴露。用镊子固定前列腺腹侧叶,在两侧前列腺腹侧叶分别注射0.05 ml CFA原液,且分离多个注射部位。假手术组以同样的方法注射等量无菌生理盐水溶液。用可吸收缝合线逐层缝合肌肉、皮肤,碘伏消毒伤口(图1)。术后将大鼠放置于毛绒毯上等待苏醒,单笼饲养,连续3 d用碘伏消毒伤口并腹腔注射青霉素钠溶液1.6×106U,以防止伤口化脓感染[10]。
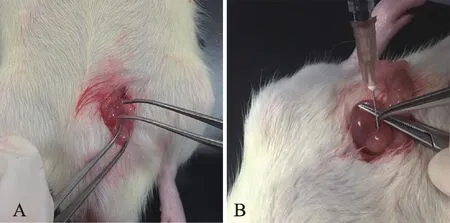
Fig. 1 The process of surgical operation to inject CFA solution into the ventral prostate lobes
1.4 大鼠一般情况观察
观察各组大鼠的一般状况,包括活动度、排尿量、毛发光泽度等。
1.5 热刺激疼痛阈值测定
参考Hargreaves[11]等的热痛阈值测定方法,分别于造模第7,14,21,28,35日测定各组大鼠足底和阴囊热刺激疼痛阈值。设置热刺痛仪(PL-200,成都泰盟科技有限公司)实验参数为光照强度为50%,照射停止时间为30 s。然后将大鼠用密闭可拆卸的透明有机玻璃盒子隔开,适应实验环境30 min,待大鼠不再四处张望、走动后开始测量。移动热刺痛仪控制桶,使其中心刺激光源分别对准大鼠后肢足底中心正下方及阴囊部位。当大鼠出现闪躲、抬腿、舔脚以及舔阴囊时则标记为阳性反应(图2)。机器自动记录的时间为热刺激疼痛阈值(以s为单位)。每只大鼠重复测定3次,每次测量中间至少间隔10 min,以防止散热不够对大鼠造成伤害以及影响测定结果,以3次测定的平均值为热刺激疼痛阈值。
1.6 大鼠前列腺湿重以及前列腺指数观察
热刺激疼痛阈值测定结束后,大鼠称重,麻醉处死。快速分离前列腺组织,用预冷的生理盐水冲洗去除附着的血液和脂肪组织,吸水纸吸干水分后称重,分析前列腺指数。前列腺指数计算公式:前列腺指数 = 前列腺质重(mg)/大鼠体质量(g)。

Fig. 2 Measurement of pain threshold of heat stimulation
1.7 大鼠组织学切片观察
取大鼠前列腺组织部分右侧腹侧叶,4%多聚甲醛溶液中固定2 d,乙醇梯度脱水(75%、80%、90%、95%、无水乙醇Ⅰ、无水乙醇Ⅱ),二甲苯透明,浸蜡,石蜡包埋后进行切片,片厚4 μm,苏木素-伊红染色,在光学显微镜下观察各组前列腺组织的结构形态变化。参考文献[12],半定量法评价前列腺组织损伤程度,根据前列腺组织病理学改变的严重程度进行记分制:前列腺腺体形态正常,腺泡内分泌物均匀充盈,间质无纤维增生,无炎性细胞浸润或仅有极少量炎性细胞,记为0分;腺腔轻度萎缩,腺泡内分泌物减少,间质有轻度纤维增生、少量炎性细胞浸润记为1分;腺腔严重萎缩,腺泡内分泌物明显减少,间质纤维增生严重,有大量炎性细胞浸润记为2分;腺腔严重萎缩至破坏,上皮细胞破坏,腺泡内分泌物完全消失,间质纤维增生严重,有大量炎性细胞浸润记为3分。
1.8 统计学处理
2 结果
2.1 大鼠一般情况观察
空白组和假手术组大鼠的精神状态、活动度、毛发光泽度以及排尿量均正常,无死亡。与空白组和假手术组比较,模型组大鼠精神萎靡,活动度降低,食欲减退。毛发光泽度降低,且术后3 d呈现暗黄色。排尿量显著增加(同等时间内垫料湿度增加),尿道口偶见乳白色异常分泌物。造模期间3只模型组大鼠出现腹胀、腹泻、消瘦甚至死亡,考虑与术后肠蠕动减缓及CPPS伴发肠易激综合征有关。
2.2 大鼠各时期热刺激疼痛阈值比较
对大鼠足底和阴囊不同时期的热刺激疼痛阈值进行测定,数据显示(图3),空白组大鼠足底和阴囊热刺激疼痛阈值基本恒定。与空白组比较,假手术组大鼠足底和阴囊热刺激疼痛阈值在造模第7日明显降低(P<0.01),后逐渐提高并趋于稳定。与空白组和假手术组比较,模型组大鼠各个时期足底和阴囊热刺激疼痛阈值均显著降低(P<0.01),并在实验期间维持稳定。同实验阶段,大鼠阴囊热痛阈值稍低于足底热痛阈值,但二者比较差异无统计学意义(P>0.05)。
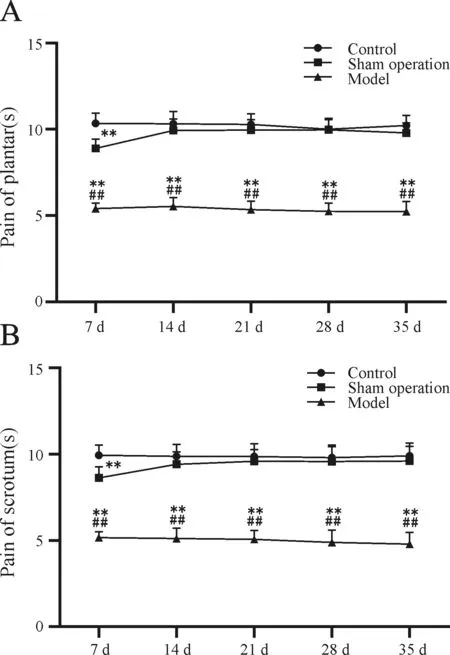
Fig. 3 Thermal stimulation pain threshold were assessed at each time point (7,14,21,28,35 day after modeling) n=15)
2.3 大鼠前列腺湿重和前列腺指数比较
如图4所示,与空白组和假手术组比较,模型组大鼠前列腺湿重和前列腺指数显著升高,差异有统计学意义(P<0.01)。
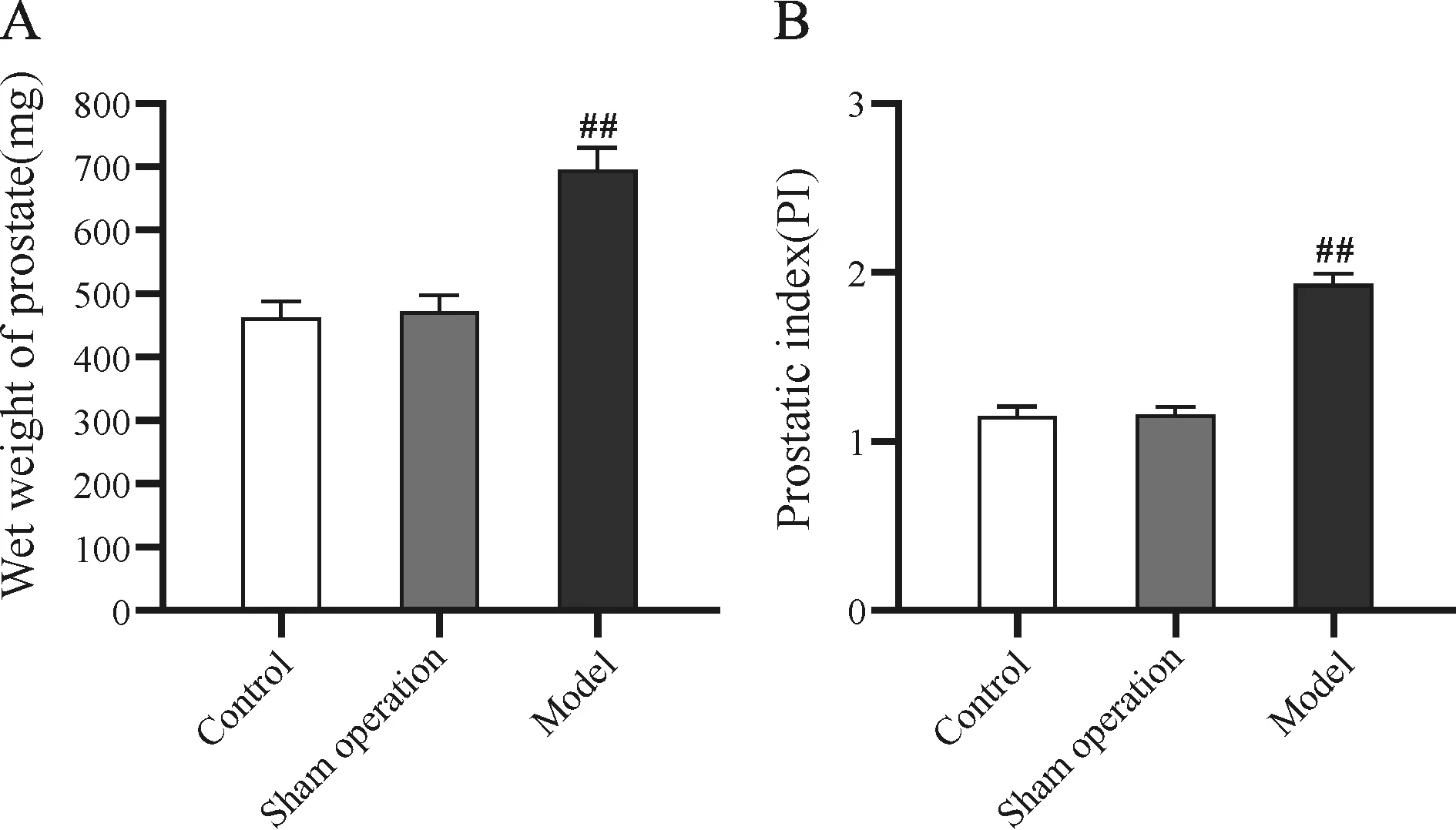
Fig. 4 Comparison of prostate wet weight and prostate index in n=15)
2.4 大鼠前列腺组织病理观察
肉眼观察(图5),空白组和假手术组大鼠前列腺组织呈粉红色,质地均匀、柔软、光滑,无水肿,无硬结,与周围膀胱等组织无粘连。与空白组和假手术组比较,模型组大鼠前列腺组织呈暗红色,水肿明显,组织表面有较多结节,质地较硬,与周围组织粘连明显,不易剥离。
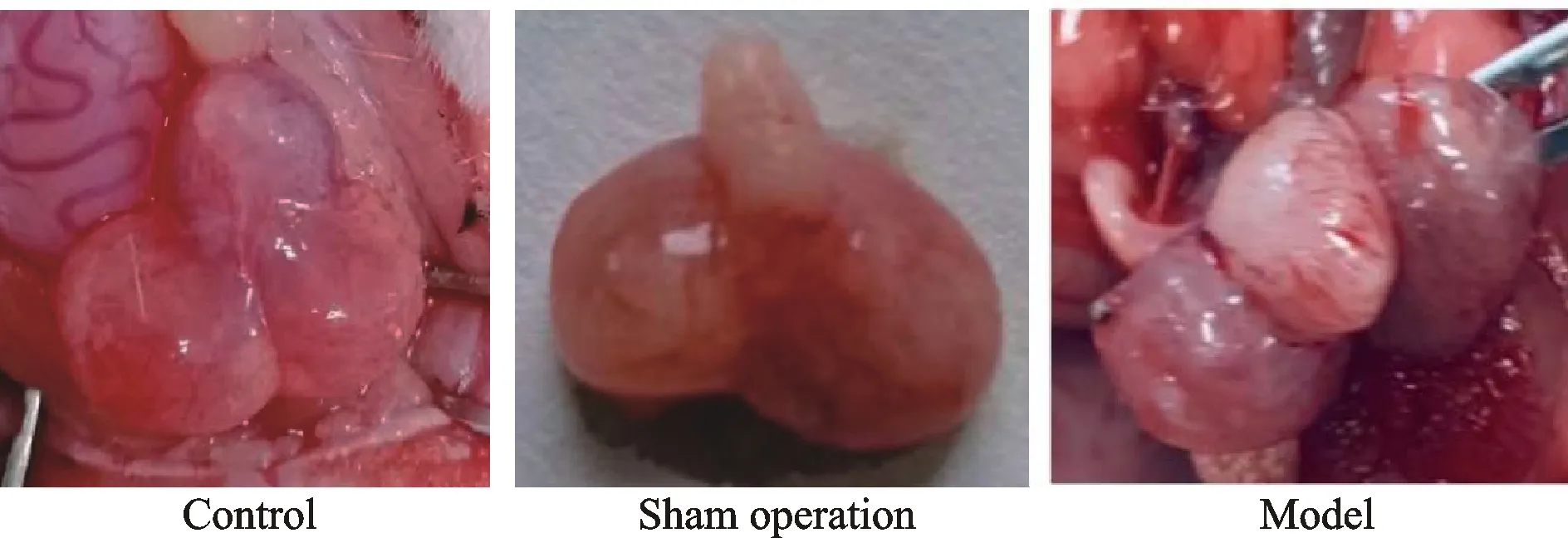
Fig. 5 Anatomy of prostate tissue in control,sham operation and model group
显微镜下观察(图6),空白组和假手术组大鼠前列腺组织结构完整,可见大小不一呈类圆形的腺泡,腺泡上皮呈柱状,形成许多复杂的乳头嵴突向腺管腔。腺腔内充满均匀的粉红色分泌物,腺泡周围包绕有大量平滑肌束,间质无水肿,无炎性细胞或仅有散在的炎性细胞分布。模型组大鼠前列腺腺腔萎缩、折叠,腔内分泌物减少甚至完全消失。部分腺泡上皮细胞由柱状变成矮柱状或扁平状,间质内有大量炎性细胞浸润,纤维组织增生,病变严重处前列腺腺泡完全为炎性细胞及纤维组织所替代。经秩和检验,模型组大鼠前列腺炎性反应高于空白组和假手术组,组织病理学分值有统计学差异(P<0.01,表2)。
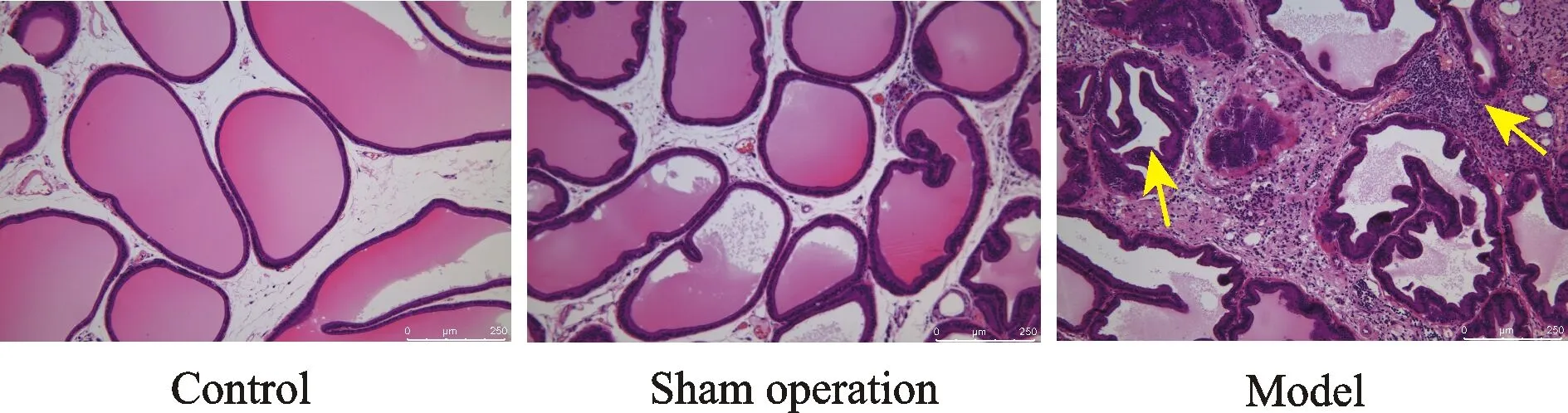
Fig. 6 Histology of prostate in control,sham operation and model groups (Scale bar=250 μm),arrows represent inflammatory cell infiltration and atrophic glandular cavity
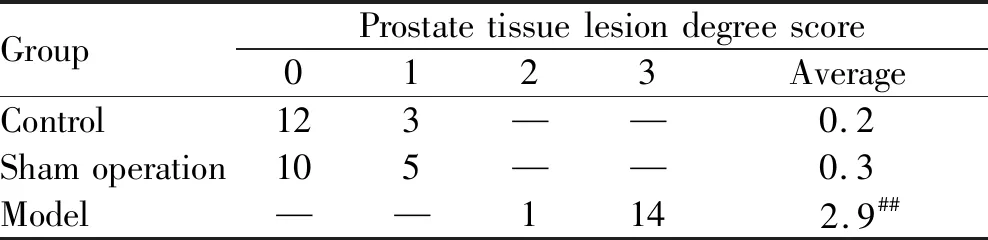
Tab. 2 Pathological changes of prostate tissues(n=15)
3 讨论
慢性盆腔疼痛是CPPS最突出的症状表现,由于疼痛部位广泛且迁延难愈,给患者带来巨大的身体痛苦和精神负担[13]。疼痛通常与炎症有关,炎性痛是由感染、创伤、化学物质等引起外周组织损伤,刺激炎症细胞和神经末梢释放炎性因子导致炎症反应所发生的疼痛,以痛觉过敏和痛觉超敏为主要临床特征,同时可伴有局部红肿热痛和功能障碍,是临床中最常见的疼痛类型[9]。研究表明,在CPPS患者前列腺液中通常可以检测到促炎性细胞因子表达的上调,证实CPPS患者机体常处于炎症状态[14]。而病灶局部释放的炎性介质可持续刺激伤害性感受器,伤害性信号的持续或反复刺激还可增加中枢神经递质的释放,引起脊髓内感觉神经元兴奋性发生改变,这些可能是炎症驱动下导致机体痛觉敏感性提高的重要原因[15,16]。因此,为了进一步明确CPPS慢性炎症性疼痛的病因、发病机制以及探索有效的治疗方法,本研究采用向大鼠前列腺组织注射CFA原液建立CPPS慢性炎性痛模型。
CFA是由结核分支杆菌、液体石蜡、羊毛脂等在高温下灭活而成的一种混合油剂,可能导致注射部位局部炎症和肉芽肿性反应,慢性炎症,局部脓肿或组织脱落,关节炎等,多用于各种炎性痛疾病模型的制备[17]。根据CFA注射指南,参考大鼠肌肉注射方法,本研究确定的注射剂量为0.1 ml,注射部位为大鼠前列腺腹侧叶,且分离注射部位以避免聚结炎性病变。尽管有文献指出前列腺背侧叶效果更好,但由于背侧叶体积小,且位于精囊内侧,不易操作,所以将腹侧叶作为首选注射部位[18]。另外,本研究考虑到后期需要对大鼠关元穴、中极穴进行针刺,为了避免穴位的损伤,我们在大鼠下腹部前正中线旁开1 cm做切口,保证大鼠生存率不受影响。
前列腺组织学改变是判断炎症是否发生以及严重程度最直观的指标,研究结果显示,CPPS模型组大鼠前列腺组织受损严重,前列腺湿重及前列腺指数显著增加,组织间质内大量炎性细胞浸润,腺腔萎缩严重,组织病理评分提高,提示CFA成功诱发前列腺组织的炎症反应。
急性炎症性疼痛是对组织损伤或感染的自然生理反应,对于机体来说具有积极意义,并且有一定的自愈能力。而慢性炎症性疼痛往往由急性炎症性疼痛发展而来,疼痛可持续数月甚至数年,甚至造成严重的功能障碍[19]。据以往的研究发现,由于不同的造模药能维持的成模时间不同,因此,疼痛持续时间是本研究关注的重点。临床中对CPPS疼痛的评估多采用NIH-CPSI量表,但实验动物无法用语言来表达其感受到的伤害性刺激,所以需通过行为学表现如探索行为减少、反射缩足行为、搔抓嘶叫等来间接评价其疼痛程度。利用热刺痛仪对热痛阈值进行测定是动物模型中常用的定量衡量疼痛的方法之一,测痛部位常根据疾病性质和疼痛部位而定[20]。结合CPPS的疼痛部位以及测痛仪器的限制,我们首先对大鼠阴囊进行测痛实验。结果显示,造模第7日时,假手术组大鼠阴囊热痛阈值降低,提示手术损伤可能会引起大鼠痛阈值的短暂性波动,而随着伤口恢复,大鼠痛阈值提高并趋于平稳。与同时期的空白组和假手术组比较,模型组大鼠阴囊的痛阈值显著降低并可稳定维持5周以上,提示CFA可成功诱导大鼠慢性疼痛,且疼痛维持时间较长,模型较为稳定。
同样,我们在大鼠足底也检测到痛觉敏感性的提高,这可以从神经传导与反射来分析。从神经解剖学来看,大鼠坐骨神经主要由L3-6、S1-2神经根参与汇合成腰骶神经丛,向下延续为坐骨神经干。其先在骶髂关节前走行,后绕过股骨大转子进入股骨后方,发出3大分支,腓总神经、胫神经和腓肠神经。其中胫神经为坐骨神经的主要终末支,发出分支支配腓肠肌和屈趾肌群,并沿其下行至足底支配足内侧皮肤及肌肉[21]。因此,大鼠足底痛敏也可以反映其盆腔部位的痛觉敏感性,且操作性更强。
综上所述,向大鼠前列腺腹侧叶注射0.1 ml CFA原液可成功制备较持久、稳定的CPPS慢性炎症性疼痛模型,该建模方法可为后期CPPS的机制研究及镇痛治疗提供良好的工作基础。但上述方法仍存在不足之处,如实验中注射造模药物仅采用一个剂量,缺少不同剂量之间的比较,因此还需后期不断完善。
