不同运动方式对2型糖尿病小鼠肠道菌群及短链脂肪酸的影响*
2022-05-29黄燕凤刘玉花
韦 薇,张 秋,黄燕凤,翟 露,刘玉花,马 翠,黄 山,钟 鑫,戴 霞△
(1.广西医科大学第一附属医院,南宁 530021;2.广西壮族自治区人民医院,南宁 530021;3.广西医科大学第二附属医院,南宁 530007;4.北京医院,北京 100730;5.重庆市巴南区人民医院,重庆 401320)
糖尿病与肠道菌群之间有着密切的联系,肠道微生物环境稳定依赖于益生菌占据绝对优势,致病菌繁殖受到控制。但在糖尿病状态下,肠道菌群处于中等失调的状态,肠道内的总菌数量下降,菌群的比例发生改变,厚壁菌门和变形菌门细菌的相对丰度升高,拟杆菌门和放线菌门细菌的相对丰度降低,糖尿病患者粪便中短链脂肪酸(short-chain fatty acid,SCFA)浓度显著降低[1-2]。厚壁菌门在促进机体对食物能量的摄取利用方面发挥了重要作用[3]。拟杆菌门参与发酵碳水化合物、多糖、胆汁酸和类固醇代谢,维持肠道正常生理等功能。放线菌中双歧杆菌属有酸化肠道内环境、抑制腐败菌和病原体生长等作用。变形菌门多数为致病菌,在肠道内含量较少[4]。肠道菌群的结构、数量以及功能受到多种因素的影响,其中运动与肠道菌群有着密切的联系[5]。运动不仅能改善糖尿病患者的糖脂代谢,血压、胰岛素抵抗等代谢指标,还会影响人体肠道菌群的组成及代谢[6-7]。目前关于运动对肠道菌群及其代谢产物的研究多为有氧运动,抗阻运动及联合有氧—抗阻运动的研究鲜有报道。据此,本研究对糖尿病小鼠进行8 周的有氧运动、抗阻运动及联合有氧—抗阻运动干预,比较3 种运动方式对小鼠肠道菌群及粪便、血清中SCFA的影响,为运动改善肠道菌群和治疗糖尿病提供新的研究依据和指导意义。
1 材料与方法
1.1 实验动物 取C57BL/KS.db背景的雄性db/db小鼠40只,8周龄,随机血糖≥300 mg/dL,购自南京大学南京生物医药研究院。所有动物饲养于广西医科大学实验动物中心,饲养条件:温度24~26 ℃,相对湿度50%~60%,自由摄食、饮水。
1.2 主要试剂 Pusion Hot start flex 2×Master Mix,上海仪涛生物;DL2000 DNA Maker,Takara;Gene colour,北京金博益;Qubit dsNDA HS Assay Kit,Invitrogen,Life technologies;Biowest Agarose G-10,BIOWEST;50×TAE Buffer,上海生工;AMPure XT beads,Beckman;E.Z.N.A.®Stool DNA Kit,Omega Bio-Tek;甲醇、乙酸、丙酸,Merck,Darmstadt,Germany;2-乙基丁酸,Sigma-Aldrich;正己烷,上海阿拉丁。
1.3 实验分组和运动方案 将40 只小鼠随机分为4组,即有氧运动组(Y组)、抗阻运动组(K组)、有氧联合抗阻运动组(L 组)和对照组(D 组),每组10只。D 组无运动干预,其余各组进行为期8 周的运动干预。
具体运动方案如下:(1)Y 组:采用坡度为0°的八跑道小鼠跑台(北京东西仪器科技有限公司,型号:WDW-1)进行无负重跑台运动,第1 周,小鼠每天运动30 min,运动速度10~15 m/min;第2~8周,小鼠每天运动60 min,运动速度15 m/min。(2)K组:采用自制的爬梯(长1 m,坡度为85°)进行尾部负重爬梯训练,每天完成2组,每组3次不同负重的抗阻运动,第1周负重10%体重,第2周负重20%体重,第3周负重30%体重,第4周负重50%体重,第5~8周负重70%体重。(3)L 组:采取有氧运动与抗阻运动间隔进行的运动方式,周一、周三、周五进行抗阻运动训练,运动方式、运动量及运动时间同K 组;周二、周四、周六进行有氧运动训练,运动方式、运动量及运动时间同Y组。
1.4 血糖监测 检测小鼠的随机血糖值。酒精消毒小鼠尾部末端,待干。取出血糖试纸(强生稳豪试纸),插入血糖仪(强生稳豪血糖仪),无菌医用剪剪取小鼠尾部2 mm,待血液流出,使血液滴入血糖试纸血槽,数秒后,读取血糖仪上的血糖数值并记录。
1.5 取材 无菌管收集小鼠粪便并称重,置于-80 ℃超低温冰箱冻存。用1%戊巴比妥钠(100 mg/kg体重)麻醉后进行眼静脉丛取血,颈椎脱臼处死,低温下1 000 r/min 离心10 min,取上层血清,置于-80 ℃超低温冰箱冻存。
1.6 16S rDNA测序 使用Stool DNA Kit进行粪便DNA 提取,通过琼脂糖凝胶电泳检测DNA 提取质量,紫外分光光度计对DNA 进行定量,对粪便细菌16S rDNA 的V4 区进行PCR 扩增,引物为515F(5’-GTGYCAGCMGCCGCGGTAA-3’)和806R(5’-GGACTACHV GGGTWTCTAAT-3’)。PCR 反应体系:Pusion Hot start flex 2×Master Mix 12.5 μL,上、下游引物各2.5 μL,DNA 模板50 ng,ddH2O 定容至25 μL。PCR反应条件:98 ℃预变性30 s;98 ℃变性10 s,54 ℃退火30 s,72 ℃延伸45 s,共35 个循环。PCR 扩增产物通过2%琼脂糖凝胶电泳进行检测,采用AMPure XT beads 试剂盒对目标片段进行回收,上机测序。
生物信息学分析:采用FLASH(v1.2.8)软件,根据双端序列的overlap 关系,将序列拼接(merge)成长的tag,并将序列上建库引入的barcode 和引物序列去除,然后采用vsearch(v2.3.4)过滤嵌合体。预处理之后的cleandata使用Vsearch 将序列相似性大于97%的clean tags定为一个OTU,挑选最佳的centroids(位于几何中心)序列作为该OTU 的代表序列。使用QIIME(v1.8.0)分析Alpha 多样性。使用blast 进行序列比对,将OTU 代表序列与RDP(核糖体数据库)以及NCBI-16S 数据库对每个代表性序列进行物种注释。其他图片使用R 包(V3.2.5)实现。
1.7 SCFA 检测 SCFA 检测采用气相色谱—质谱联用法(GC-MS)进行检测。配制乙酸、丙酸、丁酸的混合溶液后,再依次配制成0.000 1 μL/μL、0.000 7 μL/μL、0.001 4 μL/μL、0.007 1 μL/μL、0.014 3 μL/μL、0.017 9 μL/μL、0.035 7 μL/μL 的浓度梯度,使用7个浓度的标品样本进行GC-MS检测,根据不同浓度及相应浓度下标品的相对峰面积(标品峰面积/内标峰面积)绘制标准曲线。样本进行预处理后进行GC-MS检测,根据绘制的标准曲线及待测样本中该物质的峰面积计算出该物质在样本中的含量。1.8 统计学方法 采用SPSS 20.0统计软件对数据进行分析,正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Bonferroni 检验;偏态分布的计量资料以中位数(四分位数间距)[M(P25~P75)]表示,多组间比较采用Kruskal-WallisH检验,组间两两比较采用Wilcoxon 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 不同运动方式对小鼠血糖的影响 Y 组、K 组和L 组小鼠运动干预8 周后的血糖均低于D 组,Y组、K 组和L 组之间小鼠血糖比较差异无统计学意义,见图1。
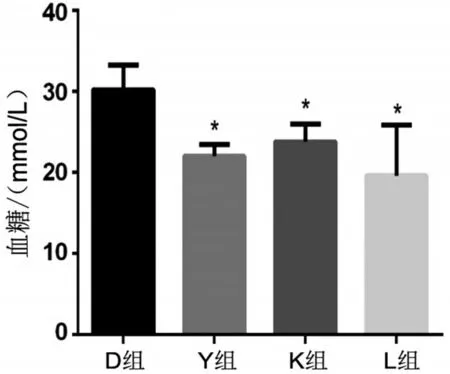
图1 各组小鼠运动干预后的血糖比较
2.2 OTU 分布Venn 图 图2 列举了不同运动方式对小鼠共有以及特有菌种的数量,4组小鼠共有810种菌种为共有菌种,Y 组特有菌种有59 种,K 组有127种,L组有12种,D组有8种,Y组、K组和L组小鼠的特有菌种数量均高于D 组,说明3 种运动方式均有提高菌群种类的作用。
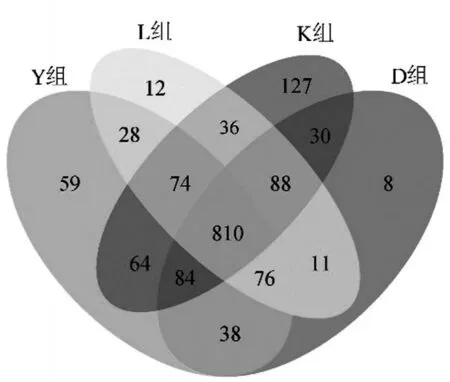
图2 OTU分布Venn图
2.3 不同运动方式对小鼠肠道菌群多样性的影响 本研究以chao 1 指数和shannon 指数来评价小鼠肠道微生物的Alpha 多样性,chao1 指数高,说明样品物种数目越多,shannon 指数越大,多样性越高[8]。运动干预8周后,4组小鼠chao 1指数和shannon 指数比较,差异有统计学意义(P<0.05),K 组2型糖尿病小鼠的chao 1指数和shannon指数高于D组,Y 组chao 1 指数高于D 组,L 组shannon 指数高于D组(均P<0.05);各运动组chao 1指数比较无明显差异(P>0.05),K 组与L 组shannon 指数比较无明显差异(P>0.05),见图3。
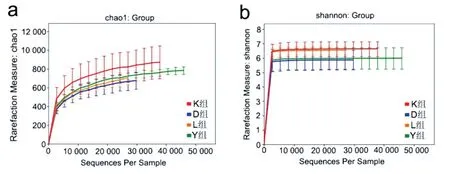
图3 各组小鼠肠道菌群Alpha多样性比较
2.4 不同运动方式对小鼠门水平上肠道菌群结构的影响 在门水平上,K 组、Y 组、L 组、D 组小鼠的优势菌分别为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria),约占97%~98%。K 组、Y 组、L组小鼠肠道放线菌门相对丰度分别为1.18(0.80~1.20)、0.39(0.24~0.75)、0.57(0.43~0.71),均高于D 组的0.36(0.22~0.61)(均P<0.05),Y 组小鼠变形菌门的相对丰度[4.39(2.88~5.85)]低于D 组[9.36(7.38~13.22)](P<0.05),见图4。
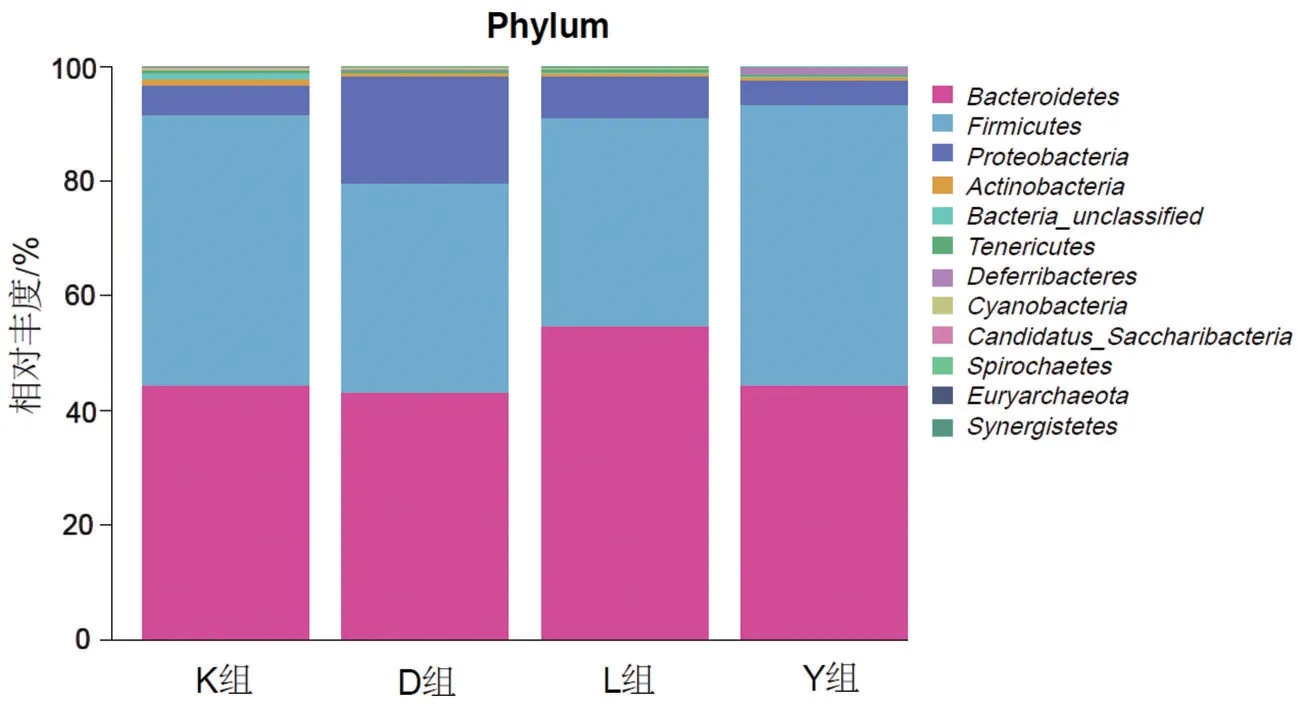
图4 不同运动方式对小鼠菌群门水平结构的影响
2.5 不同运动方式下小鼠属水平上肠道菌群前20种菌属热图分析 经过8周的抗阻运动干预后,2 型糖尿病小鼠产SCFA 细菌罗氏菌属(Roseburia)和瘤胃球菌属(Ruminococcus)相对丰度升高,见图5。

图5 不同运动方式干预对小鼠菌群属水平的影响
2.6 不同运动方式对2型糖尿病小鼠粪便SCFA的影响 K 组和L 组粪便乙酸含量高于D 组和Y 组,K 组粪便丙酸含量高于D 组、Y 组、L 组(P<0.05);各运动组粪便丁酸含量均高于D 组(均P<0.05),见表1。
表1 各组粪便中SCFA含量比较ng/mg,±s
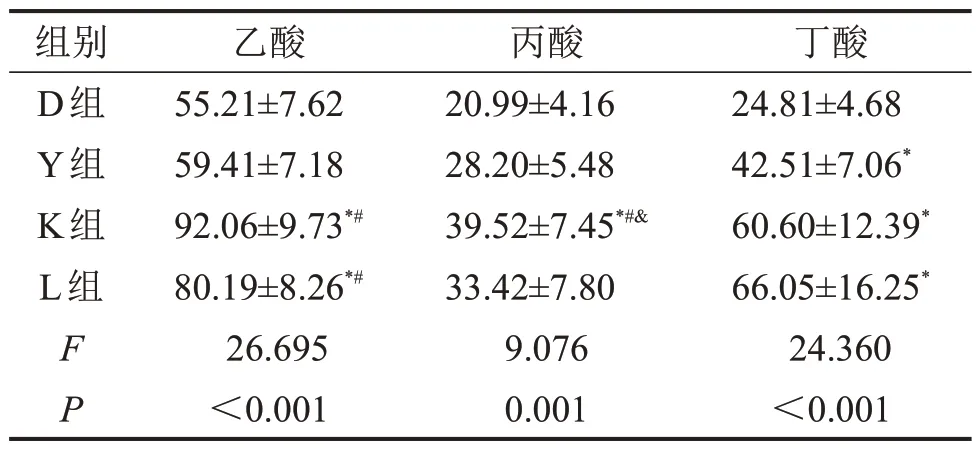
表1 各组粪便中SCFA含量比较ng/mg,±s
与D 组比较,*P<0.05;与Y 组比较,#P<0.05;与L 组比较,&P<0.05。
2.7 不同运动方式对小鼠血清SCFA 含量的影响K组、L组血清丁酸含量均高于D组(P<0.05),但L组与K血清丁酸含量比较,差异无统计学意义(P>0.05);各组间血清乙酸、丙酸含量比较,差异均无统计学意义(均P>0.05),见表2。
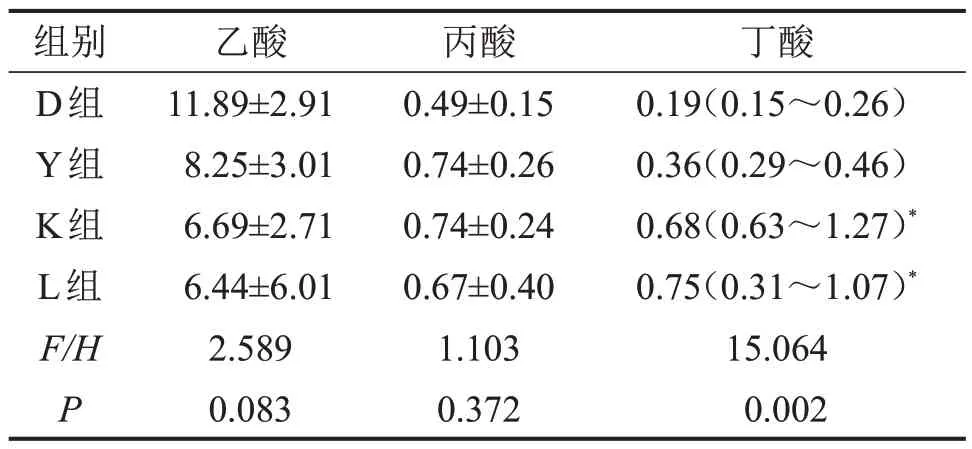
表2 各组血清中SCFA含量比较ng/μL
3 讨论
运动可改善患者的糖脂代谢和胰岛素抵抗[9]。有研究对26例糖尿病患者进行为期12周弹力带抗阻运动,结果显示运动能明显改善患者的糖化血红蛋白、空腹、餐后血糖等指标[10]。另有研究报道,联合运动比单纯有氧运动更能显著改善患者的血糖水平,提高生活质量[11]。本研究发现,3种运动均可改善2 型糖尿病小鼠血糖水平,但3 种运动方式在改善血糖水平上的效果无明显差异,可能与运动的时间、强度及频率不同有关。
徐山茸等[12]发现,运动干预后在校大学生OTU数目增加,提示运动可以提高物种丰富度。本研究发现,各运动组小鼠特有菌种OTU 数量均增加,说明3 种运动方式均可有效提高菌群种类。2 型糖尿病患者肠道菌群Alpha 多样性降低,肠道菌群多样性对2 型糖尿病的影响主要通过介导肠道菌群代谢[13]。本研究中,运动干预后的小鼠肠道菌群多样性提高,这与Kern等[14]的运动训练能提升肠道菌群多样性的结果相一致,提示运动能提高肠道菌群的多样性。
厚壁菌门、拟杆菌门、变形菌门和放线菌门为肠道优势菌,占总菌群的98%以上[15]。本研究结果显示,4组小鼠的优势菌均分别为厚壁菌门、拟杆菌门、变形菌门、放线菌门,说明运动不会对肠道菌群的主要优势菌的大结构有明显影响。但是经过运动干预后,各运动组小鼠肠道放线菌门的相对丰度均上升,有氧运动还降低小鼠变形菌门的相对丰度。此外,抗阻运动显著提高罗氏菌属和瘤胃球菌属的相对丰度,罗氏菌属是产丁酸盐细菌[16]。有研究报道,运动改善了糖尿病前期患者葡萄糖稳态及胰岛素敏感性,该作用与肠道菌群的改变密切相关[17]。本研究结果亦证实,各运动组糖尿病小鼠在肠道菌群结构得到改善的同时,血糖水平也得到显著改善,提示运动改善血糖的可能途径是影响肠道菌群的组成和结构。
研究证实,SCFA 通过减少热量摄入、降低血糖、改善胰岛素抵抗和炎症反应、增加胰高血糖素样肽-1分泌来改善2型糖尿病[18]。运动会影响人体肠道菌群的组成及代谢,Matsumoto 等[19]最早报道了运动会改变盲肠的微生物组成,并且提高小鼠盲肠中正丁酸盐浓度。本研究发现,3种运动可提高2型糖尿病小鼠体内SCFA 的含量,其中抗阻运动及联合运动在提高SCFA 水平上的效果优于有氧运动。
综上所述,有氧运动、抗阻运动以及联合有氧—抗阻运动均可改善2 型糖尿病小鼠的血糖水平,运动可调节肠道菌群的组成和结构,影响SCFA 的水平,运动改善血糖的另一个可能途径是通过影响肠道菌群的组成、结构及代谢。
