TERT沉默对OGD/R诱导的大鼠体外星形胶质细胞损伤的影响及机制*
2022-05-29谢晓云黄海萍梁程伟傅金凤王辞岚刘竞丽
谢晓云,吴 双,黄海萍,梁程伟,傅金凤,王辞岚,刘竞丽
(广西医科大学第一附属医院神经内科,南宁 530021)
缺血性脑卒中是由于血管狭窄或闭塞而引起脑组织损伤的重大疾病之一,可导致局灶性神经功能障碍甚至是死亡[1]。星形胶质细胞作为大脑中最丰富的细胞类型,在代谢支持、调节神经递质、维持血脑屏障以及促进神经发生等方面发挥至关重要的作用[2-4]。研究显示,脑缺血后,活化的星形胶质细胞可通过多种途径或机制发挥内源性神经保护作用,包括转化为神经元[5]、吞噬作用[6]及缺血耐受[7],使其成为近些年缺血性脑卒中研究的热点。因此,脑缺血后减少星形胶质细胞的损伤对于神经元保护具有重要意义。
端粒酶逆转录酶(telomerase reverse transcriptase,TERT)是端粒酶催化的功能部位,是端粒酶活性的关键调控因子和限速决定因素。长期以来,对TERT 的研究主要集中在其维持端粒长度。然而,近年来也发现TERT 具有非端粒依赖性功能。TERT参与调控细胞的增殖、凋亡及血管生成,与炎症、氧化应激和肿瘤代谢等过程紧密相关[8-10]。体内外研究发现,TERT 对脑缺血/再灌注(ischemia/reperfusion,I/R)损伤所致神经元凋亡具有保护作用[11-12]。课题组前期研究也证实,小脑顶核电刺激可促进TERT的表达,并且TERT能够保护神经元免受脑缺血再灌注诱导的氧化应激损伤[13]。但目前其对脑缺血后星形胶质细胞的作用及机制尚未阐明。因此,本研究建立TERT 基因沉默的原代大鼠脑皮层星形胶质细胞模型,通过OGD/R来模拟体内脑I/R 损伤过程,探讨沉默TERT 对OGD/R 诱导的大鼠体外星形胶质细胞凋亡的影响及其作用机制。
1 材料与方法
1.1 主要仪器和试剂 倒置荧光显微镜(日本Olympus 公司);DMEM/F12培养基、DMEM无糖培养基、胎牛血清及胰蛋白酶均购买于美国Gibco 公司;转染试剂Lipofectamine™RNAiMAX Transfection Reagent(货号:13778030)及TERT SiRNA 购自于美国赛默飞公司;100×青链霉素、CCK-8 试剂盒购自碧云天生物公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自大连美仑公司。TERT 抗体、Bcl-2及Bax抗体购买于美国novus公司,P53抗体、GFAP抗体购自英国Abcam。
1.2 原代星形胶质细胞培养及OGD/R模型的制备
选择出生48 h内的SD乳鼠,不分雌雄,订购于广西医科大学实验动物中心。用75%乙醇消毒乳鼠3 min,断头取脑后分离出大脑皮层,剥离脑膜和血管,剪碎后0.25%胰蛋白酶消化15 min,过滤、离心、吹打,以合适的密度铺板于多聚赖氨酸包被过的培养瓶中,每2~3 d换液。培养过程中使用差速贴壁、恒温摇床法来纯化星形胶质细胞。使用培养至第三代的细胞,将原先的培养液(89%DMEM/F12+10%FBS+1%青链霉素)更换为DMEM 无糖培养基并置于缺氧小室内,5%O2、95%N2的条件下培养6 h,后将DMEM 无糖培养基更换回原先的完全培养基。继续培养24 h后收集细胞。
1.3 星形胶质细胞转染及分组 参照Lipofectamine™RNAiMAX Transfection Reagent 转染的说明将干扰TERT 表达的SiRNA 转染星形胶质细胞。以每孔2×105个细胞数接种于6孔板中,待细胞融合至60%~80%时进行转染,分别制备阴性对照及siRNA TERT 与Lipofectamine™RNAiMAX Transfection Reagent 复合物,将上述复合物滴加到6 孔板的对应孔中,培养48 h后收集细胞。
将细胞随机分为4 组,即正常生长的星形胶质细胞(Control 组)、糖氧剥夺6 h/复糖复氧24 h(OGD/R 组)、OGD/R+转染siRNA 阴性对照(OGD/R+Si-Con 组)及OGD/R+干扰TERT 表达的SiRNA(OGD/R+Si-TERT组)。
1.4 细胞免疫荧光 制备无菌细胞爬片并将其置于24 孔板中,同时予多聚赖氨酸包被玻片过夜,然后将细胞接种至24孔板中,密度为3×104个/孔至6×104个/孔,星形胶质细胞经相应处理后予固定、通透、封闭、孵育一抗(GFAP 1∶150、TERT 1∶100)、孵荧光二抗(1∶200)及用含DAPI 的抗荧光猝灭封片剂封片,最后在荧光显微镜下观察并采集图像。通过Image J 软件来测定各组双标阳性细胞的荧光强度。
1.5 CCK-8检测细胞活力 以每孔8×103个细胞接种至96 孔培养板,每孔的细胞液的体积为100 μL,每组设置5个平行孔。然后按上述的分组进行干预后每孔分别加入10 μL CCK-8 溶液,并于细胞培养箱中继续孵育2 h。最后通过酶标仪测定各孔吸光度值并统计结果。
1.6 Western blotting(WB)检测P53、Bcl-2及Bax蛋白的表达 用PBS清洗细胞,加入适量含蛋白酶抑制剂的RIPA 裂解液,冰上裂解后12 000 r/min 离心10 min,收集沉淀上清即为细胞总蛋白质。BCA 法检测蛋白质浓度。SDS-PAGE 电泳使蛋白分离。250 mA 90-150 min(根据分子量大小)将蛋白转移到PVDF 膜上,5%脱脂奶粉封闭60 min。根据marker 裁剪目的蛋白条带。将其与相应的一抗放在抗体孵育盒中,4 ℃过夜。实验中使用的抗体有抗TERT 抗体(1∶500),抗P53 抗体(1∶1 000),抗Bcl-2 抗体(1∶1 000)和抗Bax 抗体(1∶1 000)。4 ℃孵育过夜后,TBST洗膜后使用相应的二抗(1∶10 000)室温孵60 min,之后洗膜并通过ECL 法显色,内参蛋白为GAPDH,Image J 软件对条带灰度值进行分析。
1.7 星形胶质细胞凋亡测定 收集各组细胞,离心后将细胞重悬于500 μL 缓冲液中,吸取其中的100 μL 至新的EP 管中,随后加入Annexin V-FITC溶液和PI 溶液各5 μL,混匀,室温下避光孵15 min。染色孵育后涂片,荧光显微镜下观察。
1.8 统计学方法 采用SPSS 26.0统计软件对数据进行分析。计量资料用均数±标准差(±s)表示,多组间均数的比较用单因素方差分析,两组间的比较运用独立样本t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 皮层星形胶质细胞GFAP 鉴定 免疫荧光检测星形胶质细胞标志物GFAP 蛋白的表达情况,见图1。GFAP 主要表达在细胞质,细胞形态较为完整,状态良好,可用于后续的实验要求。
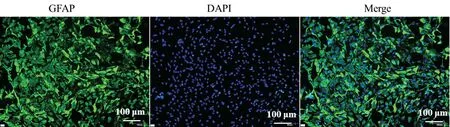
图1 免疫荧光检测SD大鼠皮层星形胶质细胞GFAP蛋白的表达及定位
2.2 OGD/R 后星形胶质细胞中TERT 荧光定位及表达变化 免疫荧光结果显示,TERT 在星形胶质细胞的细胞质和细胞核中均有表达,以细胞核为主,细胞质表达较少;与Control 组相比,OGD/R 组星形胶质细胞中TERT的表达増加,且TERT在细胞核及细胞质中的表达均升高(t=6.69,P<0.05),见图2。
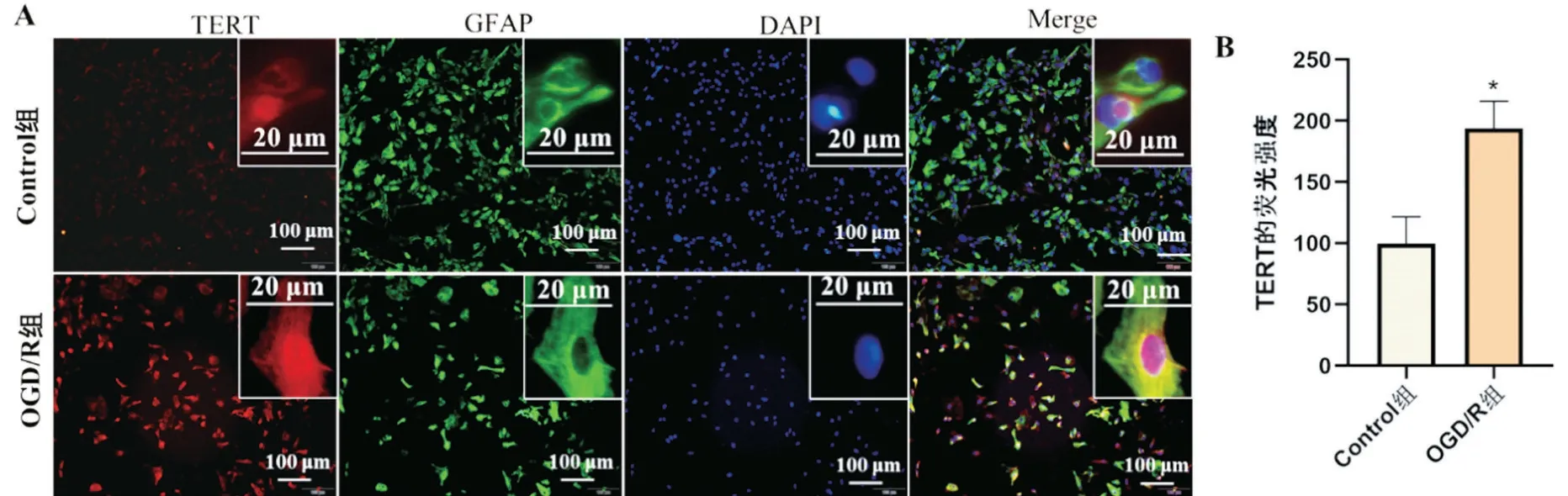
图2 星形胶质细胞中TERT荧光的表达变化及细胞定位
2.3 TERT蛋白在星形胶质细胞中的表达水平
与Control组比较,TERT蛋白在OGD/R组表达增加(P<0.05);将TERT-siRNA 转染星形胶质细胞,WB 检测转染后4 组TERT 蛋白表达水平比较,差异均有统计学意义(均P<0.05);与OGD/R+Si-Con 组比较,OGD/R+Si-TERT 组TERT 蛋白表达低于OGD/R+Si-Con 组(P<0.05),表明使用siRNA 敲低星形胶质细胞TERT成功,见图3。
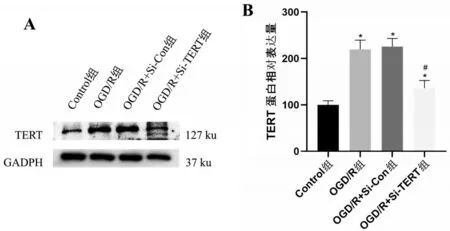
图3 WB检测TERT蛋白在星形胶质细胞中的表达
2.4 抑制TERT表达对星形胶质细胞活力的影响
CCK-8 结果显示,与Control 组相比,OGD/R组、OGD/R+Si-Con组及OGD/R+Si-TERT组细胞活力明显下降(P<0.05);与OGD/R+Si-Con 组比较,OGD/R+Si-TERT 组的细胞活力明显下降(P<0.05),表明在大鼠星形胶质细胞缺糖缺氧后,沉默TERT可使细胞相对活力明显下降,加重细胞损伤,见图4。
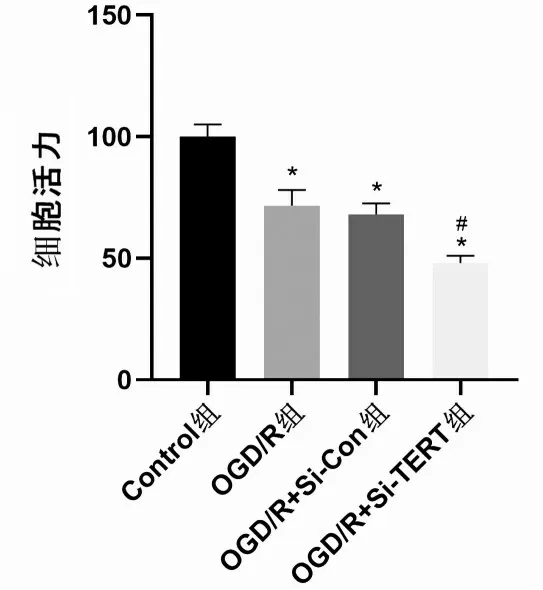
图4 星形胶质细胞在OGD/R 后沉默TERT 对细胞活力的影响
2.5 抑制TERT表达对星形胶质细胞凋亡的影响
Annexin V-FITC/PI染色结果显示,仅被绿色荧光染色的为凋亡前期细胞,而同时被绿色和红色双染的是凋亡晚期或坏死细胞。与Control 组相比,OGD/R组、OGD/R+Si-Con组及OGD/R+Si-TERT组细胞凋亡明显增加(P<0.05);与OGD/R+Si-Con 组比较,OGD/R 组细胞凋亡无统计学差异(P>0.05),而OGD/R+Si-TERT组细胞凋亡明显增加(P<0.05),见图5。
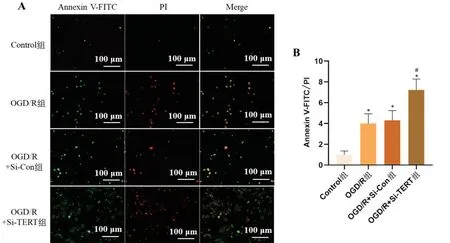
图5 Annexin V-FITC/PI荧光染色检测星形胶质细胞凋亡
2.6 TERT 沉默对OGD/R 后星形胶质细胞P53、Bax及Bcl-2蛋白的影响 为了进一步研究TERT调节OGD/R 后星形胶质细胞凋亡的机制,对P53/Bcl-2/Bax 凋亡通路进行WB 检测,结果显示,星形胶质细胞OGD/R 后Bax、P53 蛋白表达较Control 组升高,Bcl-2蛋白降低(均P<0.05);与OGD/R组比较,OGD/R+Si-Con组星形胶质细胞的P53、Bax及Bcl-2蛋白相对表达量差异无统计学意义(P>0.05);与OGD/R+Si-Con组比较,OGD/R+Si-TERT组星形胶质细胞的P53、Bax蛋白相对表达量增加,Bcl-2蛋白表达降低(均P<0.05)。由此可知,星形胶质细胞缺氧后P53、Bax 的表达增高,Bcl-2 表达降低,下调TERT 后P53、Bax 的表达增高和Bcl-2 表达降低更为明显,见图6和图7。
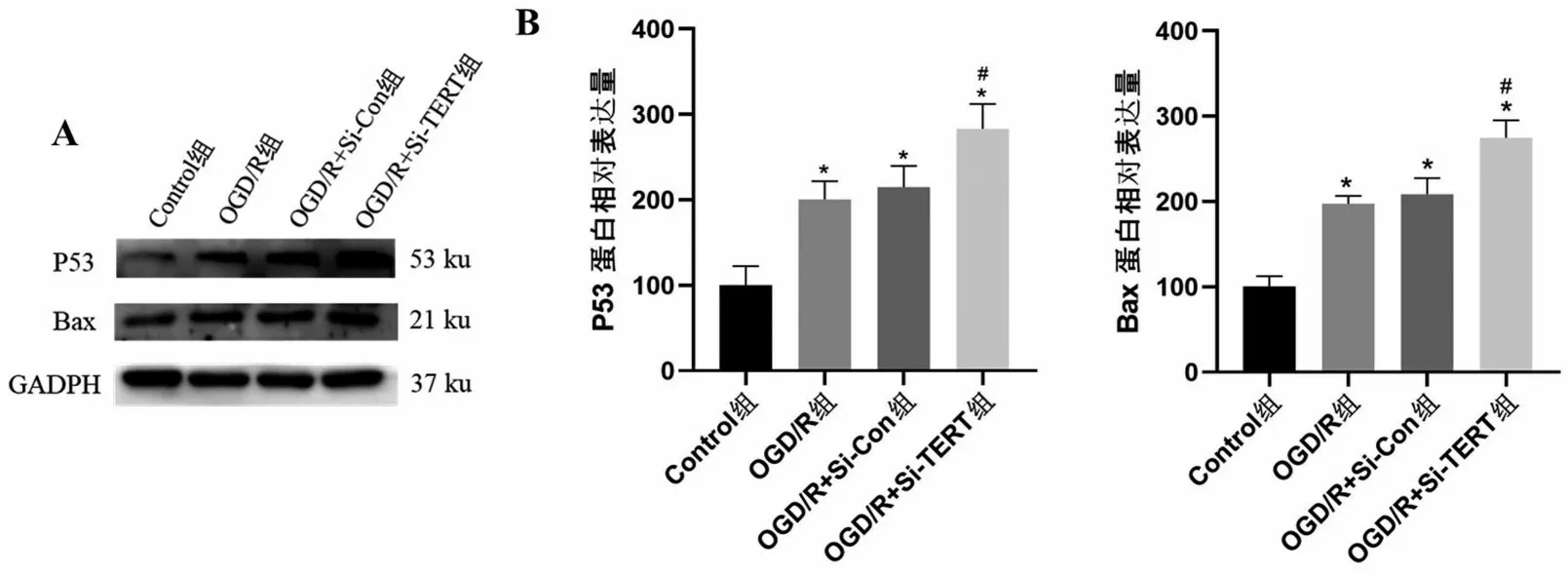
图6 TERT沉默增加OGD/R诱导的星形胶质细胞P53、Bax蛋白表达
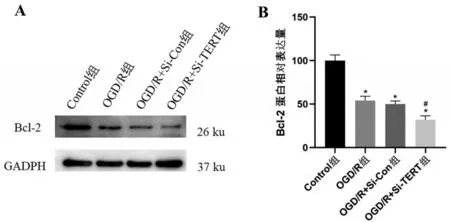
图7 TERT沉默减少OGD/R 诱导的星形胶质细胞Bcl-2蛋白表达
3 讨论
脑缺血及再灌注损伤涉及一系列复杂的病理过程,包括氧化应激、钙离子超载、兴奋性毒性、炎症反应和细胞凋亡等。其中,神经细胞凋亡在I/R再灌注损伤机制的研究过程中发挥关键作用。课题组前期研究发现,在大鼠脑I/R模型中,小脑顶核电刺激可促进脑组织TERT的表达,增加的TERT对缺血神经元具有保护作用[13]。过去的研究也显示,在啮齿类动物及其原代神经元缺血缺氧模型中TERT的表达升高,并且TERT具有促进缺血神经元存活的作用[12,14]。然而,TERT对脑缺血后星形胶质细胞损伤的影响及作用机制未见报道。
因此,在课题组前期研究的基础上,本研究建立OGD/R 大鼠星形胶质细胞模型,模拟体内脑I/R损伤后星形胶质细胞的病理过程,发现TERT 蛋白在大鼠脑皮层星形胶质细胞OGD/R 模型中表达明显升高,提示TERT蛋白可能在星形胶质细胞OGD/R损伤的病理过程中发挥关键作用。免疫荧光结果表明,星形胶质细胞OGD/R后,TERT蛋白在胞核及细胞质中的表达均明显增加。这与既往Wu等[15]发现TERT 不仅表达于细胞核中,其在细胞质也有表达的结果基本一致。
既往研究表明,TERT在I/R的过程中能够抑制不同组织细胞的凋亡。研究显示,在急性心肌I/R模型中,过表达线粒体TERT对小鼠心肌细胞、成纤维细胞和内皮细胞凋亡具有保护作用[16]。Zhao等[12]在新生大鼠缺氧缺血模型中发现TERT可能通过抑制caspase-3的激活而发挥抗凋亡作用。同样,我们的前期研究也发现大鼠脑I/R损伤后小脑顶核电刺激可促进TERT 的表达,并且通过阻止Bax 蛋白由细胞质转位到线粒体膜而抑制线粒体细胞凋亡途径[13,17]。因此,为了进一步明确TERT 对OGD/R 后星形胶质细胞凋亡的影响及机制,本研究采用TERT siRNA 沉默TERT 的表达,发现TERT 沉默可明显增加OGD/R 诱导的星形胶质细胞凋亡及凋亡相关蛋白P53、Bax 的表达,减少细胞活力及凋亡相关蛋白Bcl-2的表达,提示在OGD/R过程中,星形胶质细胞TERT的表达增加是抑制细胞损伤和凋亡的重要原因之一。
在凋亡发生时,Bcl-2家族成员Bcl-2/Bax和P53蛋白发挥了重要的作用。其中Bcl-2在细胞凋亡过程中具有抗凋亡作用,而Bax 及P53 则具有促凋亡作用[18-29]。研究证实P53通过与Bcl-2/Bax相互作用而介导内源性凋亡途径,维持线粒体功能[20-21]。稳定Bcl-2/Bax的比例可以抑制OGD/R诱导的星形胶质细胞凋亡。P53 蛋白是体内重要的转录因子,其与细胞凋亡和DNA 损伤修复紧密相关。本研究WB结果表明,与Control组比较,OGD/R组Bcl-2蛋白表达降低,P53 及Bax 蛋白表达升高;TERT 基因沉默促使OGD/R 后星形胶质细胞内的P53、Bax 蛋白进一步升高,而Bcl-2 蛋白进一步降低。从该研究结果可以推测TERT参与星形胶质细胞的凋亡途径,TERT 沉默加重OGD/R 大鼠皮层星形胶质细胞的损伤,其机制可能是通过调控P53/Bcl-2/Bax信号通路上的蛋白表达影响细胞活力和凋亡等方式而实现的。
综上所述,TERT 在大鼠皮层星形胶质细胞OGD/R 处理后表达增加,抑制TERT 表达能促进星形胶质细胞损伤及凋亡,其机制可能与激活P53/Bcl-2/Bax信号通路有关。
