曲美他嗪对大鼠骨关节炎炎症反应和软骨基质降解的作用研究*
2022-05-29胡紫薇蓝逆寒
胡紫薇,茹 晓,蓝逆寒,高 明,郑 立Δ
(广西医科大学 1.广西组织器官修复医用生物材料工程技术研究中心;2.药学院;3.再生医学与医用生物资源开发应用省部共建协同创新中心,南宁 530021)
骨关节炎(osteoarthritis,OA)是一种慢性关节疾病,病程发展缓慢,常导致关节软骨退化[1]。软骨细胞外基质(ECM)主要由蛋白聚糖(GAG)和胶原蛋白组成,OA 的病因主要是ECM 的破坏和软骨稳态平衡破坏[2]。研究报道,基质降解酶包括金属蛋白酶,其中基质金属蛋白酶-3(MMP-3)、基质金属蛋白酶-13(MMP-13)与ECM 的分解代谢相关[3]。ECM 降解是导致OA 进展的关键[4]。目前,临床上治疗OA 的主要方式是手术和药物治疗,药物治疗是目前应用最广泛的治疗策略,常使用的药物包括非甾体抗炎药、乙酰氨基酚和阿片类镇痛药[5]。然而,长期使用非甾体抗炎药会导致消化道溃疡和胃肠出血等副作用[6]。因此,寻找一种既安全又能抗炎的药物用于延缓OA的进展很有必要。
曲美他嗪是一种保护心脏的药物,主要治疗心绞痛、左心室功能障碍和心血管重建[7]。此外,曲美他嗪具有抗炎抗氧化的作用,可以通过降低氧化应激、细胞凋亡和炎症反应来预防左心室重构和减少冠状动脉支架植入患者的急性炎症反应[8-9];并且可以通过改善心肌梗死区域的微环境,通过保护缺氧细胞对抗氧化应激,从而改善心肌梗死和终末期心力衰竭的治疗[10]。然而,曲美他嗪对OA 是否具有抗炎作用鲜少报道。本研究旨在探讨曲美他嗪对OA的影响,为探讨其可是否可作为OA治疗的潜在药物提供实验依据。
1 材料与方法
1.1 材料
1.1.1 试剂 曲美他嗪(纯度≥97%)(麦克林,中国);DMEM 高糖培养基(gibico,中国),0.25%胰蛋白酶,胎牛血清(四季青,中国);细胞计数试剂(cell counting kit-8,CCK-8)(Biosharp,中国);钙黄绿素/碘化丙啶(calcein acetoxymethyl ester/propidium iodide,Calcein-AM/PI)染色试剂(碧云天,中国);逆转录试剂盒(Takara,日本);引物(生工,中国);白细胞介素(IL-1β),100×青链霉素,CCK-8试剂,苏木精—伊红(HE)试剂盒,改良型番红O-固绿试剂盒(Solarbio,中国);总RNA提取试剂盒(Magen,中国)。1.1.2 实验动物 18 只雄性SD 大鼠(8 周龄)和8 只3~5 d SD 乳鼠购于广西医科大学实验动物中心,许可证号:202012013。所有雄性SD 大鼠饲养于SPF 级的环境中,温度24~26 ℃,12 h 光照,12 h黑暗处理,所有大鼠自由饮水摄食。
1.1.3 仪器与设备 细胞恒温培养箱(Forma,美国);梯度PCR 仪,荧光酶标仪,超净工作台(Thermo Fisher Scientific,美国);正置荧光显微镜(Olympus,日本);实时荧光定量PCR 仪(Roche,瑞士);1 000 转离心机(Eppendorf,德国);超纯水机(Merck,德国)。
1.2 软骨细胞提取与培养
取3~5 d 龄的SD 乳鼠,颈椎脱臼法处死,在75%酒精消毒,剔除多余的肌肉组织,在无菌条件下切取膝关节软骨,剪成1 mm的软骨碎片,置于胰蛋白酶中消化30 min,离心并弃去含有胰蛋白酶上清液,用无菌的PBS 轻轻吹洗3 次,弃去上清液,使用二型胶原酶消化8 h 过夜。取上清液离心1 000 r/min,5 min,分离出软骨细胞,与DMEM高糖培养基混合均匀,接种在10 mm 培养皿中,在37.4 ℃、5%CO2,95%湿度中培养。
1.3 CCK-8检测软骨细胞增殖率
使用CCK-8 试剂盒评估曲美他嗪对软骨细胞的毒性作用。软骨细胞传代至2~3 代,细胞生长融合达到85%时,弃去废弃的培养基,用PBS 冲洗细胞1 次再加入胰蛋白酶消化后置于96 细胞培养孔板中,细胞浓度为5×103个/孔,将其放置于恒温培养箱培养24 h,待细胞充分贴壁后,弃去旧的培养基,加入完全培养基,各浓度组分别加入含有10 ng/mL的IL-1β 和对应浓度的曲美他嗪(0.012 5 mg/mL、0.025 mg/mL、0.05 mg/mL、0.1 mg/mL、0.2 mg/mL)的完全培养基各100 μL,对照组为不添加曲美他嗪等体积的培养基,实验重复3次。加样完成后,将孔板放置于37.4 ℃条件下24 h。培养结束后,每孔加入10 μL 的CCK-8 检测试剂,孵育4 h,在波长为450 nm的条件下检测吸光度。
1.4 实验分组和干预
将软骨细胞按照完全随机设计的分组方法分为对照组、模型组和实验组。对照组加入单纯培养基培养,模型组加入含有10 μg/mL IL-1β 培养基培养,实验组加入含有10 μg/mL IL-1β+0.1 mg/mL 曲美他嗪的培养基培养。在超净台中将1.5 mm 的玻璃爬片用75%酒精消毒后置于6 孔细胞培养板中,将软骨细胞重悬液接种到6孔板中培养24 h后分别加入相应的培养基,复孔为3个,培养24 h后收样。
1.5 Calcein-AM/PI 染色检测软骨细胞活力
将第3 代软骨细胞混悬液置于6 孔板中,混悬液的细胞密度为2.5×105个/孔,待细胞融合达85%,各组加入对应药物,在37.4 ℃条件下培养24 h,PBS清洗爬片3 次,加入含有2 μL 碘化吡啶和0.5 μL 的PBS 溶液,室温避光染色5 min,然后使用正置荧光显微镜显微镜观察荧光并获取图像,实验重复3次。红色荧光代表死细胞,绿色荧光代表活细胞,用Image J软件进行量化分析。
1.6 实时荧光定量PCR(RT-qPCR)检测炎症基因和软骨特异性基因的表达
使用Magen试剂盒提取软骨细胞RNA,反转录得到cDNA。使用实时荧光定量PCR仪进行聚合酶链式反应,反应条件为95 ℃,10 min;95 ℃,15 s;60 ℃,1 min,进行55 个循环,实验重复3 次。用2-ΔΔCT的方法计算GAPDH、白介素-6(IL-6)、环氧酶-2(COX-2)、肿瘤坏死因子-α(TNF-α)、MMP-3、MMP-13、性别决定区域Y 相关的高迁移率族框9(SOX9)和蛋白聚糖(ACAN)基因表达相对量,引物序列见表1。
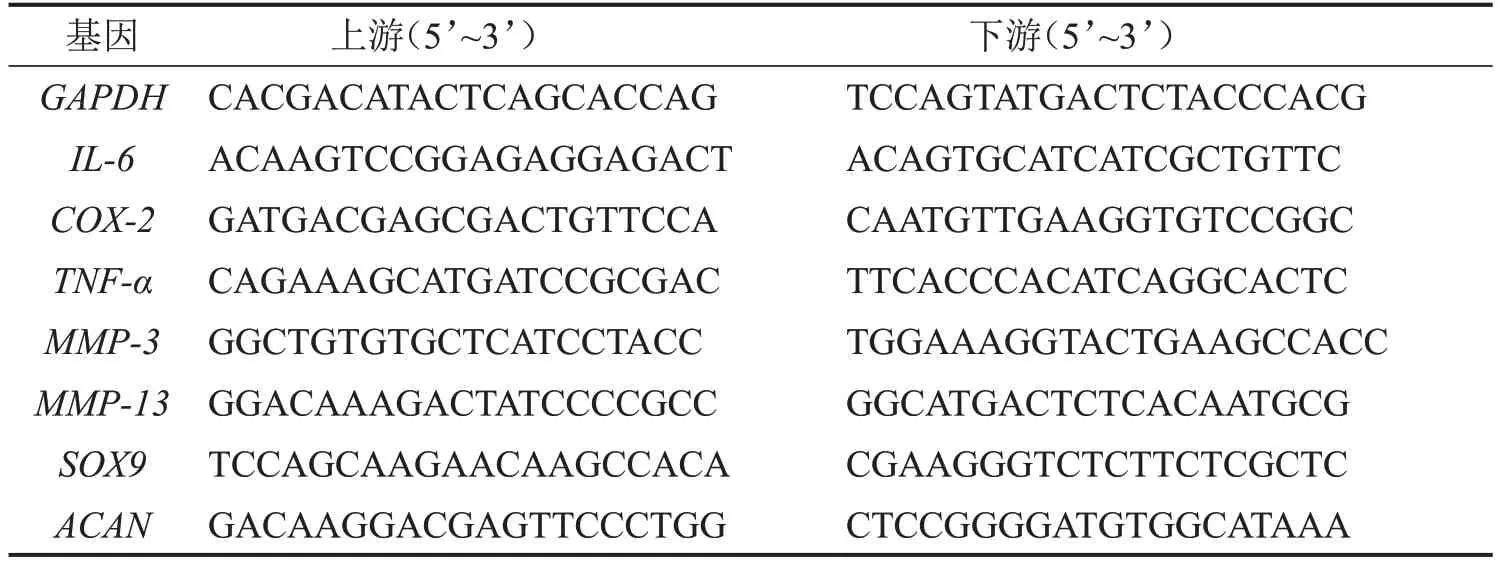
表1 RT-qPCR引物序列
1.7 OA模型建立
每只大鼠选取左侧膝关节,使用2%的戊巴比妥麻醉大鼠,膝关节剔除毛发碘伏消毒后从外侧切开并暴露关节囊,并将膝关节髌骨移向外侧,找到大鼠的前交叉韧带并用手术刀切断,再将髌骨复位,并将髌韧带与周围皮肤组织缝合,闭合关节腔,术后1 d每只大鼠注射20万U青霉素钠,连续注射1周预防感染。对照组不切开关节囊,其他操作同模型组。
1.8 动物实验分组和处理
曲美他嗪作工作液的浓度为0.1 mg/mL。将18只SD大鼠随机分为对照组、模型组和实验组(曲美他嗪0.1 mg/mL),每组6 只。避光条件下将曲美他嗪溶解于PBS,配制成0.1 mg/mL的溶液。术后4周,实验组的大鼠关节腔内注射100 μL 0.1 mg/mL曲美他嗪,模型组和对照组分别注射等量的0.9%NaCl溶液,每周注射1次,持续4周。
1.9 病理学观察曲美他嗪对SD大鼠关节软骨组织的影响
取下大鼠膝关节用4%多聚甲醛固定3 d,用pH 7.4 的EDTA 溶液将关节组织进行脱钙处理,脱钙4 周直到组织软化,再用石蜡包埋,切片厚度4 μm,分别用HE试剂盒和改良型番红O-固绿试剂盒对切片进行HE染色和番红O-固绿染色(红色为软骨组织,绿色为骨组织),根据Mankin评分系统[11]进行组织学评分,评分方法为:(1)软骨结构:正常0 分,表面不规则1 分,血管翳形成和表面不规则2分,裂隙进入过渡层3分,裂隙进入辐射层4分,裂隙进入钙化层5 分,结构完全被破坏5 分。(2)软骨细胞正常0分,弥漫性细胞增加1分,局部细胞增加2 分,细胞数量明显减少3 分。(3)软骨基质染色:正常0分,轻度减少1分,中度减少2分,重度减少3分。(4)潮线完整性:完整0分,被血管破坏1分。
1.10 统计学方法
采用SPSS 26.0 软件对所有数据进行统计学分析。计量资料以均数±标准差(±s)表示,多组间比较采用ANOVA 单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 曲美他嗪对软骨细胞的毒性作用
与0 mg/mL 比较,曲美他嗪浓度低于0.1 mg/mL 时,对软骨细胞无明显毒性(P>0.05),见图1。因此,选择曲美他嗪作工作液度为0.1 mg/mL。
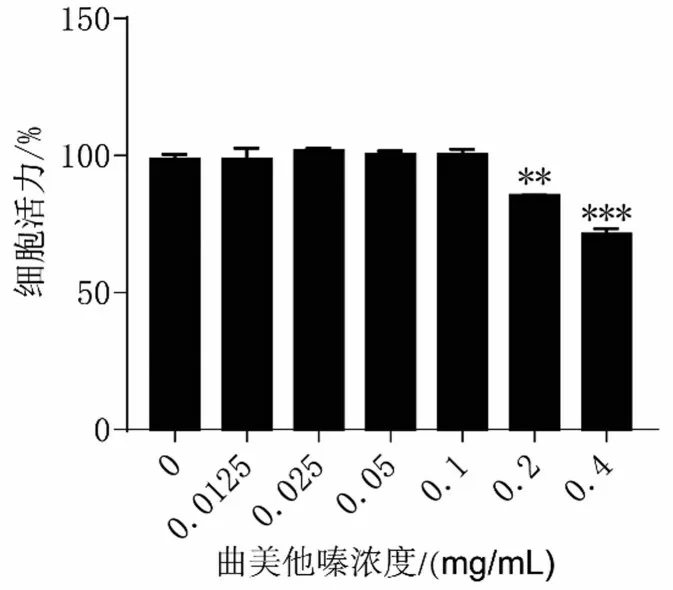
图1 CCK-8 检测不同浓度的曲美他嗪对软骨细胞的毒性作用
2.2 曲美他嗪对软骨细胞活力的作用
绿色荧光代表活细胞,红色荧光代表死细胞。与对照组比较,模型组的活细胞数量明显减少,死细胞数量明显增多,细胞活力降低(P<0.001),与模型组比较,实验组活细胞数量增加,死细胞数量减少,细胞活力提高(P<0.01),见图2。表明曲美他嗪具有促进软骨细胞增殖的作用。
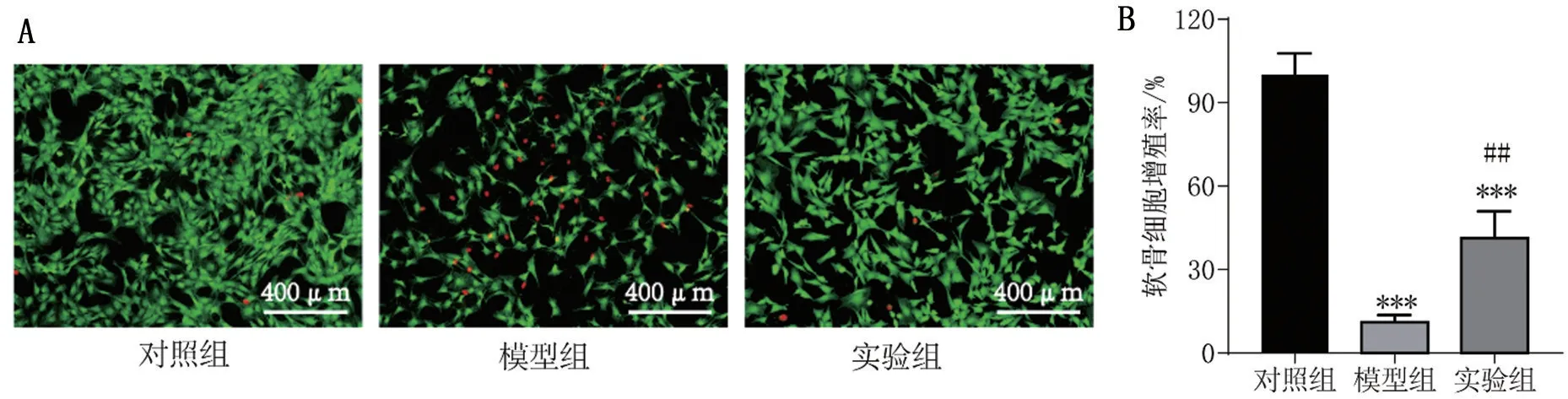
图2 Calcein-AM/PI染色检测细胞活力
2.3 曲美他嗪对软骨细胞炎症基因和成软骨基因表达的作用
与对照组相比,模型组的成软骨基因SOX9和ACAN相对表达量均降低(均P<0.05),炎症基因IL-6、MMP-3、MMP-13、Cox-2及TNF-α相对表达量均升高(均P<0.05)。与模型组比较,实验组的SOX9和ACAN相对表达量均升高(均P<0.05),IL-6、MMP-3、MMP-13、Cox-2及TNF-α表达均降低(均P<0.05),见图3。提示曲美他嗪可逆转体外OA模型的成软骨基因下调和高表达的炎症基因。
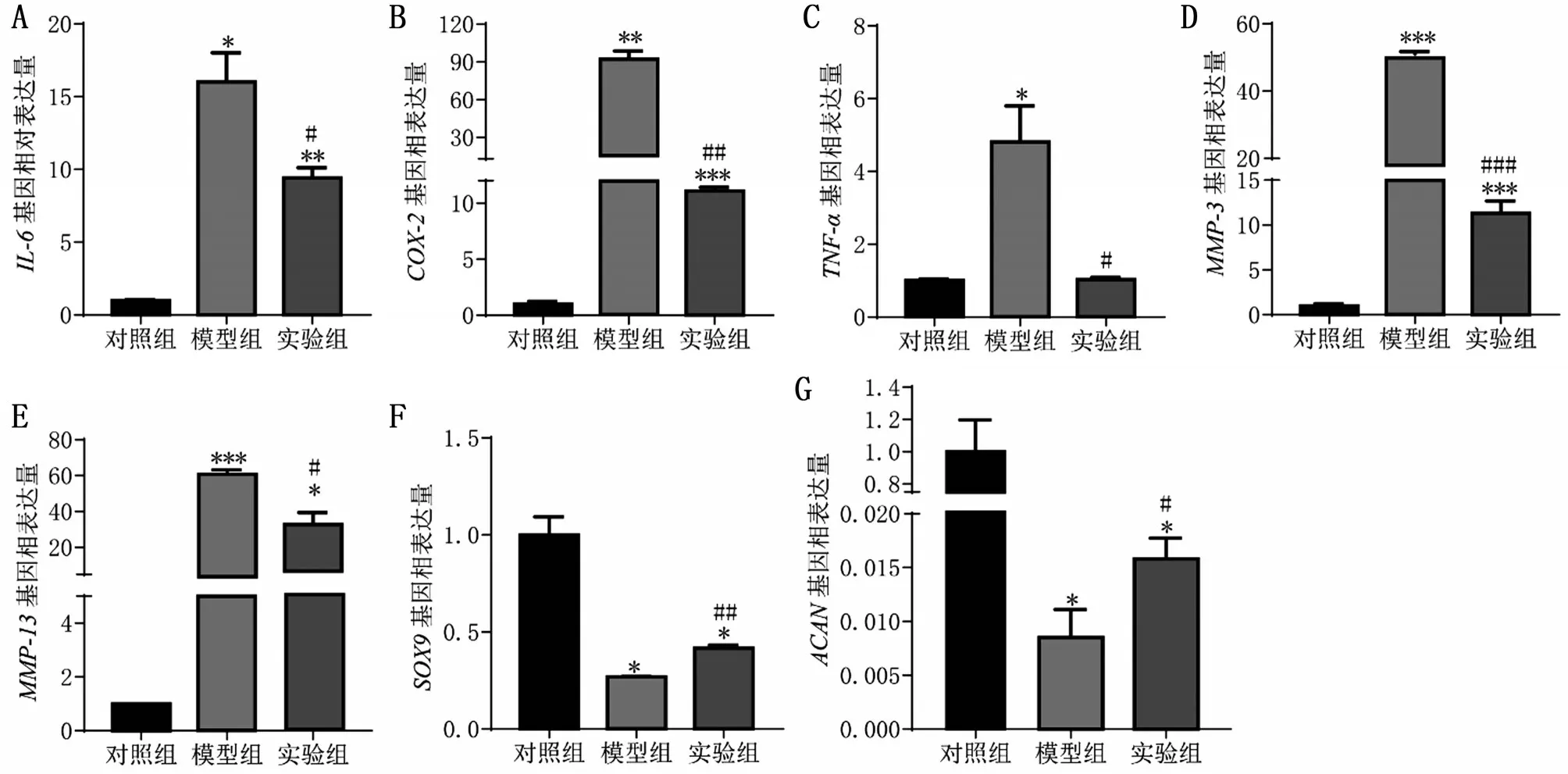
图3 炎症基因和成软骨相关基因的相对表达量
2.4 曲美他嗪对SD大鼠关节软骨组织病理学的影响
对照组的大鼠关节软骨表面完整,软骨细胞数量较多;模型组的大鼠关节软骨表面破坏严重,软骨细胞数量减少;相较于模型组,实验组软骨层的损伤与变形明显缓解。与对照组相比,模型组的组织学评分升高(P<0.001);与模型组相比,实验组的组织学评分降低(P<0.05),见图4。提示曲美他嗪缓解OA软骨基质的损伤。
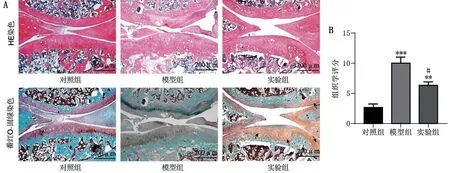
图4 曲美他嗪对SD大鼠关节软骨组织病理学的影响
3 讨论
OA 是普遍的关节慢性疾病,软骨退化是其主要的病理改变[12]。由IL-6 等炎症因子可诱导基质降解酶引起ECM 降解,软骨细胞凋亡,从而导致OA的进展[13]。曲美他嗪是一种哌嗪类药物,临床上用于治疗心肌缺血和心绞痛等心脏疾病,具有维持线粒体正常功能和抗氧化等作用,通过抗氧化机制下调TNF-α、BAX 和VEGF 等免疫因子表达来改善阿霉素诱导的心肌病[8,14]。此外,曲美他嗪通过Nrf2 激活减轻糖尿病炎症反应[15]。目前曲美他嗪剂型包括注射剂、片剂和凝胶剂等[16-18]。在临床中,关节腔内注射是一种常用的微创药理学治疗方法,有利于减轻疼痛和提升关节功能[19]。研究报道,常采用关节腔每周注射1 次的方式,连续治疗4 周以上并观察疗效[20],因此,本研究选用曲美他嗪注射剂进行关节腔注射给药,治疗4 周以观察曲美他嗪的作用效果。
CCK-8 实验显示,0.1 mg/mL 的曲美他嗪没有表现出细胞毒性,因此选择曲美他嗪作工作液浓度为0.1 mg/mL。Calcein-AM/PI 染色显示,曲美他嗪在0.1 mg/mL 浓度下促进软骨细胞的增殖和生长,维持细胞活性,抑制软骨细胞的凋亡。
炎症在OA关节病理中起着重要作用[21],是OA软骨退化病变的重要因素[22],这表明缓解炎症是OA治疗的策略。有文献报道,IL-6 与TNF-α 是导致OA 软骨基质损伤的主要炎症介质[23]。本研究结果表明,IL-1β诱导的软骨细胞炎症基因COX-2、TNFα和IL-6的表达升高,曲美他嗪可抑制IL-1β 诱导COX-2、TNF-α和IL-6的基因表达,表明其具有潜在的抗炎能力。
ECM 主要由蛋白聚糖和二型胶原组成,OA 中关节组织的破坏与关节ECM的降解有关[24]。因此,减少软骨外基质的降解对OA的治疗至关重要。蛋白聚糖和二型胶原是软骨形成和维持ECM 的分解代谢稳定并促进其合成的关键因素[25]。RT-qPCR结果显示,曲美他嗪能增加成软骨基因ACAN和SOX9的表达。在OA进展过程中,软骨细胞代谢变得活跃,产生金属基质降解酶,包括MMP-3、MMP-13,这是ECM 降解的主要因素[13]。本结果显示,曲美他嗪能够抑制MMP-3和MMP-13的基因表达,并缓解OA 大鼠软骨损伤,降低组织学评分。说明曲美他嗪可以抑制ECM 的代谢,维持ECM 的代谢平衡,起到保护软骨的作用。
综上所述,曲美他嗪可以抑制软骨炎症反应和软骨基质的降解,对OA具有潜在的治疗作用,然而曲美他嗪治疗OA的作用机制,仍需进一步研究。
