特殊竹林土壤细菌群落结构及多样性研究
2022-11-01苏建如彭艳江伟韦杰栾春光杨成邓文楷邓四情
苏建如, 彭艳*, 江伟, 韦杰, 栾春光, 杨成, 邓文楷, 邓四情
(1. 贵州民族大学生态环境工程学院, 贵阳 550025; 2.四川省宜宾竹海酒业有限公司, 宜宾 644304; 3.中国食品发酵工业研究院国家酒类品质与安全国际联合研究中心, 北京 100015)
土壤微生物是土壤物质循环的重要组成部分,极易受到外界环境影响,在林地生态系统中起着重要作用[1]。林地植被覆盖和植被类型对土壤微生物群落结构和多样性有重要影响[2],林地植物群落多样性关系到根际土壤提供微生物代谢的碳源种类的丰富度,决定着土壤微生物群落多样性[3]。竹林植被单一,研究发现其林下土壤细菌主要来自变形菌门(Proteobacteria)、放线菌门(Actinomycetes)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)[4-5],其中绿弯菌门是竹林土壤的特有优势菌[6]。对毛竹林的研究显示,竹林非根际土壤细菌数量低于其他林地植物[7-8],以酸杆菌门和变形菌门为主[9],主要包括嗜糖假单胞菌Zoogloea、Pelomonas、陶厄氏菌属Thauera、根瘤菌属Rhizobium等[10];而雷竹林则以绿弯菌门、酸杆菌门和变形菌门为主[11],即不同种类的竹林土壤细菌结构和多样性存在较大差异。
活竹酒是将基酒注入毛竹幼竹竹腔内自然生长三到五年所得,竹子活化了基酒中的甲醇、杂醇油等杂质,竹酒发酵过程中吸收了竹体中对人体有益的黄酮等元素,决定了竹腔内酒体的二次形成过程和酒体品质的高低[12]。基酒注入竹体、发酵和取酒等过程会导致基酒渗入林下土壤,改变林下土壤尤其是根际土壤环境,进而影响土壤细菌群落结构和多样性。利用竹林原位酿酒是一个很有商业价值的行为,目前鲜见对竹酒酿造区这种特殊环境中的竹林土壤细菌群落结构及其多样性的报道,因此,现围绕这种活动对竹酒酿造区这种特殊竹林环境中的土壤细菌群落的研究,既能丰富特殊环境或极端环境下土壤微生物分布数据资料,还能为竹酒企业酒体形成和发酵过程的质量控制提供环境数据支持。
1 材料和方法
1.1 采样区概况
采样区位于素有“天然氧吧”之称的“中国最美十大森林”、国家AAAA级风景区——四川宜宾长宁县蜀南竹海竹酒酿酒生态园。长宁县位于104°44′22″E~105°03′30″E,28°15′18″N~28°47′48″N,地势南高北低,南北长约60 km,东西宽30 km,海拔245.9~1 408.5 m,森林覆盖率62.8%,竹林是境内植物一大特色,竹类品种中以楠竹、慈竹、硬头黄竹、苦竹、斑竹为主产。长宁县属中亚热带湿润性季风气候,温暖湿润,雨热同季,年均气温18.3 ℃,年均降雨量1 141.7 mm,日照时数987.6 h,年无霜期357 d。竹酒酿酒生态园占地150亩(1亩=667 m2),园内有两万余棵竹,园区绿化率68%,其竹海酒传统酿造技艺在2018年获得“长宁县非物质文化遗产”称号,年产优质竹海酒超过6 000 t。
1.2 土壤样本
以竹酒工业园区竹酒竹林几何中心为核心,在竹林核心区(J1)、非竹林区(J2)和竹林边缘区(J3)选取生境因子基本一致的样点,以五点采样法采集距竹根50~60 cm的0~15 cm表层土壤,去除土壤中的石头、树根等杂物,充分混匀后装入无菌采样袋中,置于-85 ℃保存用于高通量测序。
1.3 高通量测序及生物学信息统计分析
1.3.1 土壤微生物宏基因组提取及检测
利用安倍 (MP)的土壤基因组DNA提取试剂盒(FastDNA®Spin Kit for Soil)提取土壤微生物元基因组,琼脂糖凝胶电泳检测元基因组完整性后,用微量核酸测量仪NanoDrop和Qbit对其DNA进行浓度测定,OD260/280=1.8,最后用1%琼脂糖凝胶电泳检测提取DNA的完整性。
1.3.2 构建元基因组文库
以细菌16S V4区(引物为515F和806R)正向、反向引物的聚合酶链式反应(forward 、reverse primer PCR)扩增得到的元基因组为模板,使用Thermofisher 公司的Ion Plus Fragment Library Kit 48 rxns 建库试剂盒构建高通量测序文库,不同样本通过反向引物的barcode加以区别。反应体系为50 μL,包括正反向引物各0.4 μmol/L,200 μmol/L的4种dNTP,1.5 mmol/L MgCl2,1U的Taq DNA聚合酶(Kapa biosystems,Boston,US)。反应条件为预变性95 ℃ 6 min,共22个循环:95 ℃ 1 min,52 ℃ 1 min,72 ℃ 1 min,72 ℃ 7 min。利用1.5%琼脂糖凝胶电泳检测PCR产物大小,并用QIAGEN MinElute®gel extraction kit (Cat.no. 28604, USA)回收试剂盒回收目的条带。对每个文库都进行了质量检测,包括NanoDrop ND1000 的浓度检测(Thermo Scientific, USA)和Real-time PCR(ABI 7300)的连接效率检测,在中国食品发酵工业研究院酿酒中心Thermofisher IonS5TMXL测序平台完成高通量测序。
2 结果与分析
2.1 稀疏曲线与OTUs数分析
由图1可知,本研究中的样本读长(reads)均达到6万条以上,测序样本物种数目(OTUs)达到平台期,测序数据能满足检测微生物多样性的要求。
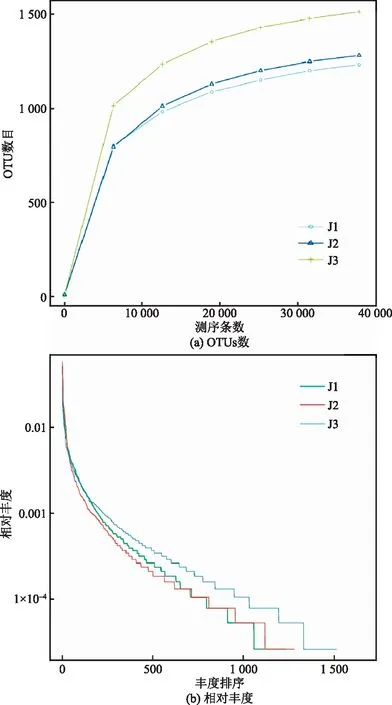
图1 样品OTUs数与种群相对丰度的稀疏曲线Fig.1 Sparse curve of sample OTUs and the relative population abundance
2.2 基于OTUs数的韦恩图分析
由图2可知,各样本的OTUs总数表现为竹林边缘区J3(1 514)>非竹林区J2(1 282)>竹林核心区J1(1 233),且J3独有OTUs数量(245)高于J2(162)、J1(153),说明不同生境的交汇地带土壤细菌基因总数和独有基因数最高;竹林边缘区J3与竹林核心区J1的共有OTUs数为64,但与非竹林区J2的共有OTUs数为253,这可能与竹林单一的生态环境有关,单一植物种类或会降低土壤细菌群落的群落多样性。
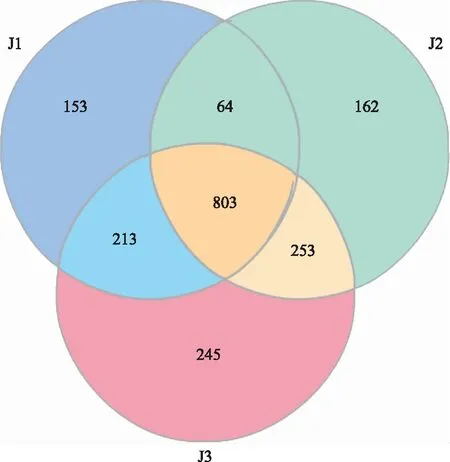
图2 基于OTUs的韦恩图Fig.2 Venn diagram based on OTUs
2.3 物种分布情况和进化树分析
2.3.1 门水平上的物种分布分析
门水平上的研究显示,采样区域土壤细菌OTUs丰度排行前10的微生物菌门主要来自酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatinonadetes)、疣微菌门(Verrucomicrobia)以及拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、厚壁菌门(Firmicuates)和己科河菌门(Rokubacteria)。在前6种优势菌门中,放线菌门在全部样品中总占比53.08%最高,其次是酸杆菌门18.57%和变形菌门10.39%,芽单胞菌门、绿弯菌门、疣微菌门总占比依次为7.38%、6.46%、4.12%。
为分析门水平上样本间优势物种的差异,选取平均丰度排名前10的物种生成了Ternaryplot三元相图。由图3可以看出,样本的优势种群主要是酸杆菌门、变形菌门、放线菌门次之、绿弯菌门的细菌等;放线菌门距竹林核心区J1更近,在J1中丰度较高;非竹林区J2中变形菌门、酸杆菌、绿弯菌门丰度较高;与J1、J2相比,竹林边缘区J3中绿弯菌门丰度较低,变形菌门丰度高于J1低于J2。
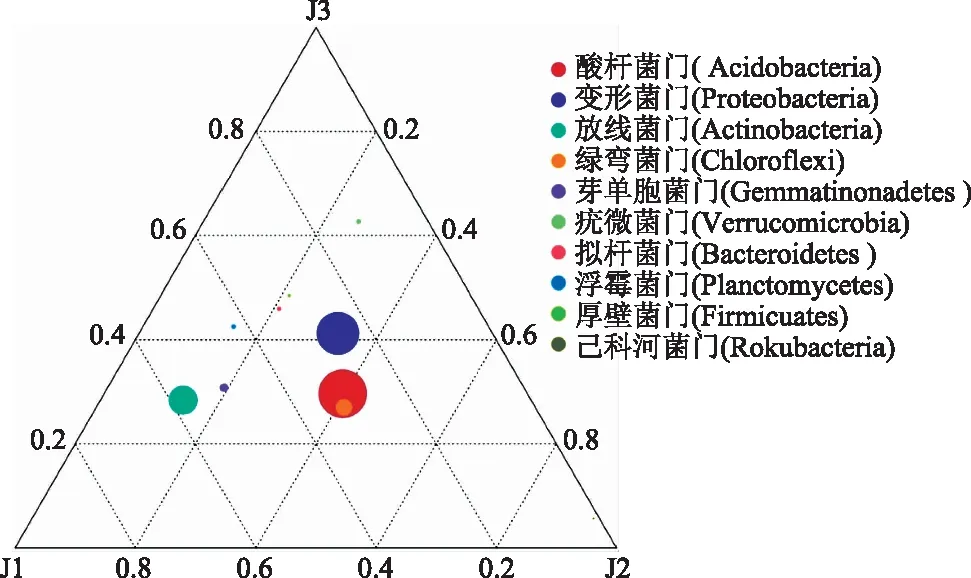
图3 门水平上排行前10的优势物种三元相图Fig.3 The ternary plot of the Top 10 dominant species at the phylum level
为了进一步研究样本间的相似性,在考虑物种丰度变化的基础上,从进化角度对样本进行了两两比较,完成了基于Weighted Unifrac距离矩阵的聚类分析(图4)。由图4可知:竹林核心区J1与竹林边缘区J3样本细菌群落结构较为相似,合为一类,二者与非竹林区J2差异较大,说明竹林土壤微生物有相对独立和独特的微生物群落;排行前10的细菌菌门的OTUs总数表现为竹林核心区J1高于J3、J2,即土壤细菌丰度从竹林核心区向非竹林区逐渐递减;从细菌群落结构来看,竹林核心区J1以放线菌门(Actinobacteria)占比最高,酸杆菌门(Acidobacteria)和变形菌门(Proteobacteria)次之;竹林边缘区J3以变形菌门占比最高,其次是放线菌门和酸杆菌门;非竹林区J2以酸杆菌门占比最高,其次是变形菌门和其他类。
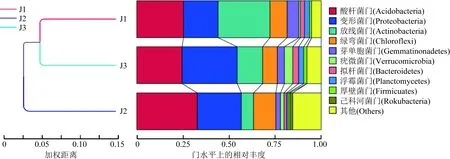
图4 门水平上的Weighted Unifrac距离矩阵聚类分析Fig.4 Cluster analysis of Weighted Unifrac distance matrix at the phylum level
2.3.2 属或种水平上的物种分布分析
为了更为清晰地反映土壤样品间细菌群落结构的微观变化,以相同的方法分析了土壤微生物属或种水平上细菌菌群的结构和丰度(表1)。研究结果显示,竹林核心区J1主要以酸杆菌门酸栖热菌属为主,放线菌门的科维粟属、嗜酸微生物属、盖莱莱属也是其优势菌群。竹林边缘区J3的优势菌群则包括变形菌门的鞘氨醇单胞菌属、酸杆菌门苔藓杆菌属、芽单胞菌门金雀花属、疣微菌门乌代杆菌属及绿弯菌门绿弯菌属。对非竹林区J2而言,各类菌群丰度均较低,酸杆菌门苔藓杆菌属成为其优势菌群。随着样本从非竹林区逐渐接近竹林核心区,个别微生物菌群的丰度发生了显著性变化。
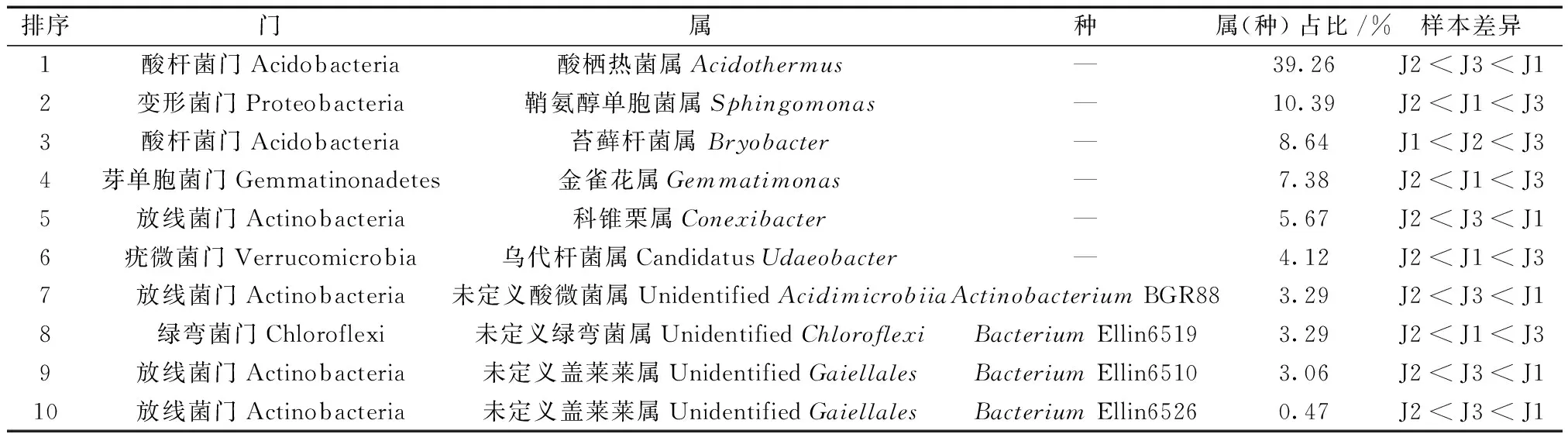
表1 属或种水平上排行前10的细菌丰度差异Table 1 The top 10 bacterial abundance differences at the genus or species level
2.3.3 属水平上的物种进化树分析
选择属水平上的Top 100代表序列进行物种进化树分析(图5),所构建的系统发育树的分支的颜色表示其对应的门,每种颜色代表一个门。结果显示它们主要来自共有菌属,即在属水平上细菌群落多有着共同起源;其在群落多样性和丰度上存在部分交叉,表明彼此间存在一定的进化相关性。
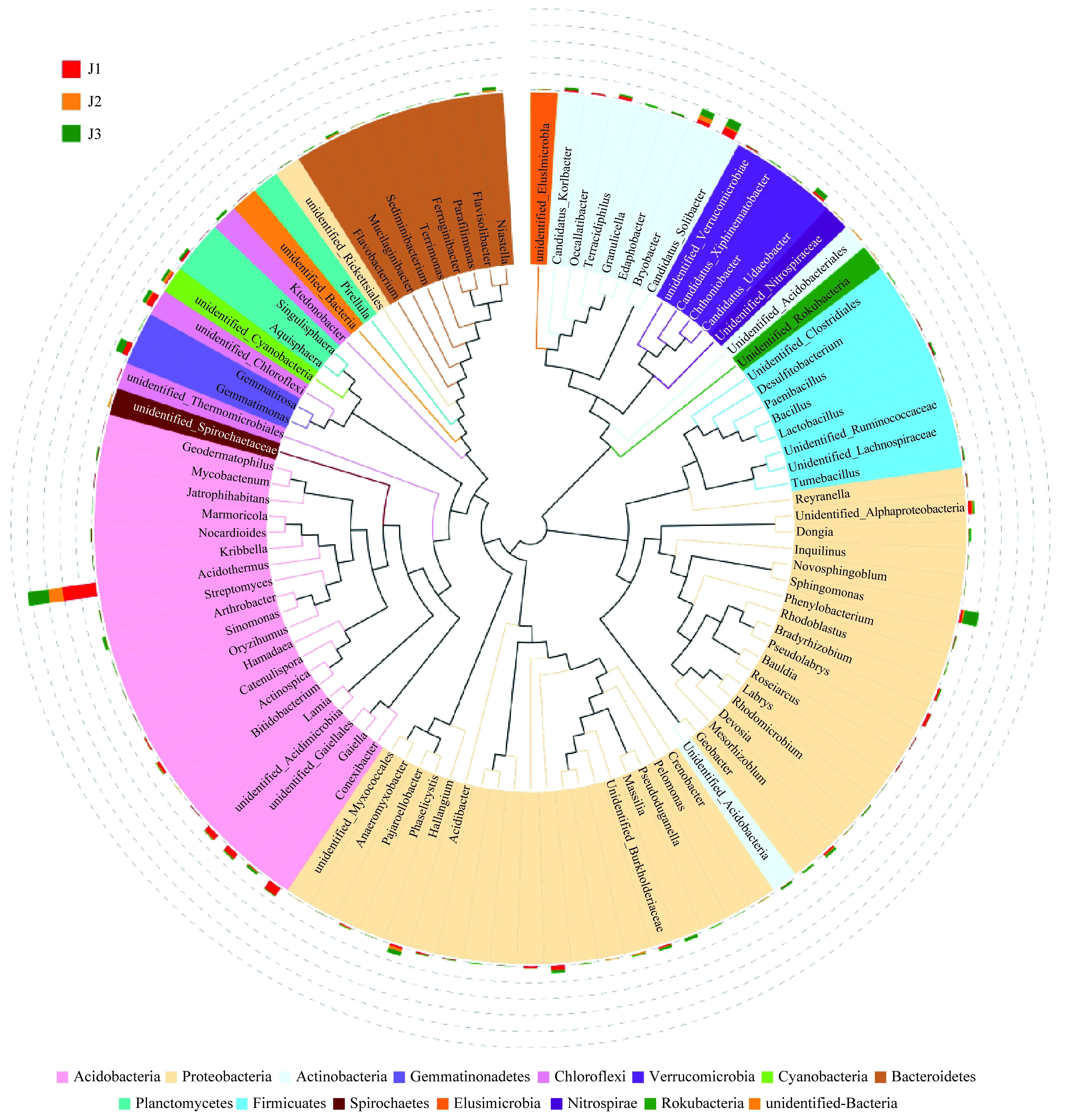
图5 属水平上Top100物种系统发生关系Fig.5 Phylogenetic relationship among Top100 species at the genus level
2.4 样本内复杂度分析
为反映样本内部细菌群落的丰富度、多样性及组间差异,进行α群落多样性分析(表2)。由表2可知,三个样本Goods Coverage指数均接近于1,表明样本测序深度非常合理,已基本覆盖了所有物种;非竹林区J2的Shannon指数、Simpson指数均低于J3、J1,表明竹林边缘区J3的群落多样性、均匀性较高、J2较低;由Chao1指数、ACE指数可知,竹林边缘区J3的物种丰富度、稀有物种数量远高于J2、J1;OTUs数提示竹林边缘区J3种群丰富,基于进化距离和物种丰度的PD谱系多样性指数也显示,J3有着更大的群落物种多样性,群落内物种较为复杂。
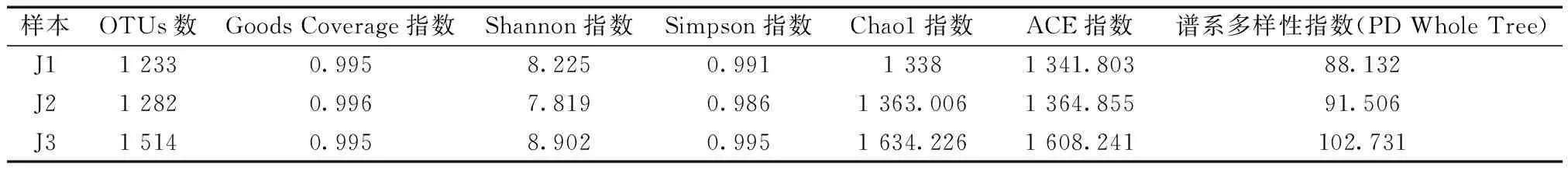
表2 样本内α群落多样性分析Table 2 Analysis of α diversity within-community
2.5 样本间比较分析
为分析不同样本的细菌群落构成,根据样本OTUs丰度信息,选用 Weighted Unifrac(加权距离)、Unweighted Unifrac(非加权距离)两个距离指标来计算两个样本间的距离,并描述其组间差异(图6),方格中的数字是两样本间的相异系数,同一方格上下两个值分别代表Weighted Unifrac和Unweighted Unifrac距离。
由图6可知,非竹林区J2与竹林核心区J1的变异系数最大(0.36),其次是与竹林边缘区J3的变异系数(0.265),J1与J3之间变异系数最小,说明非竹林区与竹林边缘区、竹林核心区在细菌群落结构方面存在的差异较大,竹林生态系统具有独特的微生物群落结构。
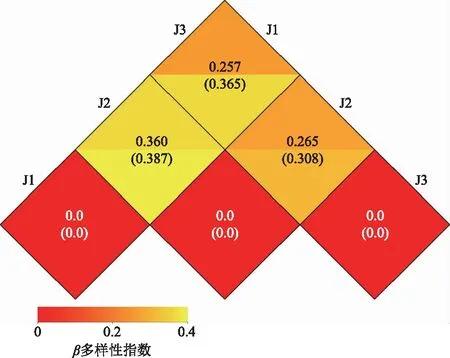
图6 β多样性指数热图Fig.6 Heat map of β diversity index
3 讨论
3.1 酸杆菌的分布及影响因子
酸杆菌门在土壤中的数量占细菌总量的20%左右[13],在16SrRNA 基因库中比例高达30%~50%,仅次于变形菌门[14],有的甚至高达 65%[15]。本文研究也发现,酿酒环境的竹林核心区J1中放线菌门数量最多,但酸杆菌门的酸栖热菌属才是其优势菌属,丰度达到39.26%。相关研究显示,杉木林、马尾松林等森林土壤细菌中酸杆菌门也是优势菌群(32.68%~49.17%)[16],且中、老林的平均丰度明显高于幼林[17]。酸杆菌的多样性及其分布与土壤类型也有一定关系,不同的酸杆菌属在不同林地类型土壤中相对丰度也不同。对7种常见树林根际土壤的研究发现,其细菌多样性较高,常绿树根际土和落叶树根际土酸杆菌亚群分布存在差异[18]。当土地利用类型改变,如原始森林转变为农田后,酸杆菌相对含量由28%降到16%[19]。对农田的研究显示,酸杆菌门平均相对丰度为24.11%,是仅次于变形菌门(29.93%)的土壤第二大细菌类群[20]。总体上,酸杆菌门细菌对不同环境有很强适应能力,在自然环境中广泛分布,其影响因子主要包括pH[21-22]、土壤有机碳含量、土壤 C/N[27]、地表植被类型、海拔高度[23]、大气二氧化碳含量和土壤含氮量等[24],在不同生境之间以及同一生态环境不同区域之间其群落结构都存在显著性差异[12,25],可能在各生态系统中均具有独特的驱动作用及生态功能[25]。
3.2 特殊竹林土壤与其他竹林土壤细菌群落结构比较
从门水平上看,竹林土壤细菌群落的优势菌门具有高度一致性[6],优势菌群的构成比例差异不明显。本文研究中竹林核心区J1竹林种类为毛竹,因此其与自然生长毛竹林[1,11,26]和其他竹林[7]的土壤细菌优势菌门丰度相比(表3),放线菌门占比较高,而其他竹林土壤变形菌门占比较高。
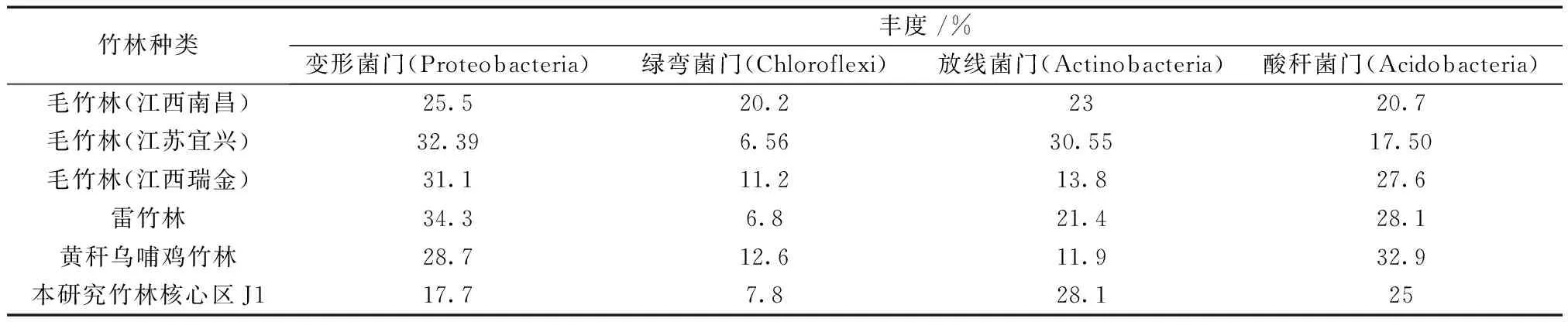
表3 特殊竹林土壤与自然生长竹林土壤细菌优势菌门丰度比较Table 3 Comparison of abundance of dominant bacteria in special bamboo forest soil and natural bamboo forest soil
从属水平上看,本研究中竹林核心区J1主要以酸杆菌门酸栖热菌属为主,放线菌门的科维粟属、嗜酸微生物属、盖莱莱属也是其优势菌群;竹林边缘区J3的优势菌群则包括变形菌门的鞘氨醇单胞菌属(Sphingomonas)、酸杆菌门苔藓杆菌属(Bryobacter)、芽单胞菌门金雀花属(Gemmatimonas)、疣微菌门乌代杆菌属(CandidatusUdaeobacter)及绿弯菌门绿弯菌属(Chloroflexi);而自然生长的毛竹林地土壤细菌优势菌群[12]主要包括不动杆菌属(Acinetobacter)、苍白杆菌属(Ochrobactrum)、鞘氨醇单胞菌属(Sphingomonas)、酸热菌属(Acidoth-ermus)、罗尔斯通菌属(Ralstonia)和慢生根瘤菌属(Bradyrhizobium)。上述研究表明活竹酒酿酒环境对竹林土壤产生了一定的影响,导致土壤细菌群落结构发生较大改变。
竹林与其他林地土壤细菌群落种类相差较小,丰度最高的前三优势菌门均为变形菌门、放线菌门和酸杆菌门(表4),但绿弯菌门是竹林特有优势菌门[6]。对油茶林土壤微生物多样性的研究发现,油茶土壤酸杆菌门、变形菌门、放线菌门和绿弯菌门相对丰度之和超过80%[27]。白桦、樟子松、兴安落叶松和偃松的根围土壤中,变形菌门、酸杆菌门和放线菌门为主要优势菌门,相对丰度之和均高于 75.0%[28]。本文研究中处于酿酒环境的竹林核心区J1土壤4种菌门相对丰度之和达81.6%,除绿弯菌门以外的3种菌门相对丰度之和为70.8%,放线菌门相对丰度高于其他植被类型,而变形菌门相对丰度相对较低。
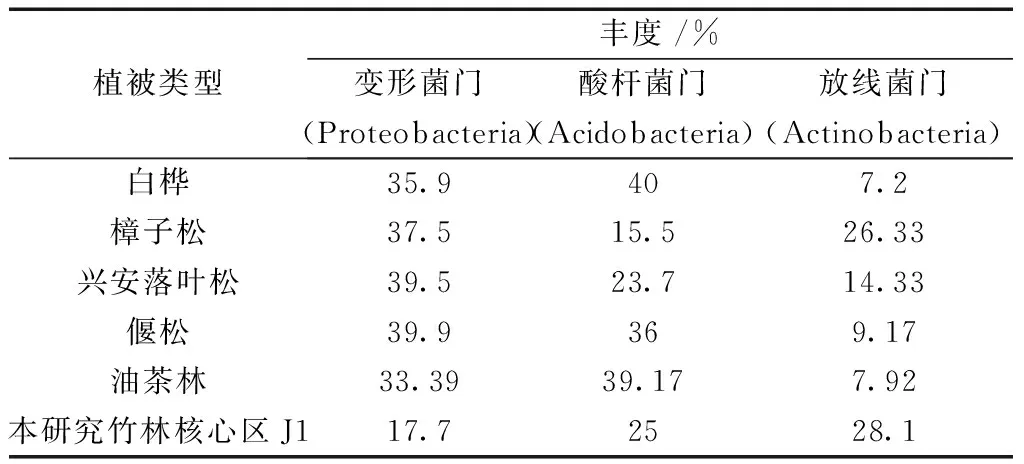
表4 特殊竹林土壤与其他森林土壤细菌优势菌门丰度比较Table 4 Comparison of bacterial dominant phyla abundance between special bamboo forest soil and other forest soil
4 结论
(1)绿弯菌门是竹林特有优势菌门,活竹酒酿造环境使得竹林土壤放线菌门而非变形菌门数量最多。竹林核心区土壤细菌数量低于非竹林区、竹林边缘区,或与竹林单一生境有关。
(2)竹林核心区酸杆菌门的酸栖热菌属数量最多,其丰度达到39.26%。竹林与非竹林区之间的交界区域群落物种丰富度、稀有物种数量较高,群落内物种较为复杂,优势菌主要来自变形菌门和绿弯菌门,但其细菌群落结构仍与竹林土壤相似。
(3)非竹林区的各类菌群丰度均较低,以酸杆菌门苔藓杆菌属为主,与竹林核心区、竹林边缘区在细菌群落结构方面存在的差异较大,活竹酒酿造使得竹林生态系统具有独特的微生物群落结构,对揭示竹酒酿造区土壤微生物的响应机制具有一定意义。
