4-辛基衣康酸抑制糖酵解调控M2型巨噬细胞极化*
2022-05-29陈成英袁江浪孔星星王新航刘彧冰陆彩玲李习艺
陈成英,蓝 利,2,袁江浪,孔星星,王新航,2,刘彧冰,李 菡,陆彩玲,李习艺,唐 深,2△
(广西医科大学 1.基础医学院;2.广西高校基础医学研究重点实验室;3.公共卫生学院,南宁 530021)
巨噬细胞(Mφ)是固有免疫的重要细胞,主要分为促炎的M1 型Mφ 和抑炎的M2 型Mφ,在不同炎症微环境刺激下会迅速做出反应,发挥促炎或抑炎功能,调控炎症以限制损害和保护人体[1-2]。当暴露于促进Mφ 可塑性和重编程的细胞因子环境时,M1 和M2 型Mφ 可发生可逆的功能变化,在调节炎症发生及消退过程中发挥着重要作用[3]。
衣康酸(itaconate,ITA)是M1 型Mφ 中最丰富的代谢产物之一,可以通过激活核因子相关因子2(nuclear factor E2-related factor 2,Nrf2)途径抑制炎症[4]。4-辛基衣康酸(4-Octyl itaconate,4OI)是一种可透过细胞膜的ITA 衍生物,在活化的Mφ 中被代谢为ITA,具有抗炎作用[5]。研究报道,4OI 可降低LPS 诱导的肺部炎症[6]。4OI 可抑制M1 型Mφ 和促炎因子的产生,抑制炎症反应[5]。研究提示,4OI 发挥抗炎作用的机制可能是通过调节M1 型Mφ 的炎症极化。目前4OI对M2的作用机制未见详尽报道,本项目以人髓系白血病单核细胞(THP-1)诱导M2型Mφ 为研究对象,初步研究ITA 衍生物4OI 对M2型Mφ 的影响和作用机制,为ITA 衍生物治疗炎症提供新的科学依据。
1 材料和方法
1.1 材料
THP-1 细胞(中国科学院典型培养物保藏委员会细胞库)。佛波酯(phorbol myristate acetate,PMA)、TRIzol、刃天青(Sigma公司);白介素(IL)-4(PeproTech 公 司);4OI(MedChemExpress);RPMI1640 培养液、胎牛血清(Gibco 公司);青霉素、链霉素、己糖激酶(Hexokinase,HK)、丙酮酸激酶(Pyruvate kinase,PK)检测试剂盒(索莱宝生物科技公司)。蛋白定量和RNA提取试剂盒(TaKaRa公司);SYBR®Green Master(Roche公司);引物由Invitrogen 公司合成;Leica 倒置显微系统、StepOne 荧光定量PCR仪、Multiskan Go全波长酶标仪。
1.2 方法
1.2.1 细胞培养及实验分组
按细胞密度8.5×105个/孔接种于6 孔板,将Mφ分为M0 组、M2 组、M2+4OI-L 组和M2+4OI-H 组。M0组用含100 nmol/L PMA培养基刺激48 h,M2 组在M0 组基础上用含20ng/mL IL-4 培养基再诱导48 h,M2+4OI-L 组和M2+4OI-H 组在M2 组基础上分别用100 μmol/L和200 μmol/L4OI再干预12 h。
1.2.2 细胞形态观察和分析
倒置显微镜观察并记录各实验组实验过程和终点的细胞形态。摄取各实验组实验终点细胞图片,5张/组以上。通过Image J软件连续计数各组观察视野中1 000个Mφ,并计算伪足伸出细胞和梭形细胞的细胞数占总细胞数的百分比。
1.2.3 实时荧光定量PCR(real time quantitative PCR,RT-qPCR)法检测M2 型Mφ 极化相关标志物和碱棕榈酰基转移酶-1α(carnitine palmitoyltransferase 1α,CPT-1α)的mRNA表达水平
到达实验终点后,去除培养基上清,无菌PBS洗1 次,每孔加入1 mL TRIzol,提取总mRNA 后逆转录为cDNA。RT-qPCR 反应体系:cDNA 0.4 μL,SYBR green mix 10 μL,RT-qPCR 正反向引物各1 μL,无酶水7.6 μL。反应条件:95 ℃预变性1 min,(95 ℃变性30 s,60 ℃退火20 s)×45 个循环。RTqPCR 引物:以β-actin为内参,采用2-△△CT法计算目的基因的相对表达量。引物序列见表1。

表1 引物序列/(5’~3’)
1.2.4 微量法检测HK和PK活性
弃去培养基后用PBS 洗3 次,每孔加入200 μL HK 或PK 提取液,将细胞刮下并收集于1.5 mL EP管内,在冰浴条件下超声裂解细胞,4 ℃离心10 min,取上清液。按照试剂说明书使用全波长酶标仪检测各实验组吸光度值,按照说明书公式计算HK 和PK活性。
1.2.5 刃天青法检测线粒体呼吸链代谢酶活性
THP-1细胞按1.8×104个/孔细胞数接种于96孔板,按照上述分组处理完成后,每组5 个复孔,每孔加入100 μL 0.02%的刃天青溶液,并设置背景对照组,37 ℃、5%CO2培养箱中孵育3.5 h,在激发光波长530 nm,发射光波长590 nm 处,全波长酶标仪读取各组荧光信号强度,荧光强度线粒体呼吸链代谢酶活性=各组荧光信号强度-背景对照组荧光信号强度。
1.3 统计学方法
采用SPSS 20.0 统计软件分析数据,计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,组间两两比较采用LSD-t法;计数资料以频数或百分率(%)表示,率的比较采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 4OI干预对M2形态的影响
THP-1 细胞经PMA 诱导活化为M0 型,细胞呈灰色煎蛋样或不规则型;M0 型经IL-4 诱导极化为M2型,细胞伪足形成和梭形样改变;各组伪足伸出细胞和梭形细胞占比分别为M0 组8.0%、M2 组78.1%、M2+4OI-L 组68.5%和M2+4OI-H 组52.3%,与M2组相比,4OI干预后的伪足伸出细胞和梭形细胞占比减少,且M2+4OI-H 组更明显(P<0.01),见图1。
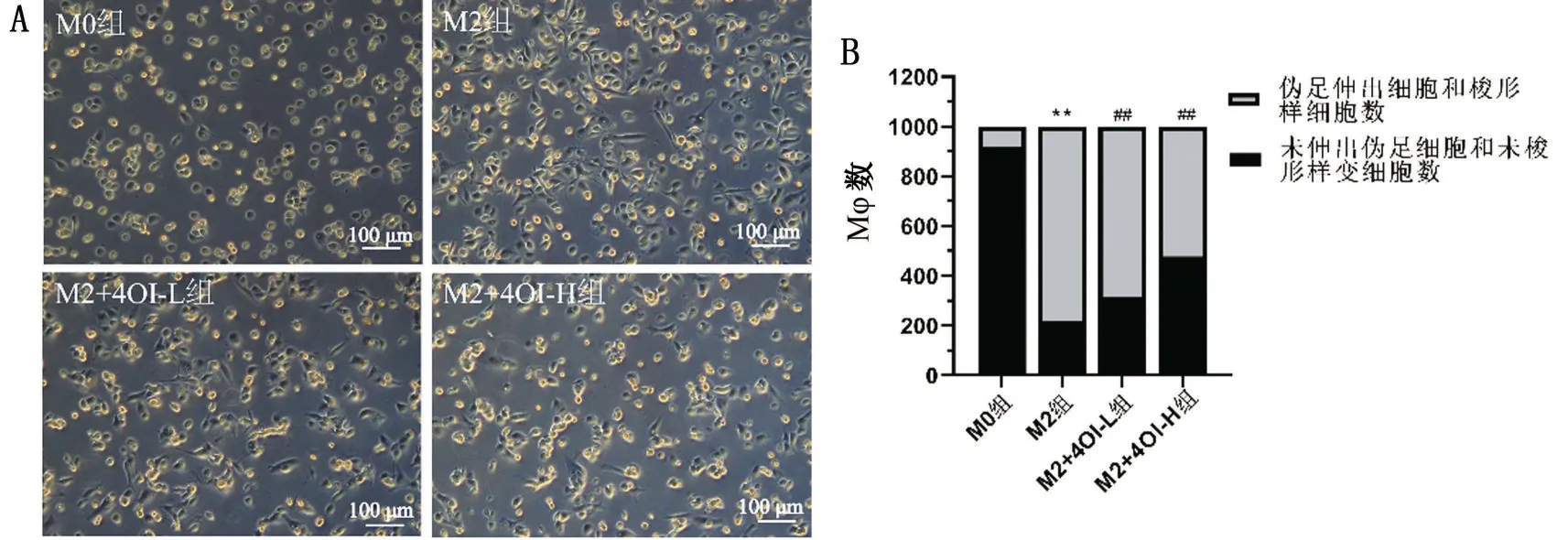
图1 Mφ极化形态学变化
2.2 4OI对M2极化相关基因表达的影响
与M0 组相比,M2 组M2 极化标志物IL-10,MRC-1,CCL22,CD209,SOCS1 和PPAR-γmRNA水平均升高(均P<0.01);与M2组相比,M2+4OI组M2 极化标志物IL-10,MRC-1,CCL22,CD209,SOCS1和PPAR-γmRNA 水平降低,且M2+4OI-H组较M2+4OI-L组干预作用更强(均P<0.05),结果提示4OI干预降抑制M2极化标志物表达,抑制作用随剂量增加而增强,见图2。据此,本文选择200 μmol/L 4OI开展后续实验研究。
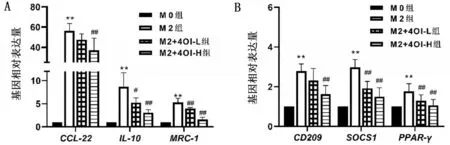
图2 M2极化相关基因mRNA表达水平比较
2.3 4OI干预对M2糖酵解限速酶活性的影响
与M0 组相比,M2 组HK 和PK 酶活性均升高(P<0.05);与M2组相比,M2+4OI-H组HK和PK酶活性均降低(P<0.05)。结果显示,M2 极化后糖酵解水平增加,4OI干预后降低M2糖酵解水平,见图3。
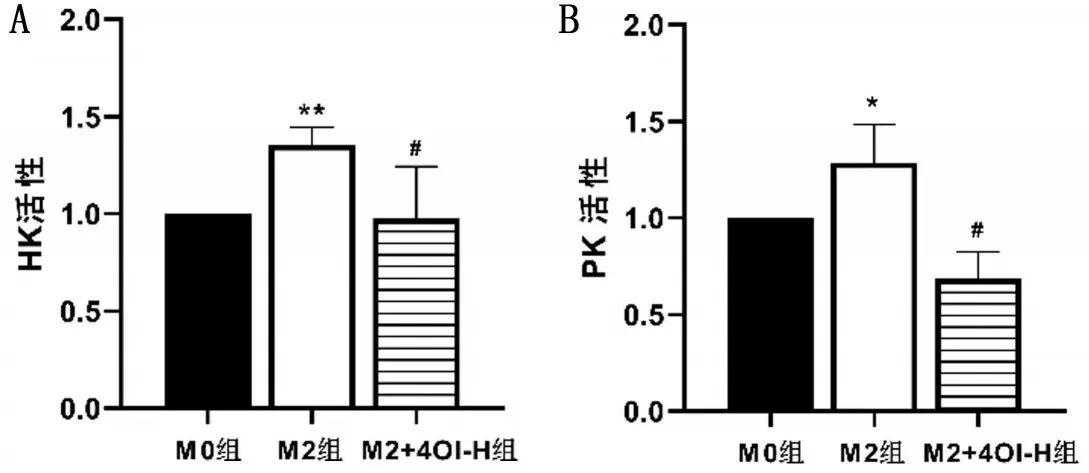
图3 糖酵解相关酶活性比较
2.4 4OI干预对M2脂肪酸氧化限速酶基因表达的影响
与M0 组相比,M2 组CPT-1αmRNA 水平升高(P<0.01);与M2 组相比,M2+4OI-H 组CPT-1αmRNA 水平进一步升高(P<0.01)。结果显示,M2极化后CPT-1αmRNA表达水平增加,4OI干预后可进一步提高M2CPT-1αmRNA表达水平,见图4。
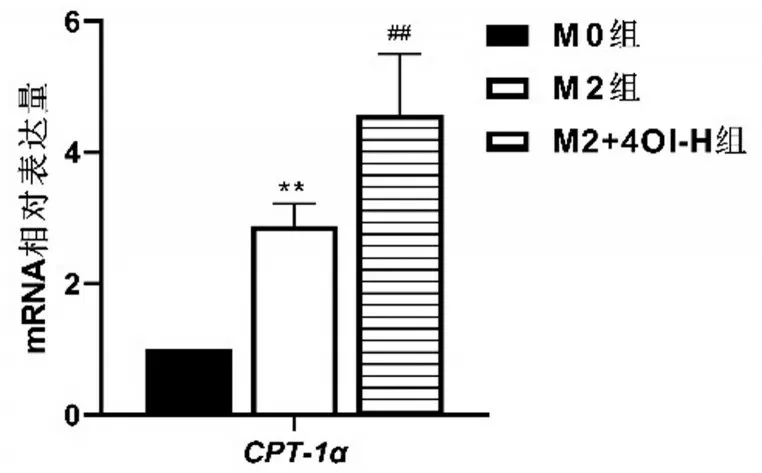
图4 CPT-1α mRNA表达水平比较
2.5 4OI干预对M2线粒体呼吸链代谢酶活性的影响
与M0组相比,M2组线粒体呼吸链相关酶活性水平升高(P<0.05);与M2组相比,M2+4OI-H组中线粒体呼吸链相关酶活性水平无明显变化(P>0.05)。结果显示,M2 极化后线粒体呼吸链代谢酶活性增加,4OI干预后不影响M2线粒体呼吸链代谢酶活性,见图5。
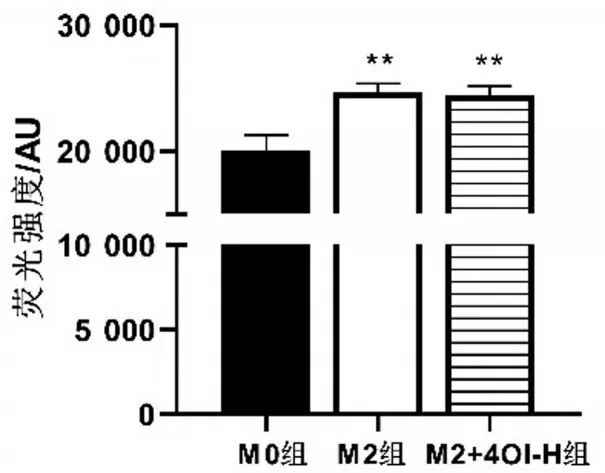
图5 线粒体呼吸链代谢酶活性水平比较
3 讨论
Mφ 在炎症微环境中可极化为M1 和M2 型。M1 通过释放IL-1β、IL-6 等介导炎症反应;M2 通过分泌IL-10、CCL22等介导抗炎和组织修复[7]。在本研究中,与M0 组相比,M2 组细胞伪足形成和呈梭形样改变,同时M2 极化标志物mRNA 表达量上升。4OI 作为ITA 衍生物在活化的Mφ 内可转化为ITA,通过亲电应激反应激活Nrf2,发挥抗炎和抗氧化作用[8]。文献报道,肝癌细胞HepG2 来源的乳酸可激活Nrf2 使Mφ 向M2 样表型倾斜[9]。在小鼠急性肝损伤模型中,4OI 饲喂抑制Mφ 从而减轻肝损伤[10]。Katharina 等[11]用4OI 处理THP-1 诱导的M2型Mφ 24 h,发现促炎因子TNF-α和M2抑炎极化标志物PPAR-γ和IL-10表达均下降,但IL-1β表达增加,这与本研究结果类似。本研究结果显示,4OI可降低M2 型极化标志物mRNA 水平。Runtsch 等[12]认为4OI是通过降低“M1-M2”谱中的所有Mφ功能来发挥抗炎作用,4OI预处理BMDM后诱导为M2,4OI 可抑制JAK1/STAT6 通路降低M2 的极化水平。
免疫代谢重编程在M1 和M2 极化中有关键的调节作用[13]。M1 的能量供应特征是增加有氧糖酵解;M2 的能量供应特点是增加葡萄糖摄取和脂肪酸氧化水平,具备完整的三羧酸循环维持的高水平氧化磷酸化[14]。IL-4 刺激小鼠Mφ 极化为M2 过程中糖酵解水平上升,参与M2 型的极化供能[15]。本研究结果显示,M0极化为M2后,糖酵解限速酶HK和PK 活性增加,脂肪酸氧化限速酶CPT-1αmRNA水平增加,线粒体呼吸链酶活性增加,提示M2极化过程中糖酵解和脂肪酸氧化共同参与供能。文献报道,4OI抑制LPS诱导的小鼠骨髓来源Mφ活化,并抑制细胞糖酵解[4]。Nrf2敲除的小鼠中长链脂肪酸和短链脂肪酸的脂肪酸氧化水平受到抑制[16]。在本研究中,4OI 抑制M2糖酵解水平,并进一步增加脂肪酸氧化水平和维持线粒体呼吸代谢酶活性水平,这提示细胞的氧化磷酸化水平被维持稳定水平。LPS 构建的脓毒性心脏病模型中,松果碱通过上调心肌细胞Nrf2 水平促进脂肪酸氧化水平和三羧酸周期从而保护氧化磷酸化水平稳定[17]。结合本研究结果,4OI作为Nrf2的激活剂,其可能通过抑制糖酵解水平和促进脂肪酸氧化,以维持线粒体呼吸代谢酶活性水平和氧化磷酸化水平稳定,继而保持M2能量代谢特征和极化稳定,避免M2过度极化导致功能失调。
综上所述,4OI抑制M2糖酵解引起细胞内糖代谢发生重编程,降低IL-4 诱导的M2 极化标志物表达;伴随进一步提高脂肪酸氧化水平,这可能作为能量补充以抵消糖酵解受抑制导致的能量缺失,从而维持线粒体呼吸链代谢酶活性和氧化磷酸化水平的稳定,保持M2 极化代谢特征状态,避免M2 的过度极化。这可能是4OI作为免疫训练调节剂介导抗炎作用的新机制,本研究为ITA 及其衍生物治疗Mφ相关炎症性疾病提供新的科学依据。
