肠道菌群在病毒性心肌炎小鼠中的初步研究
2022-05-27孔清陈利利
孔清 陈利利



摘要:目的:应用16S rRNA高通量测序技术,初步探索肠道菌群在柯萨奇病毒B3(CVB3)诱导的小鼠病毒性心肌炎(Viral myocarditis,VMC)中的变化和意义。方法:雄性BALB/c 小鼠经腹腔注射磷酸盐缓冲液(PBS)0.1ml+102TCDI50 CVB3病毒液,建立VMC小鼠模型;健康对照组为雄性BALB/c小鼠腹腔注射0.1ml PBS。在注射后的第14天,心肌HE染色观察两组心肌病理形态特征,留取新鲜粪便,应用高通量测序技术16S rRNA,对两组小鼠的肠道菌群进行特征分析。结果:对比对照组,VMC组肠道菌群的Alpha及Beta多样性差异均无统计学意义(P>0.05)。在门水平上分析,两组优势菌门均为厚壁菌门(Firmicutes)与拟杆菌门(Bacteroidetes),且二者比值(F/B)在VMC组中明显升高,为0.43,而对照组F/B比值为0.29。科水平分析,拟杆菌门S24-7菌科,对照组的相对丰度为39.47%,明显高于VMC组31.58%(p<0.05);梭菌科的相对丰度,对照组为0.27%,低于VMC组0.47%(p<0.05);F16的相对丰度,对照组为0.20%,低于VMC组为0.40%(p<0.05)。而两组的瘤胃球菌属、脱硫弧菌属、产硫细菌、梭状芽胞杆菌属、卵形拟杆菌等,其相对丰度亦有显著差异(p均<0.05)。结论:CVB3导致的病毒性心肌炎小鼠存在肠道菌群紊乱,提示肠道菌群紊乱可能参与病毒性心肌炎的发病機制。
关键词:病毒性心肌炎;肠道菌群;16S rRNA
【中图分类号】 R542.2+1【文献标识码】A 【文章编号】1673-9026(2022)14--03
病毒性心肌炎(VMC)是常见心血管病之一,以心肌弥漫性或局灶性炎症为主要特征。VMC主要由肠道病毒感染引起,是青少年、运动员猝死的主要原因之一,目前仍缺乏有效的早期诊断和有效的治疗手段。由于地域的不同,全球范围VMC的发病率约为0.1%-15%,而我国VMC发病率约2%-15%[1, 2]。肠道病毒是VMC的重要病因,其中B3型柯萨奇病毒(CVB3)感染是VMC最主要的病原[3, 4]。CVB3为细小RNA病毒科中肠道病毒属,经粪-口途径感染食道和胃肠道之后,病毒CVB3入血感染心肌细胞,继发自身免疫反应及损伤。然而, VMC发病机制尚未完全阐明
肠道病毒CVB3病毒感染机体后,肠道是其最初部位和早期复制部位,受到广泛关注。人类肠道菌群包含微生物众多,约1013~1014个,而其基因组是人体细胞的150倍,因此肠道菌群也被看作是人类的“第二基因组”[5, 6]。既往由于技术限制,人类对肠道菌群的功能检测缺乏有效的手段,肠道菌群成为了“被遗忘的微生物器官”。如今借助高通量测序技术,其不依赖培养,研究者们发现肠道菌群对机体的影响几乎涉及各个系统,特别在炎症、免疫反应方面具有举足轻重的作用。且大量研究发现肠道菌群失调与多种非传染性疾病,如脑血管疾病、2型糖尿病、肿瘤等疾病的发病机制密切相关[7-9]。
在心血管疾病中,有研究报道肠道菌群紊乱与动脉粥样硬化、高血压、缺血性心肌病、心衰等疾病有关[10]。如慢性心衰患者可出现肠道致病细菌和念珠菌属的过度生长,甚至有研究者提出新概念--心衰中存在“心-肠轴”[11]。这些研究提示肠道菌群参与部分心血管疾病发病机制。而在VMC中,肠道乳酸杆菌等菌株的丰度在雌雄小鼠中存在显著差异,提示心肌炎可能与肠道菌群失调有密切关系[12]。但VMC小鼠与健康对照组肠道菌群的差异,未见报道,亟需进一步的研究。因此本研究通过收集CVB3诱导的VMC小鼠与健康对照组的粪便,应用高通量测序对肠道菌群进行特征分析,试图寻找两组小鼠肠道差异性菌群,为阐明VMC发病机制以及探索肠道菌群干预等新治疗方式提供理论基础。
1材料与方法
1.材料:实验用BALB/c小鼠购于北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2016-0006。在实验周期内,5-6周龄雄性BALB/c小鼠均在广西医科大学动物中心饲养。CVB3(Nancy株)和Hep-2细胞株由广西医科大学微生物与免疫学教研室友情提供。本动物实验通过广西医科大学实验动物伦理委员会审批。
2.建立模型和分组:Hep-2细胞活化增殖CVB3 Nancy株,培养72小时后,依据细胞病变效应检测半数组织感染浓度(TCID50),为1×107。小鼠根据随机方法分设两组,健康对照组8只(Concrol组)、VMC组10只(VMC组),对照组腹腔注射0.1 ml PBS, VMC组注射0.1 ml含100 TCID50 CVB3的PBS。腹腔注射当天被定义为第0天。第14天时,采用颈椎脱臼法处死存活小鼠。
3.心肌组织病理学检查:取小鼠心脏切片、HE染色,在光学显微镜下观察心肌病理学变化。每张切片随机选择5个视野,计算心肌炎症面积占视野总面积的百分比,具体如下:无病变为0分,<25%为1分,25%-50%为2分,50%-75%为3分,>75%为4分[13],
4.粪便采集:第14天时,无菌收集存活小鼠的粪便,立即存至无菌EP管中,-80℃保存。
5. DNA提取:应用CTAB方法,提取两组粪便的基因组DNA,PCR选择16SrDNA V3-V4测序区域,使用琼脂糖凝胶对PCR产物进行电泳检测,剪切回收相应的目的条带。
6.构建DNA文库及16S rDNA高通量测序:文库构建使用TruSeq DNA PCR-Free Sample Preparation Kit 建库试剂盒进行,经Qubit及Q-PCR定量、文库合格后,使用HiSeq2500 PE250进行上机测序。对Illumina测序原始数据进行拼接及嵌合体过滤,利用 QIIME2(2019.4)生物信息平台得到高质量的Tags数据(Clean Tags)进行后续分析。
7.生物信息学分析:基于Clean Tags进行OTUs(Operational Taxonomic Units)聚类,97%一致性序列被聚类成为OTUs。基于OTUs的代表序列,利用Qiime软件进行物种注释。选用Greengenes 数据库对于特征序列进行物种注释。基于OTU和注释结果,使用R软件(v2.2,https://rdp.cme.msu.edu/)行物種组成分析,并进行Beta、Alpha多样性计算等统计。根据OTUs的物种注释结果,观察各组样品在不同水平中相对丰度较高的物种,例如在门(Phylum)、科(Family)、属(Genus)、种(Species)水平上分析统计。上述标本处理、生物信息学数据处理及分析均在维尔凯生物平台进行(南宁维尔凯生物科技有限公司)。
8.统计学方法:生物信息学相关统计用 QIIME2 软件进行分析。其余计量资料以均数±标准差表示,对照组和VMC组比较用独立样本t检验,以P<0.05为差异具有统计学意义,采用SPSS 17.0统计软件分析处理。
2结果:
两组小鼠一般情况及心肌病理学变化:在腹腔注射病毒后第3天,VMC组小鼠出现活动减少、耸毛、易激惹等表现,14天内死亡小鼠为2只;对照组一般情况好,无异常表现,死亡小鼠为0。HE染色可见VMC组小鼠心肌组织大量炎性细胞浸润、伴心肌细胞局灶性坏死,病理积分为1.9±0.4。对照组无心肌细胞坏死或炎性细胞浸润,病理积分为0。两组病理积分比较差异有统计学意义(P<0.05),提示VMC造模成功(图1)。
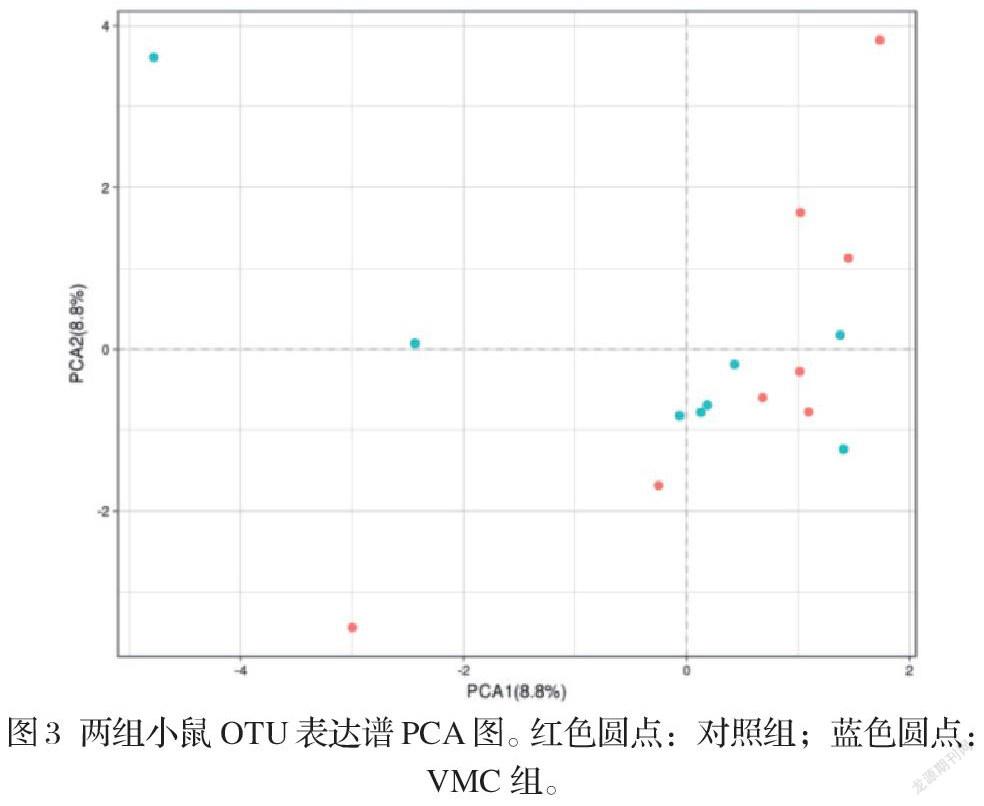
2.两组小鼠肠道菌群多样性分析:经测序质量评估及物种注释分析、基于OTU分析结果,进行Alpha及Beta多样性分析。Alpha多样性分析中ACE和Chao1评估菌群丰度指数,Shannon及Simpson评估多样性指数。结果发现,VMC与对照组比较,上述四个指数差异均无统计学意义(P均>0.05,图2)。此外,应用Beta分析了解VMC与对照组肠道菌群结构及组成在总体水平上的差异。主成分分析(PCA)提示,VMC与对照组两组间存在交叉现象,两组肠道菌群的结构组成在整体上差异无统计学意义(P=0.18,图3)。
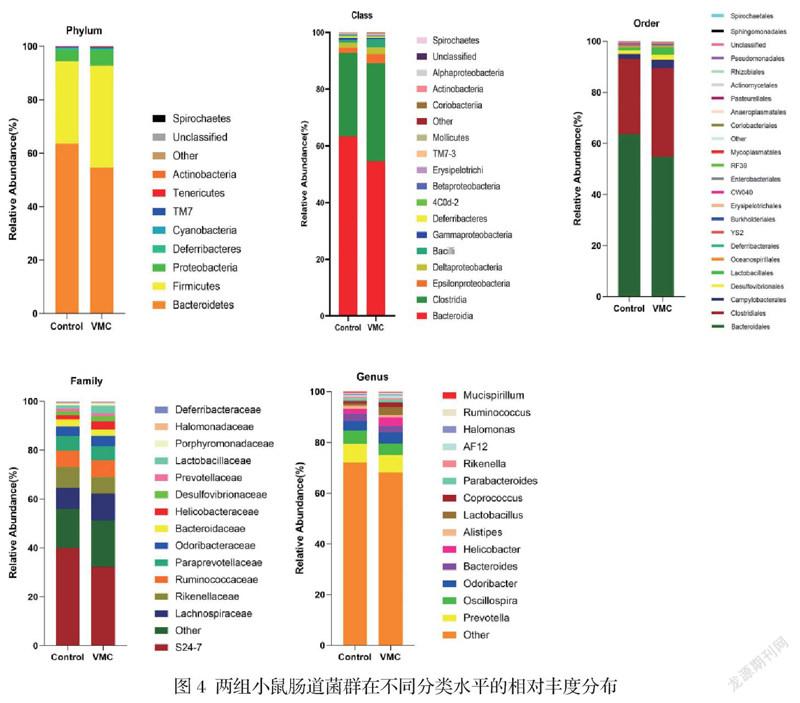
3.两组小鼠在不同分类水平上的肠道菌群差异:对样本物种信息注释后,并根据丰度值进行排序,结果示两组优势菌群主要由拟杆菌门、厚壁菌门、变形菌门、脱铁杆菌门、蓝菌门等组成。在门水平上各组优势菌门均为厚壁菌门与拟杆菌门,且二者比值(F/B)在VMC组中明显升高,为0.43,而对照组为0.29(P<0.05),见图4。
如图4所示,科水平分析,各组优势菌种主要由拟杆菌门S24-7菌科、梭菌目、毛螺旋菌科、理研菌科、瘤胃菌科等组成。科水平分析,拟杆菌门S24-7菌科的相对丰度,对照组为39.47%,VMC组为31.58%,VMC组比对照组明显降低(p<0.05)。其余的优势菌属中,两组间差异无统计学意义。而非优势菌种中,对照组梭菌科的相对丰度为0.27%,显著低于VMC组0.47%(p<0.05);对照组F16的相对丰度为0.20%,明显低于VMC组0.40%(p<0.05),见表1。
此外,属水平上分析发现部分菌属相对丰度在两组间差异显著,包括拟杆菌AF12、瘤胃球菌属、脱硫弧菌属、梭菌属等。而种水平上分析亦发现部分菌种在两组间差异有统计学意义,包括耳蜗形梭菌、产气荚膜菌、卵形拟杆菌、糖菌属(图4、表1)。
3讨论:
肠道菌群与人体的健康的关系越来越引起科学界的重视。肠道菌群甚至被视为独立的“器官”,认为肠道菌群能为人体提供营养、参与宿主共代谢、调节抗生素敏感性、诱导先天性免疫等,并参与了肥胖、糖尿病、代谢异常、炎症性肠病和高血压等疾病的发病机制[14]。因此,从肠道菌群的视角探索疾病发病机制引起广泛的关注。
肠道病毒尤其是CVB3是病毒性心肌炎最常见的病原体,而肠道是CVB3 病毒感染机体的最初器官。类似于临床所见,CVB3诱导的心肌炎小鼠模型中,雄性易感,而雌性不易感。雄性小鼠对CVB3易感是否与肠道菌群有关?既往钱乾等发现[12],CVB3诱导的心肌炎,雌雄两组小鼠的肠道菌群多样性分析无显著差异。该研究提示心肌炎的严重程度可能与肠道菌群的多样性无关。而我们首次利用高通量测序技术对CVB3导致的病毒性心肌炎小鼠肠道菌群进行整体和门属水平分析,发现菌群整体多样性与健康对照组无显著差异,提示在VMC组小鼠中无特异性表达的肠道细菌,说明并非单一的肠道细菌而有一群肠道菌群在VMC小鼠肠道存在差异,可能影响小鼠肠道免疫功能。
肠道菌群功能和结构比例异常是肠道菌群紊乱的表现,目前常用来评价肠道菌群失调的一个重要指标为F/B 比值,其上调被认为是与高血压等心血管疾病相关肠道菌群失调的重要标志[5]。本课题中,我们计算发现F/B比值在VMC组明显升高,提示VMC小鼠存在肠道菌群紊乱。与本实验结果相似,胡小凡等在实验性自身免疫性心肌炎小鼠中发现[15],其F/B比值明显升高(≈2 倍正常组)。因此,通过干预调整F/B比例有可能成为抑制CVB3诱导的心肌炎,控制VMC进展的途径之一。
菌属水平分析上我们鉴定到各组优势菌群主要由厚壁菌门、拟杆菌门、变形菌门、脱铁杆菌门、蓝菌门等组成。科水平分析,我们鉴定到VMC组拟杆菌科S24-7明显降低,拟杆菌 S24-7被视为能促进丙酸盐和丁酸盐的生成,因此,本课题组既往发现VMC中短链脂肪酸明显降低(数据未发表),其可能与 S24-7减少有关。短链脂肪酸(SCFA),包括丁酸盐、丙酸盐和乙酸盐,对于肠道生理生化稳定以及细菌自身能量代谢具有重要作用。研究发现SCFA如丁酸盐具有增加胰岛素敏感性、减少炎症、心脏保护等作用[16]。因此,VMC中心肌炎症可能与拟杆菌 S24-7降低导致SCFA减少有关,但需对代谢物质进一步分析证实。梭菌属在VMC组中明显升高,梭菌属参与肠道黏膜的完整性[17],其相关毒素破坏肠黏膜完整性[18],梭菌属在VMC组中明显升高可能参与肠道粘膜破环、损伤免疫功能。而放线菌门F16,被认为减少糖代谢[19],且可作为心血管不良事件的特征性标志物[20]。VMC中F16明显升高,其是否加重VMC心肌炎症、是否能作为VMC心血管不良事件的特征性标志物,需临床研究进一步验证。此外,拟杆菌门AF12属、瘤胃球菌属、脱硫弧菌属等菌群为非优势菌属,相对丰度较低,但在两组间差异均有统计学意义,提示这些肠道菌群的改变可能参与了VMC病情的发生发展。
本实验尚存诸多不足之处:(1)未检测肠道菌群产物如代谢组学及相关血清学指标,在解释VMC中差异菌群可能的相关机制时需要更加谨慎;(2)标本为排至体外的粪便,导致检测的菌群可能有所减少,如能检测肠道内容物则更为理想。
本研究通过对VMC及健康对照组小鼠的肠道菌群进行分析,发现VMC组小鼠肠道菌群多样性无明显变化,但F/B比值增加,提示存在肠道菌群紊乱。进一步分析提示,拟杆菌门S24-7菌科、梭菌科、放线菌门F16等菌群存在差异,证实肠道菌群失调可能参与VMC发病机制,调整肠道菌群的方法如肠道菌群移植、抗生素干预等策略,或将成为治疗VMC极具吸引力的新思路和方法。
参考文献:
[1]DENNERT R, CRIJNS H J, HEYMANS S. Acute viral myocarditis [J]. Eur Heart J, 2008, 29(17): 2073-82.
[2]SCHWAAB B, KINDERMANN I, BJARNASON-WEHRENS B, et al. Viral myocarditis: a forbidden indication for cardiac rehabilitation? [J]. Eur J Prev Cardiol, 2021.
[3]ERIKSSON U, RICCI R, HUNZIKER L, et al. Dendritic cell-induced autoimmune heart failure requires cooperation between adaptive and innate immunity [J]. Nat Med, 2003, 9(12): 1484-90.
[4]FAIRWEATHER D, STAFFORD K A, SUNG Y K. Update on coxsackievirus B3 myocarditis [J]. Curr Opin Rheumatol, 2012, 24(4): 401-7.
[5]LI J, ZHAO F, WANG Y, et al. Gut microbiota dysbiosis contributes to the development of hypertension [J]. Microbiome, 2017, 5(1): 14.
[6]ELOE-FADROSH E A, RASKO D A. The human microbiome: from symbiosis to pathogenesis [J]. Annu Rev Med, 2013, 64: 145-63.
[7]DINAKARAN V, RATHINAVEL A, PUSHPANATHAN M, et al. Elevated levels of circulating DNA in cardiovascular disease patients: metagenomic profiling of microbiome in the circulation [J]. PLoS One, 2014, 9(8): e105221.
[8]MA Q, LI Y, WANG J, et al. Investigation of gut microbiome changes in type 1 diabetic mellitus rats based on high-throughput sequencing [J]. Biomed Pharmacother, 2020, 124: 109873.
[9] LEE H, LEE H K, MIN S K, et al. 16S rDNA microbiome composition pattern analysis as a diagnostic biomarker for biliary tract cancer [J]. World J Surg Oncol, 2020, 18(1): 19.
[10] TANG W H, KITAI T, HAZEN S L. Gut Microbiota in Cardiovascular Health and Disease [J]. Circ Res, 2017, 120(7): 1183-96.
[11] KAMO T, AKAZAWA H, SUZUKI J I, et al. Novel Concept of a Heart-Gut Axis in the Pathophysiology of Heart Failure [J]. Korean Circ J, 2017, 47(5): 663-9.
[12] 錢乾. TLR13和肠道菌群在柯萨奇病毒性心肌炎发病中的作用及其机制 [D]; 苏州大学, 2014.
[13] REZKALLA S K R A, KHATIB G,ET AL. Effcet of metoprolol in acute coxsackievirus B3 murine myocarditis [J]. J Am Coll Cardiol, 1988, 12: 412-4.
[14] LI Q, GAO B, SIQIN B, et al. Gut Microbiota: A Novel Regulator of Cardiovascular Disease and Key Factor in the Therapeutic Effects of Flavonoids [J]. Front Pharmacol, 2021, 12: 651926.
[15] HU X F, ZHANG W Y, WEN Q, et al. Fecal microbiota transplantation alleviates myocardial damage in myocarditis by restoring the microbiota composition [J]. Pharmacol Res, 2019, 139: 412-21.
[16] QIUJIN JIA H L, HUAN ZHOU,XIAONAN ZHANG,YINGYU XIE,YANYANG LI,SHICHAO LV,JUNPING ZHANG. Role and Effective Therapeutic Target of Gut Microbiota in Heart Failure [J]. Cardiovasc Ther, 2019.
[17] ASANO Y, HIRAMOTO T, NISHINO R, et al. Critical role of gut microbiota in the production of biologically active, free catecholamines in the gut lumen of mice [J]. Am J Physiol Gastrointest Liver Physiol, 2012, 303(11): G1288-95.
[18] ABUGHANIMEH O, QASRAWI A, KADDOURAH O, et al. Clostridium difficile infection in oncology patients: epidemiology, pathophysiology, risk factors, diagnosis, and treatment [J]. Hosp Pract (1995), 2018, 46(5): 266-77.
[19] NULI R, CAI J, KADEER A, et al. Integrative Analysis Toward Different Glucose Tolerance-Related Gut Microbiota and Diet [J]. Front Endocrinol (Lausanne), 2019, 10: 295.
[20] SCHULZ S, REICHERT S, GROLLMITZ J, et al. The role of Saccharibacteria (TM7) in the subginival microbiome as a predictor for secondary cardiovascular events [J]. Int J Cardiol, 2021, 331: 255-61.
基金項目:广西自然科学基金,项目编号:2018JJB140169
