硬粒小麦白粉病成株抗性QTL的遗传分析
2022-05-20吕侠雷吴晓辉侯玮秀王丽艳冯家春
任 妍,吕侠雷,吴晓辉,侯玮秀,刘 倜,王丽艳,冯家春,陈 锋,3
(1.阜阳市农业科学院,安徽阜阳 236065;2.河南农业大学农学院,河南郑州 450046;3.徐州佳禾农业科技有限公司,江苏徐州 221200)
小麦是人类最重要的粮食作物之一,为全世界人口提供了1/5以上的能量来源。由禾本科布氏白粉菌(f.sp.)引起的小麦白粉病是全球性真菌病害,严重威胁小麦的高产和稳产。在中国,该病害引起的小麦产量损失平均每年高达30.45万t,严重时产量损失甚至在50%以上。实践证明,与化学防治等措施相比,选育和应用抗病品种是防治小麦白粉病最安全、环保和有效的途径。因此,培育抗病品种是当前小麦育种的重要目标之一。迄今为止,已有66个抗白粉病基因(~)被定位并正式命名。这些基因中,近三分之二的抗性基因来自于小麦的祖先和野生近缘种。如基因来自黑麦,在中国50%以上的冬小麦品种都携带有该基因;基因来自簇毛麦,在全生育期对白粉病具有高水平的广谱抗性,且分布广泛。然而,由于白粉菌具有易变异、进化快等特点,使得专化性抗性基因抗性丧失较快,致使抗性不持久。如抗白粉基因早期对小麦白粉病具有优异的抗性,但随着20世纪70年代该基因的广泛应用,白粉菌对基因的毒性日益增加,如今基因在世界范围内基本上丧失了对白粉病的抗性。相反,非专化性抗性或成株抗性由于无专化性或专化性弱,减少了对小种的选择压力,从而表现为抗性更持久、稳定,这类抗性通常由微效多基因(如、和)控制,自上世纪初以来,这些基因一直保持着良好的白粉病抗性,而且兼抗条锈病、叶锈病等多种病害。因此,进一步发掘新的白粉病成株抗性基因,特别是持久抗性基因及其抗源,对中国小麦白粉病成株抗性基因的克隆和抗性育种具有重要的意义。
四倍体小麦中蕴含着丰富的抗白粉病基因,且大部分抗性基因已经广泛应用于我国小麦抗病育种中。如来自于栽培二粒小麦的,目前对河南地区的白粉病流行小种仍具有较好的抗性;来自于波斯小麦的,编码一个丝氨酸/苏氨酸蛋白激酶,在中国和美国的小麦抗病育种中仍发挥着重要作用。本研究利用UC1113和Kofa这两个具有不同白粉病抗性的四倍体硬粒小麦构建的一个F代RIL群体为材料,在4个环境下对该群体进行白粉病成株抗性鉴定,并利用完备区间作图法构建遗传图谱,挖掘硬粒小麦中新的白粉病成株抗性QTL位点,以期为小麦抗白粉病育种提供新的抗源和抗病基因。
1 材料与方法
1.1 材 料
以硬粒小麦UC1113和Kofa杂交并通过单粒传法获得的一个含有93个株系的F代RIL群体为材料。其中,UC1113是由美国加利福尼亚大学戴维斯分校的研究人员从CIMMYT杂交组合中选育出的一个农艺性状优良的硬粒小麦品系,其系谱为KIFS//RSS/BD1419/3/MEXIS-CP/4/WAHAS/5/YAV79,该品系在苗期对白粉菌生理小种E09和E20表现为高感,反应型(infection type,IT)为4级,但在成株期对E09和E20表现为高抗。Kofa是由西方育种家选育的一个沙漠硬粒小麦品种,是一个蛋白含量高且品质优良的强筋品种,该品种在苗期对白粉菌生理小种E09和E20表现为高感(IT=4),在成株期对E09和E20表现为中感(未发表)。白粉菌生理小种E09和E20由中国农业科学院作物科学研究所李洪杰研究员和吴培培博士提供。
1.2 白粉病温室苗期接种鉴定
将93个RIL家系及其双亲分别于2017年和2021年在室内种植进行白粉病接种鉴定,具体方法参考Jia等的方法。IT分级标准参考Wang等的方法。
1.3 白粉病田间成株期接种鉴定
1.3.1 田间种植
将93个RIL家系及其双亲于2019-2020和2020-2021年度分别种植于河南省郑州市河南农业大学科教园区(113.59°E,34.86°N)和河南省原阳县河南农业大学原阳基地(113.95°E,35.10°N)。田间种植采用随机区组设计,双行区,2次重复(第1、2次重复及其平均值分别用2019ZZ Ⅰ、2020ZZ Ⅰ、2019YY Ⅰ、2020YY Ⅰ、2019ZZ Ⅱ、2020ZZ Ⅱ、2019YY Ⅱ、2020YY Ⅱ和2019ZZ A、2020ZZ A、2019YY A、2020YY A),行长1.0 m,行距0.3 m。每10个材料加2行高感对照品种京双16。为了确保发病,区组与区组间的走道采用宽窄行设计,即1行宽走道(50 cm)和1行窄走道(30 cm),并在窄走道的中间沿着垂直于鉴定材料的方向均匀播种高感对照品种京双16,进一步诱发田间白粉病。
1.3.2 田间接种
2020-2021年度河南郑州点采用人工接种的方法,接种时间为2021年3月14日。首先在室内将高感对照品种京双16在一次性塑料小盆中种植,待其第2片叶完全展开时利用白粉菌小种E09和E20进行接种,接种7 d后,当白粉菌孢子堆在小麦叶片上逐渐显现时,将感白粉病的小麦苗移栽至田间试验诱发行,每1.5 m移栽4盆。其余环境均为自然发病。
1.3.3 田间鉴定
2019-2020年度郑州点以及2019-2020和2020-2021两年度的原阳点为自然发病,当高感对照品种京双16倒二叶上的白粉病严重度(即白粉菌孢子堆的面积占整个叶片面积的百分数)达到70%以上时,对RIL群体及其双亲的白粉病最大严重度(maximum disease severity,MDS)进行调查,1周后对白粉病MDS进行第2次调查。2020-2021年度郑州点为接种鉴定,根据当年高感对照品种的发病情况,分别在2020年4月27日和2020年5月7日调查材料的白粉病MDS。
1.3.4 表型数据统计分析
1.4 遗传图谱的构建及QTL定位
Zhang等选用1 235个SSR标记、275个小麦SNP标记以及7个已克隆基因的功能标记对亲本材料UC1113和Kofa进行了多态性筛选,并用亲本间有多态性的标记对93个家系进行了群体基因型分析,共获得235个多态性标记的群体基因型信息。本研究利用这235个多态性标记和完备区间作图法构建遗传图谱,并利用作图软件QTL ICIMapping V4.1(http://www.isbreeding.net)对群体基因型进行连锁分析并结合白粉病表型进行QTL定位。BIP工具的参数设置如下:作图方法选用ICIM-ADD,步长值设为1.0 cM,PIN设为0.001,LOD阈值为 2.5,permutation为1 000次,Type I error为 0.05。在Wheat Omics 1.0(http://202.194.139.32/)网站上获得连锁标记在中国春基因组中的物理位置。
2 结果与分析
2.1 双亲及其RIL群体的白粉病抗性表现
2017年和2021年的白粉病苗期鉴定结果表明,感病对照品种京双16对白粉菌小种E09和E20的IT为3~4级,说明苗期白粉病发病充分,苗期接种有效;RIL群体的93个家系及其双亲对白粉菌小种E09和E20的反应型均为3~4级,表明该群体的白粉病抗性不属于苗期抗性或全生育期抗性。
2019-2020和2020-2021两年度郑州点和原阳点的田间试验中,感病对照品种京双16在4个环境下的MDS均在80%以上,说明白粉病发病充分。93个家系在4个环境下的平均MDS变化幅度分别为0.5%~70.0%、3.0%~90.0%、3.0%~87.5%和0.0%~80.0%,均呈现出连续性变异(图1),表明RIL群体的白粉病成株抗性属于数量性状。亲本UC1113在4个环境下的白粉病MDS介于1.0%~7.5%之间,而Kofa在4个环境下的MDS较高,在45.0%~70.0%之间。可以看出,在所有环境中UC1113的MDS均小于Kofa,说明UC1113的白粉病抗性优于Kofa。
2.2 RIL群体白粉病MDS在不同环境间的相关性
相关性分析结果(表1)显示,4个环境中除了2019―2020年度郑州点和原阳点的白粉病MDS的相关系数为0.473外,其余环境间白粉病MDS的相关系数均在0.500以上,说明白粉病MDS在不同环境间的相关性较高,表型鉴定的结果可靠。方差分析结果(表2)显示,不同区组间白粉病MDS存在极显著差异,说明本研究中设置区组有效的降低了试验误差,试验设计合理。此外,基因型、环境以及基因型和环境互作对白粉病MDS的影响均达到极显著水平,说明这三者共同影响材料的白粉病抗性。RIL群体白粉病MDS的遗传力为0.91,说明白粉病成株抗性主要受基因型的影响。
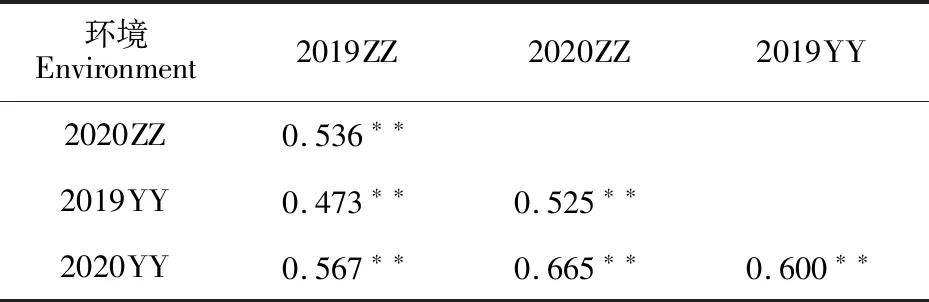
表1 “UC1113/Kofa”RIL群体白粉病MDS在4个环境间的相关性Table 1 Correlation of powdery mildew MDS for RIL population of “UC1113/Kofa”in four environments
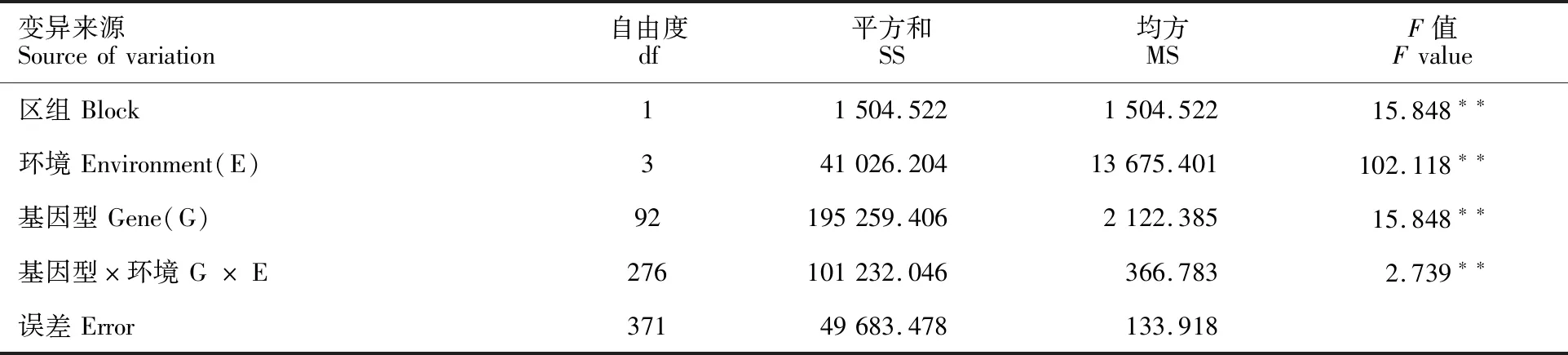
表2 “UC1113/Kofa”RIL群体白粉病MDS的方差分析Table 2 ANOVA of powdery mildew MDS for RIL population of “UC1113/Kofa”
2.3 白粉病成株抗性QTL的定位结果
采用完备区间作图法对RIL群体4个环境下2次重复的MDS及其平均MDS进行白粉病抗性QTL扫描,共定位到4个白粉病成株抗性QTL,即、、和(表3)。
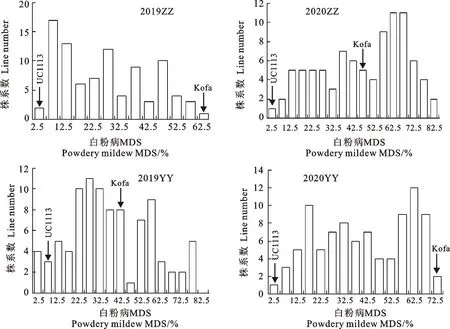
2019ZZ:2019-2020年度郑州点;2020ZZ:2020-2021年度郑州点;2019YY:2019-2020年度原阳点;2020YY:2020-2021年度原阳点。表1同。白粉病MDS数据为2次重复的平均值。2019ZZ:Zhengzhou in 2019-2020;2020ZZ:Zhengzhou in 2020-2021;2019YY:Yuanyang in 2019-2020;2020YY:Yuanyang in 2020-2021.The same in table 1.MDS values of powdery mildew were the mean of two repeats.图1 “UC1113/Kofa”RIL群体在4个环境下白粉病MDS的频率分布图Fig.1 Frequency distribution of powdery mildew MDS for RIL population of “UC1113/Kofa”in four environments
其中、和的加性效应为负值,表明其加性效应来自父本UC1113,而的加性效应为正值,表明其加性效应来自母本Kofa。
从表3和图2可知,在1A染色体上共检测到1个QTL,为,其位于标记区间BM140362_603-1A~wmc312,在2019―2020年度原阳点的重复II以及2020―2021年度原阳点2次重复的MDS平均值中被检测到,LOD值分别为4.02和2.64,表型贡献率分别为18.20%和12.16%。在4A染色体上共检测到2个QTL,分别为和,其中位于标记区间gwm265~wmc258,仅在2019―2020年度原阳点的重复I中被检测到,表型贡献率为 11.98%;位于标记区间wmc718~barc135,在2020―2021年度郑州重复I和重复II以及2次重复的MDS平均值中均可检测到,LOD值在2.79~5.24之间,表型贡献率范围为3.50%~20.27%。在5A染色体上共检测到1个QTL,为,位于标记区间barc151~BG607308_101-5A,在2020―2021年度郑州点重复II、原阳点重复I以及原阳点2次重复的MDS平均值中可检测到,LOD值在 2.69~3.75之间,表型贡献率范围为6.66%~ 10.83%。
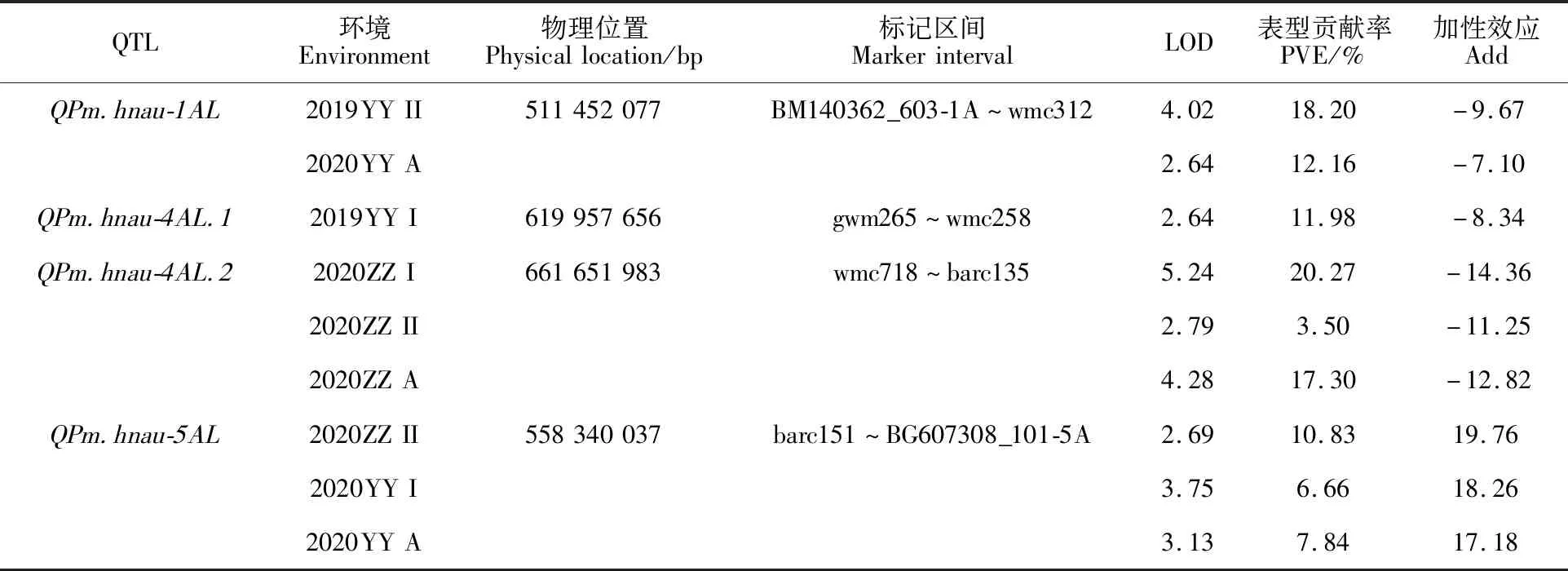
表3 “UC1113/Kofa”RIL群体白粉病成株抗性QTL定位结果Table 3 QTL mapping for powdery mildew resistance in RIL population of “UC1113/Kofa”
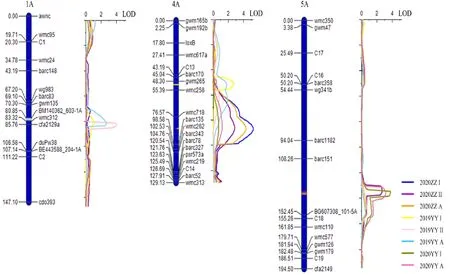
图2 “UC1113/Kofa”RIL群体白粉病成株抗性QTL在染色体上的分布Fig.2 Location of QTL for powdery mildew MDS on chromosomes in the RIL population of “UC1113/Kofa”
3 讨 论
本课题前期对四倍体硬粒小麦品系UC1113进行了多年的白粉病抗性鉴定,结果显示,UC1113在成株期对白粉菌流行小种E09和E20表现为高抗,且稳定遗传,而苗期则对白粉菌流行小种E09和E20表现为高感(未发表),因此,硬粒小麦品系UC1113属于典型的成株抗性材料。本研究RIL群体中93个家系的苗期鉴定结果也表明,所有家系在苗期均对E09和E20表现为高感,这也验证了该群体的白粉病抗性属于成株抗性。从QTL的定位结果看,亲本UC1113中聚合了3个白粉病成株抗性QTL,而Kofa中只检测到了1个白粉病成株抗性QTL,表明单个QTL的效应可能是微效的,但当品种中聚合3个及以上的抗性QTL时,品种的白粉病抗性可以达到较高水平,这和前人的研究结果是一致的。因此,不断发掘白粉病抗源和抗性QTL,并在育种中聚合多个抗性QTL,是培育持久高抗小麦品种的有效手段。
前人报道中,1A染色体上正式命名的抗白粉病基因有3个,分别为来源于普通小麦或野生四倍体小麦的、黑麦的和野生一粒小麦的。本研究定位到的来自于四倍体硬粒小麦,所以该QTL与和不同。另外,介于分子标记SFR159和294D11-22之间,根据Guo等整合的小麦抗白粉病基因位置图谱,该基因位于1A染色体短臂近端粒处,而位于1A染色体长臂上,因此也不同于。Lan等在普通小麦百农64中定位到一个抗白粉病位点,该QTL位于SSR标记barc148和wmc550之间,位于1A染色体着丝点附近。此外,Keller等和Mingeot等用RFLP标记分别检测瑞士斯佩耳特小麦品种Oberkulmer和法国小麦品种RE714,在1A染色体上分别定位到抗白粉病位点和,分别位于psr121b~psr941M和cdo572b~bcd442的标记区间。基于已有的小麦分子标记图谱,发现前人定位到的这3个QTL(、和)与位置相近。然而,从来源上看,、和来自普通小麦或者斯佩耳特小麦,而来自于四倍体栽培种。因此,推测是一个新的白粉病成株抗性QTL。
Chen等将定位在4A染色体上的5B易位系片段,介于SSR标记gwm159和barc109之间,而和均定位于4A染色体长臂上,因此和与不同。此外,前人已报道的位于4AL染色体上的抗白粉病QTL中,、和位于4A染色体着丝粒附近,和分别位于SSR标记gwm4下游22 cM和37 cM处,而、和则位置相近,均位于4AL染色体末端附近。本研究检测到的白粉病成株抗性位点位于SSR标记gwm265和wmc258之间,基于小麦分子标记图谱,该位点与位置相近。但是,的抗性来自于瑞士普通小麦品种Foron,与来源不同。本研究检测到的位于分子标记wmc718和barc135之间,在下游30 cM左右,与已报道的3个位于4AL染色体末端的白粉病成株抗性QTL(、和)的遗传距离约为10 cM,表明可能与它们不同。因此,推测和是2个新的白粉病成株抗性QTL。
前人在小麦5AL染色体上已定位了6个抗白粉病QTL,分别为、、、、和。根据Li等整合的小麦成株抗性QTL图谱可知,上述6个QTL分别位于5AL染色体上的3个不同区段,其中位于SSR标记gwm666和barc319之间,与本研究检测到的的染色体位置相近,遗传距离在5 cM左右。而且是由四倍体小麦材料提供抗性,与来源类似。因此,和很可能是相同的QTL。
4 结 论
本研究利用完备区间作图法共检测到4个抗白粉病QTL,分别为、、和,单个环境下可解释总表型变异的3.50%~20.27%。其中、和来自于抗亲UC1113,且均为新的白粉病成株抗性QTL。UC1113及其抗性QTL可用于小麦白粉病的抗性改良。
