WAVE25 生物反应器对白细胞介素-12表达的工艺放大
2022-05-19乔磊郑彬彬杨盼盼陈文成闫乐乐王建刚吴明远
乔磊,郑彬彬,杨盼盼,陈文成,闫乐乐,王建刚,吴明远
康立泰生物医药(青岛)有限公司,山东 青岛 266000
细胞因子是调控机体免疫反应[1],激活先天免疫的重要因子[2],在诱导抗肿瘤免疫应答中发挥重要作用[3]。有研究发现,肿瘤细胞内白细胞介素-12(interleukin-12,IL-12)基因治疗可通过抑制血管生成,将肿瘤细胞停滞在G0 / G1 期,并诱导凋亡[4]。
IL-12 是由p35、p40 两个亚基共同组成的异源二聚体[5],是刺激T 细胞生长,促进CD8+T 细胞记忆性,诱导CD4+T 辅助细胞向Th1 细胞转化的重要介质,此外,IL-12 可通过诱导干扰素γ(interferonγ,IFNγ)和肿瘤坏死因子-α 的产生,降低IL-4 对IFNγ的抑制,负性调节IL-10,转化生长因子β1,从而促进免疫细胞肿瘤浸润,改善免疫抑制微环境[6-7]。已有研究发现,IL-12 对黑色素瘤、结肠癌、卵巢癌、乳腺癌等多种肿瘤具有抑制肿瘤生长,减少肿瘤转移的作用[8],并在多种动物模型中也具有明显的抗肿瘤作用[9-12]。2017 年,FDA 批准pIL-12 为治疗不可切除转移性黑色素瘤的罕见药[13]。因此,IL-12 作为肿瘤免疫基因治疗的候选基因受到越来越多的关注[14-17]。
本研究从Sartorius BIOSTAT B 10 L 生物反应器工艺放大到GE WAVE25 50 L 生物反应器,通过细胞生长、细胞代谢、蛋白质质量等对比研究分析,初步评估IL-12 表达工艺放大的可行性,为后续更大规模的商业化生产提供参考。
1 材料与方法
1.1 细胞株 CHO-DG44 细胞为本公司细胞库保藏。
1.2 主要试剂及仪器 CD opti-CHO AGT、F-68、LGlutamine 和CHO CD Efficient Feed B 均购自美国Thermo Fisher 公司;NaHCO3购自德国Merck 公司;标准品R201805001 为本公司实验室制备(来自BIOSTAT B 10 L 罐)并检测标定批次;10 L 生物反应器BIOSTAT B 和无菌接管机BioWelder®TC 购自德国Sartorius 公司;50 L 生物反应器WAVE25 购自美国GE 公司;生化分析仪Cedex 购自瑞士Roche 公司;细胞计数仪IC1000 购自中国上海睿钰生物科技有限公司;超高效液相色谱仪H-Class bio 购自美国Waters 公司;pH 计ST3100 购自美国奥豪斯公司。
1.3 反应器条件 细胞接种密度和活率、细胞培养温度、pH 控制、DO 控制两种反应器相同;初始培养体积和工作体积根据反应器设计进行线性放大计算获得;通气策略根据厂家推荐获得,同时根据DO实时值进行调节;搅拌转速参考厂家推荐转速,并根据每天细胞状态适当调整。两种反应器的具体条件见表1。

表1 两种反应器的条件Tab.1 Conditions of two bioreactors
1.4 补料策略
1.4.1 CHO CD Efficient Feed B 补加策略 从培养第3 天开始,每天补加培养终体积5%的CHO CD Efficient Feed B 至发酵罐中,共补加8 d,补料质量用天平定量,补料密度按1 g / mL 计算。
1.4.2 200 mmol / L L-Gln 补加策略 发酵第0 ~6天,根据生化分析仪检测L-Glutamine 剩余量,计算L-Glutamine 补加量,补加至当天L-Glutamine 终浓度2 mmol / L。发酵第7 ~12 天,根据生化分析仪检测L-Glutamine 剩余量,计算L-Glutamine 补加量,补加至当天L-Glutamine 终浓度3 mmol / L。
1.5 日常取样检测 发酵开始后每天取10 mL 细胞悬液,直接利用pH 计检测pH,用IC1000 细胞计数仪检测细胞密度和细胞活率,将细胞悬液130 × g 离心5 min,收集上清液,分装至1.5 mL EP 管中,取1管,用生化分析仪进行葡萄糖(Gluc)、乳酸(Lac)、谷氨酰胺(L-Gln)、铵根离子(NH4+)含量检测,留存5管作为留样备用。
1.6 理化分析
1.6.1 非还原型SDS-PAGE 取第0 ~12 天上清液,按3 ∶1 体积比加入供试品缓冲液(非还原型),于旋涡振荡器上充分混匀后,将供试品和标准品按预定顺序加入4.5%浓缩胶-10%分离胶胶孔中,上样蛋白总量10 μg 以上(避免供试品溢出至临近泳道,防止交叉污染和供试品损失)。上样完毕后,进行恒压电泳,初始电压为80 V,进入分离胶时调至120 ~140 V,整个跑胶时间约为100 min。电泳完毕后,染色,脱色,并拍照保存。
1.6.2 IL-12 含量检测 采用反相超高效液相色谱法(reversed phase ultra high performance liquid chromatography,RP-UPLC)。用PBS 配制0.5、0.4、0.3、0.2、0.1、0.05 μg / μL 标准品各100 μL,绘制标准曲线。取第7 ~12 天发酵上清液,经0.22 μm 滤膜过滤后备用。利用ACQUITY UPLC Protein BEH C4 Column,300 埃,1.7 μm 色谱柱,在Waters H-Class Bio 超高效液相色谱上进行检测分析。
1.6.3 原液等电点检测 打开冷凝水机预冷至15 ℃,在冷凝板上加2 mL 石蜡油或去离子水,取出胶,将胶表面完全擦干,放在冷凝板上,胶片下面不能有气泡。使用滤纸片或上样条对供试品和标准品进行上样,上样量约为20 μL,电泳到一半时上样条撤去。CleanGel for IEF 的运行条件:预电泳电压700 V、电流12 mA、功率8 W、时间20 min,上样电压500 V、电流8 mA、功率8 W、时间10 min,等点聚焦电压2 000 V、电流12 mA、功率14 W、时间90 min,电泳完成染色脱色,并对胶进行拍照保存。
1.6.4 原液肽图检测 取3 k 膜浓缩管,用50 mmol/L碳酸氢铵溶液充分透析,取标准品和原液约200 μg,4 ℃,13 000×g 离心20 min,加入200 μL 50 mmol/L碳酸氢铵,4 ℃,1 500 × g 离心20 min,重复上述操作,加入4 μL 1 μg / μL Trypsin,用50 mmol / L碳酸氢铵补足体积至100 μL,37 ℃反应20 h,加入1 μL 甲酸终止反应,液相色谱仪检测并记录色谱图。
1.7 收获标准 培养至第12 天或Countstar 全自动细胞计数仪(台盼蓝拒染法)检测细胞活率低于80%时收获。
2 结 果
2.1 两种反应器培养的细胞生长代谢的比较
2.1.1 活细胞密度及细胞活率 两种反应器培养的细胞生长变化趋势一致,培养第8 天进入平台期,最高活细胞密度均在1.3 × 107cells / mL 左右,见图1。细胞活率变化也一致,收获当天细胞活率均在80%以上,见图2。
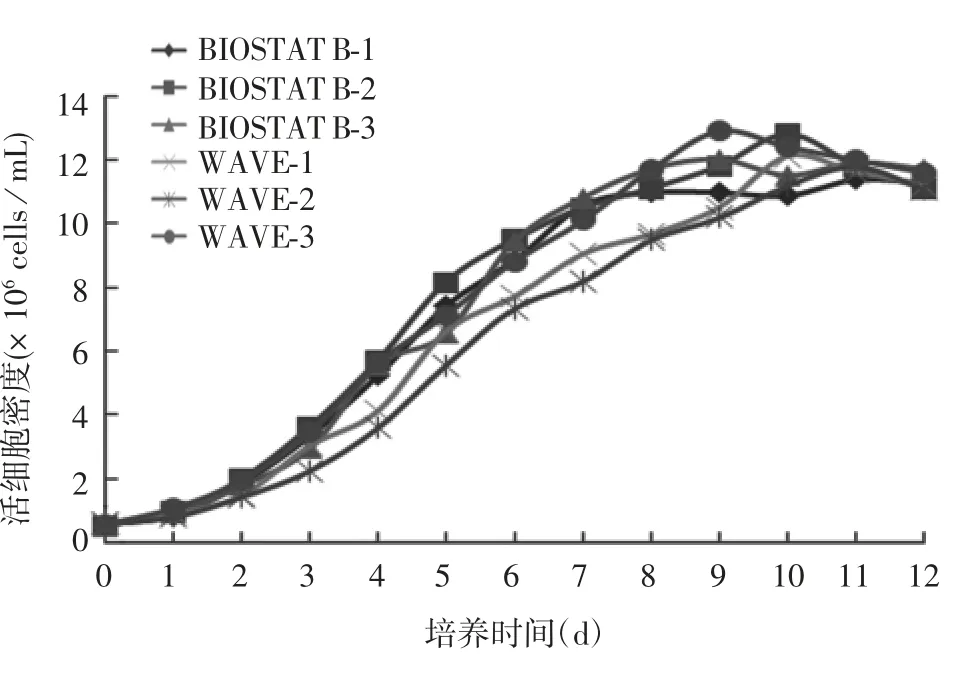
图1 两种反应器的活细胞密度曲线Fig.1 Viable cell density curves of two bioreactors

图2 两种反应器的细胞活率曲线Fig.2 Viability curves of two bioreactors
2.1.2 pH 与10 L BIOSTAT B 相比,50 L WAVE25 pH 曲线较快降低至6.85,这是两种反应搅拌方式和通气方式差异导致,但整体上pH 变化基本一致,且pH 值均在质量控制范围6.8 ~7.4 内,见图3。

图3 两种反应器的pH 曲线Fig.3 pH curves of two bioreactors
2.1.3 L-Gln 和NH4+整个培养过程中,两种反应器的L-Gln 曲线变化较一致,均呈现先降低后稳定在0.5 ~1.0 mmol / L 之间,见图4。NH4+浓度随培养时间的延长而累积,但二者全程均未超过14 mmol / L,远低于内控小于20 mmol / L 的要求,见图5。50 L WAVE25 后期NH4+浓度较高是由于不用混合系统的传质效率差异导致的。

图4 两种反应器的L-Gln 曲线Fig.4 L-Gln curves of two bioreactors

图5 两种反应器的NH4+曲线Fig.5 NH4+curves of two bioreactors
2.1.4 Gluc 和Lac 两种反应器Gluc 和Lac 变化趋势基本一致,Gluc 先降低,后期随着补料的加入又上升,见图6。Lac 前期升高,后期随着细胞的消耗降低,见图7。

图6 两种反应器的Gluc 曲线Fig.6 Glucose curves of two bioreactors

图7 两种反应器的Lac 曲线Fig.7 Lactate curves of two reactors
2.2 理化分析
2.2.1 非还原型SDS-PAGE 两种反应器在第10 ~12 天发酵上清液在标准品相对分子质量约70 000处有对应的目的蛋白条带,且两种反应器发酵上清液中均未见异常条带,见图8。

图8 两种反应器培养细胞上清液的SDS-PAGE 分析Fig.8 SDS-PAGE profiles of culture supernatants of cells in two bioreactors
2.2.2 IL-12 含量 RP-UPLC 分析显示,两种反应器IL-12 蛋白表达量稳定,从第7 ~12 天蛋白表达量逐渐积累,收获时均在80 mg / L 左右,见表2。
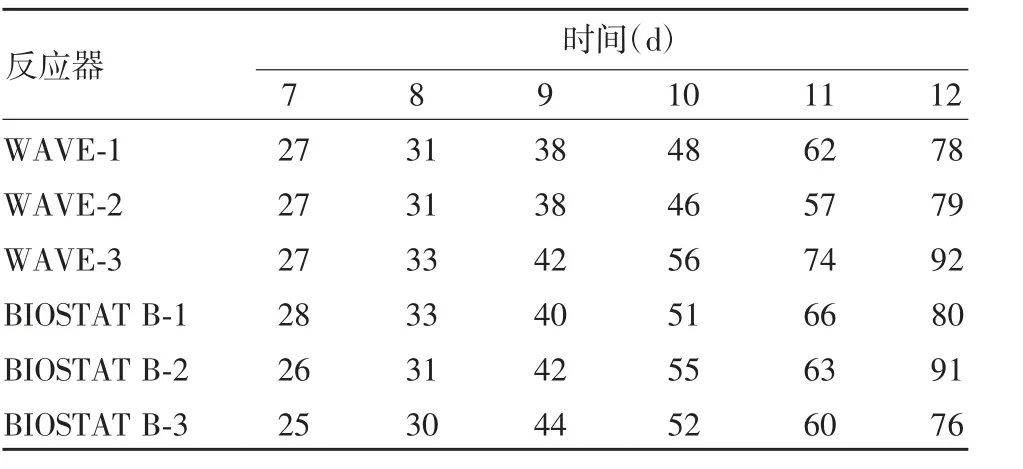
表2 两种反应器的IL-12 含量(mg / L)Tab.2 IL-12 contents expressed in two bioreactors(mg / L)
2.2.3 原液等电点 两种反应器各3 批次收获后纯化获得的原液,每批重复3 次上样,等电点均在4.6 ~5.0 之间,见图9。由于蛋白的等电点与其氨基酸序列和翻译后修饰相关,表明放大前后目的蛋白质量无显著差异,相对保持稳定。
2.2.4 原液肽图 放大后WAVE25 收获的目的蛋白肽图谱峰形、出峰时间、峰高与标准品比较均一致,表明放大前后目的蛋白的一级结构、蛋白修饰基团位点和修饰所占比例等质量均无显著差异,保持了较好的一致性。见图10 和图11。

图10 BIOSTAT B 肽图Fig.10 BIOSTAT B peptide map

图11 WAVE25 肽图Fig.11 WAVE25 peptide map
3 讨 论
本研究在不同规模,不具有几何相似性的两种反应器上初步探索了10 L 到50 L 放大的可行性,放大过程保持部分体积依赖性参数,如初始培养体积、补料体积等进行适当的比例放大。部分体积非依赖性参数,如初始接种密度、培养温度、溶氧、pH等放大前后保持不变。研究结果表明,50 L 与10 L反应器的细胞活率、密度及Gluc、Lac、L-Gln 和NH4+等代谢参数基本一致。其次,目的蛋白终产量均在80 mg / L 左右,SDS-PAGE 条带一致性良好,相对分子质量大小符合预期(70 000 左右)。最后,不同反应器所得原液等电点均在4.6 ~5.0 之间,多批次间肽图均与标准品肽图相符,表明目的蛋白质量一致性良好。
当前业内工艺放大的方法通常是等P / V、等Kla或经验放大方法,这些方法通常要求放大前后反应器具有几何相似性,从而更好地计算放大前后相应的控制参数。接种反应器前一代种子的高密度、高活率、稳定生产性能成为过程控制的关键,而接种反应器前一代种子通常通过WAVE 灌流获得,本研究从BIOSTAT B 10 L 放大到WAVE 50 L,目的蛋白的产量和质量均未发生显著变化,这为后续高密度接种提供了参考。
综上所述,本研究采用经验放大法对不具有几何相似性的两种反应器放大的可行性进行了初步探索,结果表明,该表达工艺能够进行规模性放大,为后续高密度接种发酵及更大规模的商业化生产提供了参考。
