丝素-壳聚糖支架对骨髓间充质干细胞黏附、增殖和成骨分化的影响
2022-05-09丘雨蓓李德雄陈江
丘雨蓓, 李德雄, 陈江
口腔临床中常面临各种原因造成的颅颌面骨组织缺损或骨量不足。随着生物材料研究的进展,越来越多的研究将注意力集中在人工合成的骨修复材料上[1]。近年来,天然高分子材料因其来源广、加工性能好、组织相容性佳等优点备受研究者的关注。壳聚糖(chitosan, CS)是目前发现的唯一与细胞外基质糖胺聚糖化学结构相似的多聚糖,具有良好的亲水性和抗菌性[2]。但CS降解速度过快,机械强度低,一般不单独用于制作三维支架,而常与其他材料混合使用。丝素蛋白(silk fibroin, SF)是一种天然纤维蛋白,具有良好的力学性能,含有α-螺旋、无规则卷曲和β-折叠三种结构,与骨组织中的胶原蛋白结构相似但却无明显的抗原性[3]。当SF的α-螺旋和无规则卷曲转变成稳定的β-折叠结构时,能明显降低其水溶性。研究发现,CS溶液和SF溶液混合后会促进β-折叠形成,降低材料的降解速率,提高机械性能,并能保留两种材料的优点[4]。本研究拟采用SF和CS为原材料制备三维多孔支架,检测骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)在该材料上的黏附、增殖及成骨分化,探讨其作为骨修复材料的可能。
1 材料与方法
1.1 SF-CS支架制备 将2 g CS粉(美国Sigma公司)溶解于100 mL 0.2 mmol/L乙酸溶液,磁力搅拌至CS完全溶解。将2 g的SF粉(实验组前期制备)溶解于100 mL去离子水中。将制备好的SF溶液和CS溶液按体积比3∶1比例混合,搅拌均匀后倒入24孔板中并置于-20 ℃冰箱冷冻。24 h后放入预冷好的真空冷冻干燥机(FD-1E-50,北京博医康实验仪器有限公司)中干燥(-54 ℃,80 Pa)后用无水乙醇室温交联6 h。去离子水完全置换无水乙醇后再次冷冻干燥24 h,最终得到SF-CS支架。
1.2 SF-CS支架物理性能表征
1.2.1 支架表面形貌和孔径检测 将SF-CS支架用导电胶固定于检测圆台上,表面喷金处理,室温下扫描电子显微镜(scanning electron microscopy,SEM,QUANTA450,美国FEI公司)观察其表面形貌特征,并随机测量3个样本共75个孔径,计算孔径平均值。
1.2.2 支架孔隙率和吸水率检测 采用无水乙醇检测支架的孔隙率。在量筒中装入10 mL无水乙醇(V1),将底面积为2 cm2、高为1 cm的SF/CS复合材料放入量筒中,待充分浸泡后,记录此时的乙醇体积为V2;取出材料后,剩余的乙醇体积记录为V3,计算材料的孔隙率(共检测10个样品):
孔隙率(%)=[(V1-V3)/(V2-V3)]×100%
采用磷酸盐缓冲液(phosphate buffered saline,PBS)检测材料的吸水率。将材料浸入PBS溶液中,待完全溶胀后取出,去除表面水分,称质量,记录湿态支架的质量为W1,后将材料置于65 ℃烘箱中完全烘干,称质量,记录干态支架的质量W2,计算支架的吸水率:
吸水率(%)=[(W1-W2)/W2]×100%
1.2.3 支架力学性能测量 制备高1.0 cm、直径1.5 cm样品,室温下采用万能材料试验机(中国岛津公司)检测SF-CS支架湿态下(PBS为浸泡液体)的压缩强度,载荷0.1 kN,加载速度为 1 mm/min,压缩量为80%,每组测量10个样本,计算平均值。
1.3 细胞接种 将SF-CS支架切成厚度为1 mm的圆片,环氧乙烷灭菌后放入24孔板中。每孔加入1 mL完全培养基(L-DMEM培养基+10% FBS+1%青/链霉素)浸润2 h后,每个样本接种5×104个BMSCs。对照组将相同数量的BMSCs直接接种于24孔板中。将孔板放置于37 ℃、体积分数为0.05的 CO2培养箱中,每3 d更换1次培养基。所有细胞实验均重复3次,每组3个样本。
1.4 细胞黏附 细胞培养1 d后,光镜下观察对照组细胞的黏附形态,SEM观察实验组细胞的形态。去除培养基,PBS轻轻冲洗,每孔加入1 mL 4%多聚甲醛室温固定15 min,PBS清洗3次,梯度乙醇脱水(30%、50%、70%、80%、90%、95%、100%),每次10 min;CO2临界点干燥,样本表面喷金,采用SEM观察细胞在材料上的黏附情况。
1.5 细胞增殖 细胞培养1、3、7 d后采用CCK-8法检测细胞增殖。去除原培养基,每孔加入50 μL CCK-8和 500 μL完全培养基,37 ℃孵育 2 h后,每孔吸出100 μL加入新的96孔板种,酶标仪(美国Bio-Rad公司)测量450 nm波长处吸光度值OD。
1.6 细胞成骨分化相关基因表达检测 细胞接种方式同1.3。细胞培养24 h后去除原培养液,更换成含成骨诱导液的完全培养基(完全培养基+10 mmol/Lβ-甘油磷酸钠+0.1 μmol/L地塞米松+50 mg/L维生素 C),每 3 d更换1次培养液。细胞成骨分化诱导7 d后,采用TRIZOL法(美国Invitrogen公司)及RNA提取试剂盒(日本TaKaRa公司)提取细胞的总RNA,将RNA逆转录(ABI 2720,美国Thermo Fisher Scientific公司)成cDNA,实时荧光定量PCR(quantitative realtime PCR, qPCR)检测实验组和对照组细胞Runt相关转录因子-2(runt-related transcription factor-2,Runx-2)、碱性磷酸酶(alkaline phosphatase,ALP)及骨钙素(osteocalcin,OC)基因的表达水平。实验以甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)为内参,采用 2-ΔΔCt法计算各组基因的相对表达量。引物序列见表1。

表1 成骨基因引物序列Tab.1 The primer sequences for osteogenic genes
1.7 统计学处理 采用SPSS 22.0软件进行统计处理,采用独立样本t检验进行组间差别比较。P<0.05 为差别有统计学意义。
2 结 果
2.1 SF-CS支架的结构特征 SF-CS支架物理形貌如图1所示。所获得的样本为白色海绵状圆柱体,与24孔板外形一致。SEM下,支架呈三维多孔结构,孔径为(251.16±69.85) μm。孔隙率和吸水率分别为(89.10±2.74)%和(280.25±9.07)%,压缩强度为(0.54±0.07) mPa。

SF-CS:丝素-壳聚糖。A~C:支架外观;D~E:支架表面形貌扫描电镜观(D: ×40;E: ×400)。图1 SF-CS支架形貌特征Fig.1 The morphology characters of SF-CS scaffold
2.2 SF-CS支架对细胞黏附的影响 SF-CS支架三维多孔结构对细胞黏附形态产生了明显的影响。对照组BMSCs呈纺锤多角状,紧贴培养皿底面呈二维生长(图2A)。实验组细胞贴附在SF-CS支架孔壁上,并沿着孔壁外形呈三维方向生长,细胞胞体变形和拉伸明显,部分细胞伸出细长的伪足黏附到远处的孔壁上,细胞胞体呈悬空状(图2B)。

SF-CS:丝素-壳聚糖;BMSCs:骨髓间充质干细胞。A: BMSCs在培养皿中的黏附形态( ×100);B:BMSCs在SF-CS支架上的黏附形态扫描电镜观( ×2 500,箭头所指为BMSCs)。图2 BMSCs黏附形态Fig.2 The cell adhesion and morphology of BMSCs
2.3 SF-CS支架对BMSCs增殖能力的影响 两组细胞的增殖趋势良好。随着培养时间的增加,细胞数量均明显增加。在各个检测时间点,实验组的细胞增殖均高于对照组,差别有统计学意义(P<0.05,图3)。
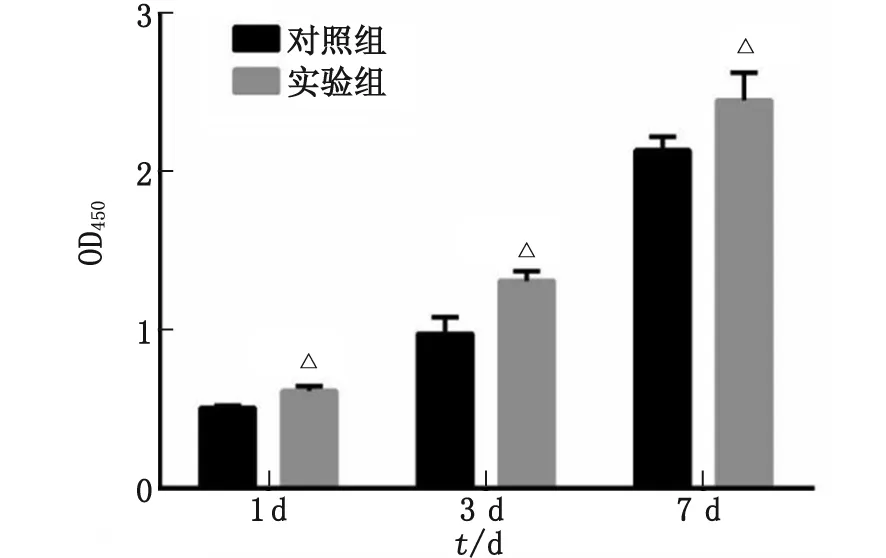
与对照组比较,△:P<0.05。图3 骨髓间充质干细胞在不同时间点的增殖情况Fig.3 The cell proliferation of bone mesenchymal stem cells for different culture period
2.4 SF-CS支架对BMSCs成骨分化相关基因表达的影响 实验组和对照组细胞成骨分化诱导7 d后,qRT-PCR检测结果显示,SF-CS支架上培养的细胞成骨分化相关基因Runx-2、ALP及OC的mRNA表达水平均高于对照组,差别有统计学意义(P<0.05,图4)。

Runx-2:Runt相关转录因子-2;ALP:碱性磷酸酶;OC:骨钙素。与对照组比较,△:P<0.05。图4 骨髓间充质干细胞成骨分化相关基因表达水平Fig.4 The osteogenic gene expressions level in bone mesenchymal stem cells
3 讨 论
理想的骨修复支架材料应具有良好的加工性能,当填充在骨缺损及骨量不足区域时,能为新骨的生长提供三维空间,同时具有一定的孔径和孔隙率,能为组织细胞的黏附、生长及分化提供微环境。本研究通过冷冻干燥法制备了SF-CS支架,在扫描电镜下,SF-CS支架呈现三维多孔形貌,孔径和孔隙率与人体骨组织(50~300 μm,75%~90%)相似,具有一定的机械强度,能满足非承重区如牙槽骨缺损骨修复支架的物理性能要求。
BMSCs是骨愈合过程中最重要的细胞,它的高度自我复制能力和多向分化潜能使其成为组织再生研究中应用得最为广泛的种子细胞。细胞在材料表面的黏附是细胞-材料相互作用的第一步,也是细胞实现增殖、迁移、分化等行为的基础。材料表面是否有利于细胞的黏附和生长,是评价材料生物性能的一个重要指标[5]。本研究中,BMSCs在SF-CS支架上具有良好的黏附能力,支架的三维多孔结构明显影响了细胞的黏附形态,细胞沿着孔壁外形铺展,并伸出细长伪足黏附至远处孔壁。研究发现,丝状伪足是细胞发生迁移的重要途径[6],说明SF-CS支架具有良好的生物相容性,有利于细胞的黏附和迁移。
BMSCs在材料上呈现出良好的增殖趋势,CCK-8检测结果表明,BMSCs在SF-CS支架上的增殖率高于二维平面培养的对照组,与既往的研究结果相似[7]。在细胞的成骨分化检测中,实验组BMSCs 成骨分化相关基因Runx-2、ALP及OC的表达水平较对照组细胞上调。Runx-2及ALP是BMSCs成骨分化早期的重要标志,OC是BMSCs成骨分化晚期的重要标志,这些结果说明SF-CS支架能促进BMSCs的成骨分化。以往研究表明,细胞外基质的微纳形貌会对细胞功能产生巨大的影响[8-9]。相对于二维平面生长的对照组细胞,细胞在SF-CS三维支架上沿着多孔结构呈立体生长,铺陈面积大,胞体更为拉伸。细胞形态的变化会导致细胞骨架发生形变,这种形变能直接产生力学刺激并通过细胞膜上的相关蛋白传递到细胞内部,激活下游一系列信号通路,如MAPK通路、β-catenin通路等,从而对细胞增殖及分化等生物学行为产生影响[10]。ZHANG等[11]发现,BMSCs具有更为拉伸的细胞形态和更大的细胞铺展面积时,有利于成骨向分化。
综上所述,本研究通过冷冻干燥法制备的三维多孔SF-CS支架利于BMSCs黏附,促进其增殖和成骨分化,提示该材料具有作为骨修复材料的潜能,后续将进行体内实验进一步验证该材料的成骨性能。
