术后肠梗阻炎症进展中NR4A1、MAPK及IL-6表达变化的分析
2022-05-09魏永张俊榕潘杰翁宗奇陈先强
魏永, 张俊榕, 潘杰, 翁宗奇, 陈先强
术后肠梗阻(postoperative ileus, POI)是外科术后常见的并发症,发生率为10%~30%[1-2]。POI的发病机制比较复杂,至今尚未完全阐明,其中炎症反应是POI的主要机制。丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)14和MAPK3是炎症反应中最重要的激酶之一,参与炎症反应的发生、发展并发挥调控作用。NR4A1(nuclear receptor subfamily 4, group A-1)是孤核受体家族之一,是免疫稳态的重要调节因子。多种细胞外刺激因素,如缺氧、炎症、细胞应激等可诱导NR4A1快速表达[3-4]。已有研究表明,NR4A1作为一种响应蛋白,在信号传导的早期发挥作用,可调控MAPK激酶和炎症因子的表达,从而参与炎症反应[5-6]。本研究拟建立大鼠POI模型,检测NR4A1、MAPK14、MAPK3和白细胞介素6(interleukin, IL-6)的表达,探讨NR4A1调控POI炎症反应的可能机制。
1 材料与方法
1.1 材料
1.1.1 动物 18只健康雄性SD(Sprague-Dawley)大鼠,体质量(180±20) g,福建医科大学实验动物中心[动物批号:SCXK(闽)2016-0002]饲养(普通饲料饲养,温度20~26 ℃,湿度40%~70%)。本研究已获得福建医科大学实验动物委员会批准。
1.1.2 主要试剂 CytosporoneB (CAS321661-82-5,美国Glpbio公司);NR4A1(DF7850,江苏Affinity公司);MAPK14(别名p38α, ab170099,英国Abcam公司);MAPK3(别名ERK1,16443-1-AP,美国Proteintech公司);IL-6酶联免疫吸附试验ELISA(MM-0190R1,武汉Elabscience公司);TUNEL检测试剂盒(C1088,上海碧云天公司)。
1.2 方法
1.2.1 POI造模 大鼠术前禁食12 h,可饮水。2%戊巴比妥钠(50 mg/kg)腹腔注射麻醉。麻醉后四肢固定于手术台上,腹部备皮后碘伏消毒铺巾。做下腹部正中线长约3 cm切口,依次切开皮肤、腹壁肌肉后进腹。取出全部小肠外置于两层湿纱布间,用盐水湿纱布由小肠末端自下而上擦拭肠管至幽门环,反复6次,用时10 min,期间注意防止损伤肠系膜血管。将全部肠管放回腹腔,注意理顺小肠,防止其扭转。1-0丝线分层连续缝合肌肉及皮肤关腹。假手术组大鼠腹部只做进腹和关腹处理。动物麻醉清醒后禁食不禁水,注意保温。
1.2.2 动物分组 将18只SD大鼠数字随机分成3组:假手术组、模型组(POI模型)和激动剂组(POI模型+CytosporoneB),每组6只。激动剂组大鼠术前1 h腹腔注射CytosporoneB (13 mg/kg);假手术组和模型组大鼠术前1 h腹腔注射同等剂量磷酸盐缓冲液。饲养48 h后大鼠进行1 mL墨汁灌胃处理,灌胃后30 min麻醉各组大鼠,开腹观察小肠形态,测量小肠推进率,取腹主动脉血液和距离盲肠10 cm的一段回肠组织样本做相关指标检测。
1.2.3 腹腔内小肠形态情况 打开腹腔,肉眼观察小肠形态情况,包括肠管有无积气、积液、充血、水肿。
1.2.4 小肠推进率测量 将不同组大鼠处死后取出整段小肠(保留胃、盲肠),测量小肠长度L1及幽门到墨汁最远处的距离L2,计算小肠推进率:
小肠推进率=(L2/L1)×100%
1.2.5 组织病理学检查 将肠组织固定于4%甲醛溶液,乙醇脱水、石蜡包埋、切片,苏木精-伊红(hematoxylin and eosin, H-E)染色。采用光学显微镜观察肠道组织的病理改变。
1.2.6 TUNEL法检测细胞凋亡情况 石蜡切片预处理准备、烤片、脱蜡、水化、修复、洗涤,加TUNEL检测液、封片镜检。
1.2.7 免疫组织化学检测NR4A1表达 石蜡切片烤片、脱蜡、水化、修复、洗涤、一抗NR4A1(1∶100)磷酸盐缓冲液浸洗玻片,辣根酶标记山羊抗兔IgG(H+L)(1∶100),磷酸盐缓冲液充分淋洗。DAB显色、苏木精复染、盐酸酒精分化、返蓝、脱水、透明、封片、镜检。
1.2.8 免疫荧光检测MAPK14和MAPK3表达 石蜡切片包埋、切片脱腊水化、抗原修复、通透、封闭、一抗孵育MAPK14 (1∶150)和MAPK3 (1∶50)、荧光二抗cy3 (1∶150)、复染核、封片。
1.2.9 ELISA法检测IL-6水平 取大鼠血液及回肠组织样本进行处理,分离血浆,采用双抗夹心法加样、加酶、温育,覆膜置于37 ℃温箱60 min,配液,洗涤,甩干,洗涤5次,拍干,加入显色剂,37 ℃避光显色,加终止液,酶标仪分析。
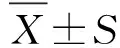
2 结 果
2.1 免疫组织化学检测肠组织中NR4A1蛋白表达情况 假手术组中可见大量NR4A1蛋白,呈棕黄色。与假手术组比较,模型组中的棕黄色程度明显减少,仅少数阳性颗粒在细胞核中表达,NR4A1蛋白表达明显降低;与模型组比较,激动剂组中的棕黄色程度明显增加,NR4A1蛋白表达明显升高(图1)。

A:假手术组;B:模型组;C:激动剂组。NR4A1:孤核受体。图1 大鼠肠组织NR4A1表达Fig.1 Expression of NR4A1 in intestinal tissue of rats
2.2 肠组织病理形态学、细胞凋亡及小肠推进率情况
2.2.1 病理形态学 假手术组为正常的肠组织结构,无明显形态改变。与假手术组比较,模型组的肠组织水肿严重,细胞边界不清,具有大量炎性细胞浸润;与模型组比较,激动剂组的肠组织炎性浸润程度具有明显的改善(图2A)。
2.2.2 TUNEL检测细胞凋亡结果 与假手术组比较,模型组肠组织中细胞凋亡明显升高,差别有统计学意义(P<0.01);与模型组比较,激动剂组肠组织中细胞凋亡明显降低,差别有统计学意义(P<0.01,图2B)。
2.2.3 小肠推进率情况 与假手术组比较,模型组中小肠推进率显著降低,差别有统计学意义(P<0.000 1);与模型组比较,激动剂组小肠推进率显著提高,差别有统计学意义(P<0.000 1,图2C)。
DAPI:4,6-二脒基-2-苯基吲哚;Apoptotic cell:凋亡细胞;Merge:融合。Sham:假手术组;Model:模型组;Stimulator:激动剂组。A:病理H-E染色;B:细胞凋亡;C:小肠推进率。与Sham组比较,△:P<0.01,△△△: P<0.000 1;与Model组比较,△:P<0.01,△△△:P<0.000 1。图2 肠组织病理学检查、细胞凋亡及小肠推进率情况Fig.2 Pathological examination of intestinal tissue, apoptosis and small intestine propulsion rate
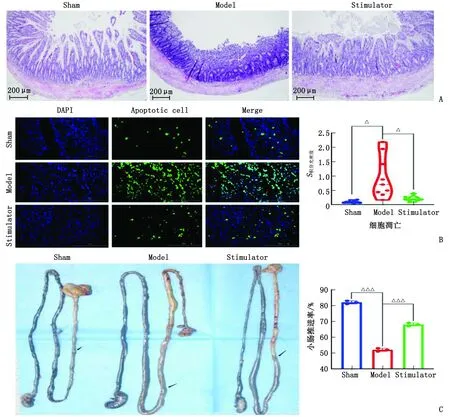
2.3 免疫荧光检测MAPK14和MAPK3的表达 与假手术组比较,模型组中MAPK14和MAPK3显著上调,差别有统计学意义(P<0.000 1);与模型组比较,激动剂组中MAPK14和MAPK3显著下调,差别有统计学意义(P<0.000 1)。MAPK14和MAPK3激活下可诱导炎症反应,NR4A1激动剂显著抑制MAPK14和MAPK3的表达,进而抑制炎症因子(图3)。

DAPI:4,6-二脒基-2-苯基吲哚;Merge:融合;MAPK:丝裂原活化蛋白激酶;ERK:细胞外调节蛋白激酶。Sham:假手术组;Model:模型组;Stimulator:激动剂组。A:MAPK14表达;B:MAPK3表达。与Sham组比较,△△△:P<0.000 1;与Model组比较,△△△:P<0.000 1。图3 肠组织MAPK14和MAPK3表达情况Fig.3 Expression of MAPK14 and MAPK3 in intestinal tissue
2.4 IL-6含量水平变化 与假手术组比较,模型组血浆和肠组织中IL-6含量升高,差别有统计学意义(P<0.000 1);与模型组比较,激动剂组血浆和肠组织中IL-6的含量降低,差别有统计学意义(P<0.000 1,P<0.001,图4)。
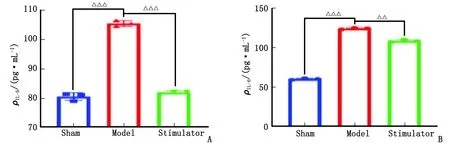
IL-6:白细胞介素6。Sham:假手术组;Model:模型组;Stimulator:激动剂组。A:血浆;B:肠组织。与Sham组比较,△△△:P<0.000 1;与Model组比较,△△:P<0.001;△△△:P<0.000 1。图4 血浆和肠组织IL-6含量水平Fig.4 IL-6 level of plasma and intestinal tissue
3 讨 论
POI是腹部外科手术后常见的并发症,与手术创伤程度、炎症反应、术后疼痛、阿片类药物、应激等多因素有关[7]。POI的主要临床表现为腹胀、恶心、呕吐、腹痛不明显及肛门停止排气、排便等症状。POI可导致患者推迟进食时间、延长住院时间、降低手术疗效及增加额外医疗费用等。虽然微创技术持续发展,手术方法也不断改进,但POI仍不可避免发生。
POI发生和发展的机制十分复杂,涉及多方面因素相互作用,分为早期阶段和持续阶段。POI的持续阶段主要是肠组织炎症反应作用,其持续时间与肠肌层炎症反应的程度呈正相关[8]。抑制炎症反应是防治POI最直接和最有效的方法。POI的炎症反应机制涉及多个信号传导通路共同作用。手术操作刺激胃肠道1 h即可激活细胞内MAPK14(p38α)、MAPK3(ERK1)、JNK/SAP等炎症反应相关的信号通路,引起一系列连锁反应,导致肠道部位的巨噬细胞和肥大细胞激活和核转录因子的活化,从而产生和释放大量IL-6、TNF-α及IL-1等促炎细胞因子和趋化因子,其中IL-6 在炎症反应中具有广泛的影响。IL-6等促炎因子激活中性粒细胞,引起肠道的炎症反应,最终导致POI的发生[9-11]。ZHU等[12]发现,结直肠癌术后发生POI患者的腹腔引流液中IL-6、TNF-α等炎症因子含量水平明显升高,腹腔炎症因子可预测POI的发生及持续时间。ZHANG等[13]发现,激活p38MAPK、ERK1/2信号通路可诱导细胞的炎症反应,抑制p38可降低IL-6和TNF-α表达水平,抑制ERK1/2可降低IL-6表达水平。WEHNER等[10]的研究表明,抑制小肠常驻巨噬细胞中p38信号通路可以有效预防POI。XIONG等[14]的研究发现,通过阻断p38/MK2信号通路可以有效地抑制小鼠POI中炎症因子表达,减少炎症细胞的浸润,从而减轻肠道炎症。因此,通过抑制MAPK信号通路,可以预防或减轻POI炎症反应,改善肠梗阻症状。
NR4A1属于孤核受体家族的重要一员,参与多种细胞过程,包括增殖、分化、凋亡、代谢和发育。NR4A1在免疫稳态、动脉粥样硬化、代谢类疾病、肿瘤的发生、发展等过程中扮演着重要角色[15-16]。最近有研究表明,NR4A1在炎症反应中具有负性调节作用[5-6,17]。NR4A1是一种磷酸化的蛋白。磷酸化可以调节NR4A1的活性,在刺激或炎症反应时可激活MAPK激酶,导致NR4A1的磷酸化。NR4A1处于失活状态,促进核因子NF-κB进入细胞核内,与 NF-κB位点结合,促进下游细胞因子IL-6、TNF-α释放大量炎症因子,进一步导致局部或全身炎症反应[18-19]。NR4A1在巨噬细胞和单核细胞中表达降低,而炎症因子(如IL-1和IL-6)表达升高[3-4]。HAMERS等[20]发现,NR4A1通过抑制p38MAPK和NF-κB表达而降低ET-1水平,ARDS大鼠肺组织中NR4A1表达明显降低,NR4A1激动剂CytosporoneB减轻了ARDS的炎症和损伤。ANOUK等[21]发现,小鼠结肠炎模型中敲除NR4A1基因,结肠炎症明显加重,激活NR4A1表达可减轻结肠炎症。本研究结果显示,大鼠POI肠组织中NR4A1表达明显降低,MAPK14、MAPK3及IL-6的表达显著升高;CytosporoneB激活NR4A1表达可显著降低MAPK14、MAPK3及IL-6表达,减轻肠组织的炎症和水肿,提高小肠推进率。
综上所述,大鼠POI肠组织中NR4A1低表达在炎症反应及POI进展中起着重要作用。激活NR4A1表达可减轻POI肠组织炎症和缓解梗阻症状,其作用机制可能与通过抑制MAPK信号通路有关。
