PERK-ATF4通路对增龄相关牙周膜干细胞成骨分化减弱的机制研究
2022-05-05张曦戈费栋栋王垭铮张杨王晓雨葛晓彤王勤涛
张曦戈 费栋栋 王垭铮 张杨 王晓雨 葛晓彤 王勤涛
牙周膜干细胞(periodontal ligament stem cells, PDLSCs)是从牙周组织分离的成体干细胞,具有增殖,自我更新以及多向分化等特性,在牙周组织再生领域具有广阔的应用前景[1-2]。成骨分化潜能是PDLSCs重要特性,然而,大量研究表明,老年个体来源的牙周膜干细胞(PDLSCs from the old,O-PDLSCs)成骨分化潜能显著降低,并已成为老年人牙槽骨骨质疏松的重要因素[3-7]。因此,对于增龄相关 PDLSCs成骨分化能力减弱的机制研究具有重要意义。
未折叠蛋白反应(unfolded protein response,UPR)是一种细胞维持蛋白质稳态的适应性反应。UPR主要由三个跨膜蛋白启动:蛋白激酶R样内质网激酶(protein kinase R like endoplasmic reticulum kinase,PERK),肌醇需要酶 1(inositol requiring enzyme 1,IRE1)和转录活化因子6(activating transcription factor-6,ATF6),UPR通过减少蛋白合成,上调分子伴侣的表达和促进错误折叠蛋白质的降解以恢复蛋白质稳态[8]。PERK-转录活化因子 4(activating transcription factor 4,ATF4)通路是UPR的经典通路之一,主要通过抑制蛋白质翻译以减轻内质网负荷[9]。有研究表明,衰老因素可影响PERK-ATF4通路,导致细胞功能改变[10-11]。此外,也有研究证实 PERK-ATF4通路对间充质干细胞的成骨分化具有重要调控作用[12-14]。但PERK-ATF4通路是否参与增龄相关PDLSCs成骨分化能力降低目前尚不可知。本实验拟探究PERKATF4通路对增龄性PDLSCs成骨分化能力的调控作用,以期为老年患者的牙周组织修复提供新思路。
1 材料与方法
本项研究经第四军医大学口腔医院伦理委员会的批准(批号:IRB-YJ-2018066),所有受试者均签署了知情同意书。
1.1 主要材料与仪器
α-最低必须培养基(Gibco,美国);胎牛血清(杭州四季青生物有限公司);青霉素链霉素、胰蛋白酶、茜素红染色液(北京索莱宝公司);Ⅰ型胶原酶(Bio-Froxx,德国);PERK基因过表达质粒(上海吉凯基因);PERK siRNA(Santa Cruz Biotechnology,美国);总RNA提取试剂 Trizol Reagent(Invitrogen,美国);cDNA反转录试剂盒和实时荧光定量PCR(qRT-PCR)试剂盒(TaKaRa,日本);YJ-875型超净工作台(苏州净化设备厂);实时荧光定量PCR仪(Bio-Rad,美国);倒置相差显微镜(Olympus,日本)。
1.2 PDLSCs的分离培养
Y-PDLSCs来源于15~30岁患者健康的第三磨牙及因正畸需要拔除的健康前磨牙,O-PDLSCs来源于55~75岁牙周无明显炎症的牙齿,所有患者均无系统性疾病,刮取离体牙牙根中1/3牙周膜,使用Ⅰ型胶原酶于37℃消化40~60 min,每间隔10 min震荡1次,组织碎片加入完全α-MEM培养基重悬,接种于六孔板中,在含5%CO2的37℃恒温孵箱中孵育。实验过程中使用第3~4代PDLSCs。
1.3 siRNA敲减PERK表达
将O-PDLSCs接种至六孔板,待细胞汇合90%~95%时转染,转染前2 h对细胞换液,加入1.5 mL无双抗无血清α-MEM培养基;将转染复合物和siRNA混合物混匀,室温静置20 min,500μL转染混合物加入六孔板中摇匀,置于37℃恒温细胞培养箱中,4~6 h更换α-MEM完全培养基。
1.4 PERK过表达
将Y-PDLSCs接种至六孔板,待细胞汇合90%~95%时转染,转染前2 h对细胞换液,加入1.5 mL无双抗无血清α-MEM培养基;将转染复合物和质粒复合物混匀,室温静置20 min,500μL转染混合物加入6孔板中摇匀,置于37℃恒温细胞培养箱中,4~6 h更换α-MEM完全培养基。
1.5 PDLSCs的成骨诱导
PDLSCs接种至6孔板中,待细胞汇合至80%时加入成骨诱导培养基(含10 mmol/Lβ-甘油磷酸钠、0.1μmol/L地塞米松、50mg/L维生素C、10%胎牛血清)。
1.6 茜素红染色
成骨诱导28 d后,弃培养基,PBS冲洗,4%多聚甲醛固定30min,PBS冲洗2遍,加入茜素红染液染色20 min,PBS冲洗2遍,置于镜下观察,每孔加入1 mL十六烷基吡啶,室温放置15min,酶联免疫检测仪检测540 nm波长的吸光度值。
1.7 实时荧光定量聚合酶链式反应(qRT-PCR)
Trizol提取PDLSCs总RNA,紫外分光光度仪检测RNA浓度及纯度,配比 20μL反转录体系(1000 ngRNA,4μL反转录预混液、ddH2O配平),反转录cDNA;配比10μL反应体系(1μL的 cDNA、0.4μL目的基因上下游引物、5μL的 SYBR、3.2μL的ddH2O),以GAPDH为内参。引物序列见表1。
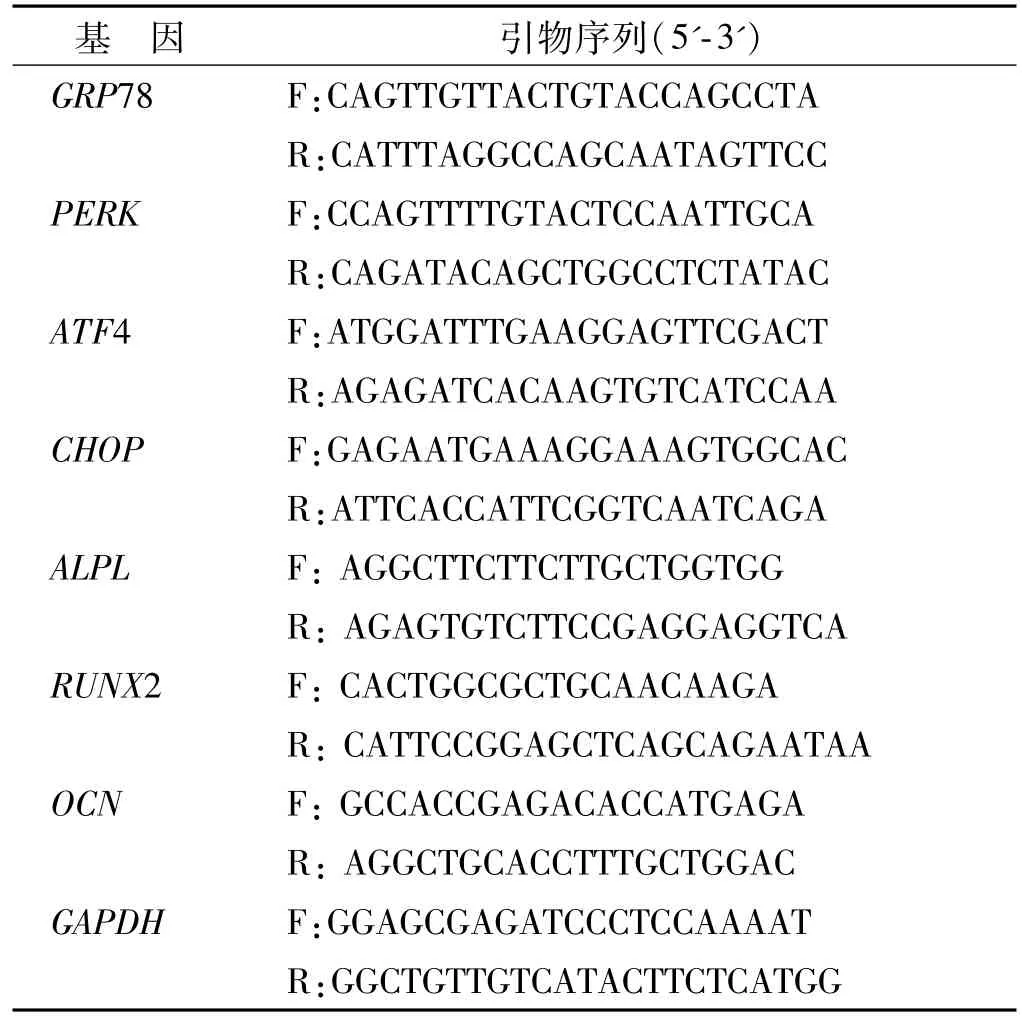
表1 引物序列Tab 1 Primer sequences
1.8 统计学方法
2 结 果
2.1 Y-PDLSCs和O-PDLSCs的成骨分化能力比较
成骨诱导7 d后,采用qRT-PCR检测成骨相关基因ALPL、RUNX2、OCN的mRNA表达水平,结果显示,与Y-PDLSCs相比,O-PDLSCs的成骨相关基因的mRNA表达水平均明显降低(P<0.05)(图 1A)。成骨诱导28 d后,茜素红染色结果显示,O-PDLSCs的矿化能力显著降低(图1B)。以上结果均表明,与YPDLSCs相比,O-PDLSCs的成骨分化能力降低。
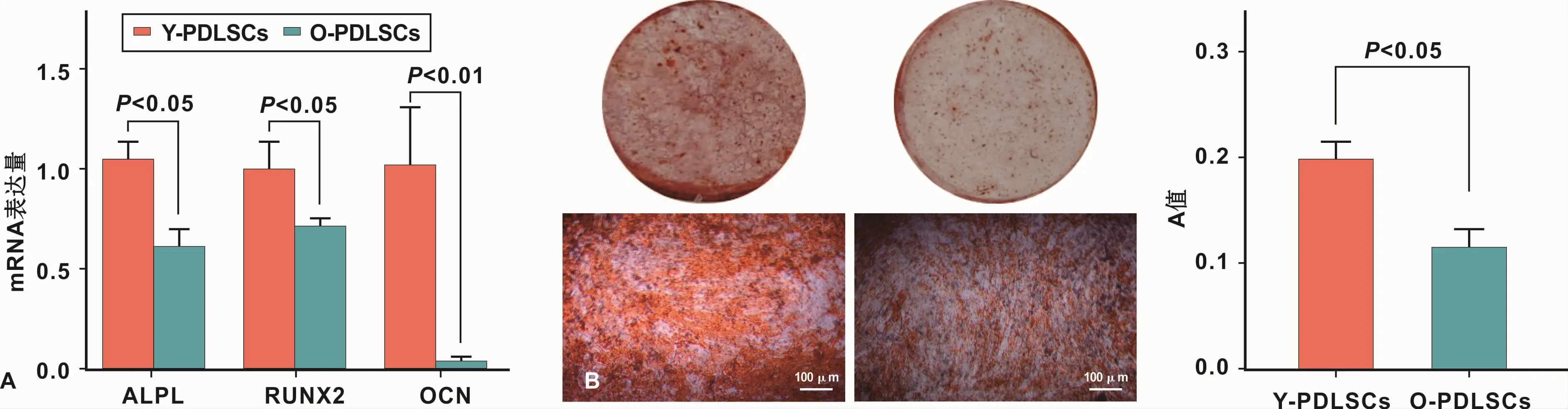
图1 Y-PDLSCs和O-PDLSCs的成骨分化能力比较Fig 1 Comparison of the osteogenic differentiation ability between Y-PDLSCs and O-PDLSCs
2.2 Y-PDLSCs和O-PDLSCs中PERK-ATF4通路相关基因的表达
qRT-PCR检测结果显示,与Y-PDLSCs相比,OPDLSCs的PERK通路相关基因GRP78、CHOP、PERK以及ATF4 mRNA表达水平均明显升高(P<0.05)(图2)。
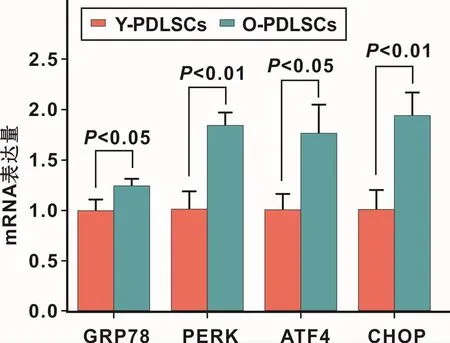
图2 PDLSCs中PERK通路相关基因的表达Fig 2 The expression of PERK pathway related genes of PDLSCs
2.3 抑制PERK-ATF4通路对O-PDLSCs成骨分化能力的影响
PERK siRNA转染O-PDLSCs后,qRT-PCR检测结果显示,PERK siRNA转染后,O-PDLSCs的PERK及PERK通路下游分子ATF4的mRNA表达水平均下降(P<0.05)(图 3A)。PERK siRNA可有效抑制O-PDLSCs的PERK-ATF4通路。
PERK siRNA转染O-PDLSCs后,进行成骨诱导。成骨诱导7 d后,qRT-PCR结果显示,抑制O-PDLSCs的PERK-ATF4通路后,成骨相关基因ALPL、RUNX2、OCN表达水平均升高(P<0.05)(图 3B)。成骨诱导28 d后,茜素红染色结果显示,抑制 O-PDLSCs的PERK-ATF4通路后,矿化结节形成数量明显增加(P<0.05)(图 3C)。以上结果均表明,抑制 PERK-ATF4通路后,O-PDLSCs的成骨分化能力升高。
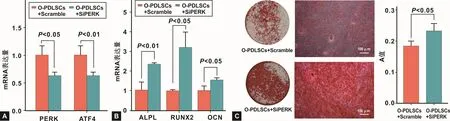
图3 敲低PERK对O-PDLSCs成骨能力的影响Fig 3 The effects of knockdown of PERK on the osteogenic ability of O-PDLSCs
2.4 激活PERK-ATF4通路对Y-PDLSCs成骨分化能力的影响
用PERK过表达质粒转染 Y-PDLSCs后,qRTPCR结果显示,Y-PDLSCs的PERK及ATF4的表达水平均明显升高(P<0.05)(图 4A)。PERK过表达质粒可显著激活Y-PDLSCs的PERK-ATF4通路。
PERK过表达质粒转染Y-PDLSCs后,进行成骨诱导。成骨诱导7 d后,qRT-PCR结果显示,激活YPDLSCs的PERK-ATF4通路后,成骨相关基因的mRNA表达水平均明显下降(P<0.001)(图 4B)。成骨诱导28 d后,茜素红染色结果显示,激活Y-PDLSCs的PERK-ATF4通路后,矿化结节形成数量减少(P<0.05)(图 4C)。以上结果均表明,激活 PERK-ATF4通路可降低Y-PDLSCs的成骨分化能力。
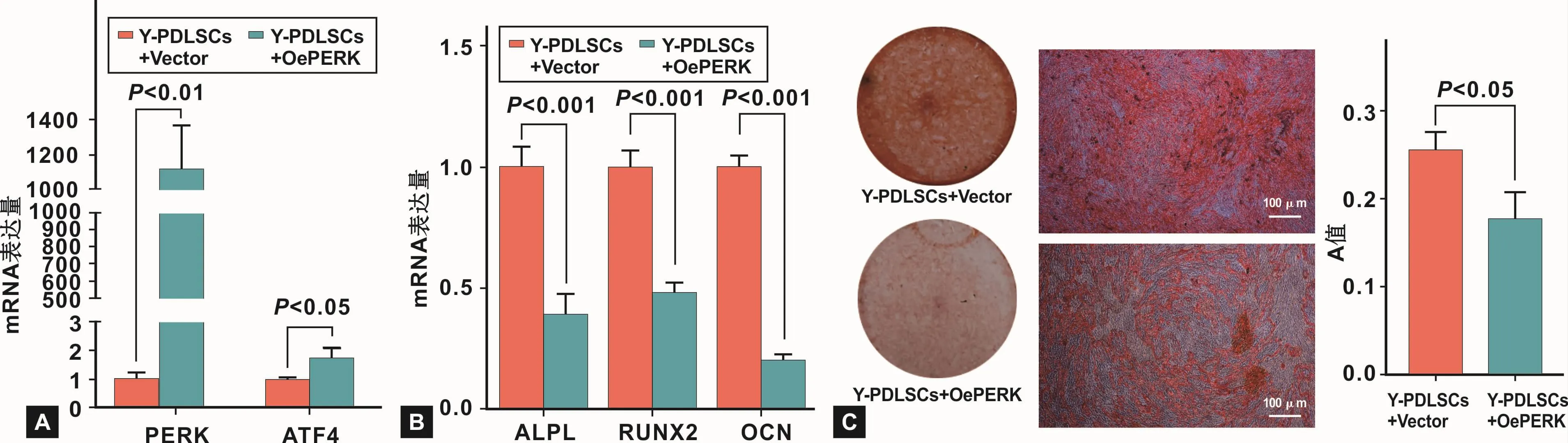
图4 过表达PERK对Y-PDLSCs成骨能力的影响Fig 4 The effects of overexpression of PERK on the osteogenic ability of Y-PDLSCs
3 讨 论
PDLSCs因其具有自我更新及多向分化潜能等特性,为牙周再生治疗提供了可靠来源。而增龄性因素对PDLSCs成骨分化的负向调控限制了其临床应用,并且是老年人牙槽骨骨质疏松的重要因素。有研究报道,不同年龄受试者PDLSCs的成骨能力随着年龄的增长显著降低[3]。本研究发现,相比于Y-PDLSCs,OPDLSCs的成骨相关分子ALPL、RUNX2、OCN在基因水平表达均降低,茜素红染色结果也证实O-PDLSCs的成骨能力显著降低。内质网应激 (endoplasmic reticulum stress,ERS)是指各种原因扰动细胞内稳态,使未折叠或错误折叠蛋白质在内质网腔内积累。UPR可减少细胞内未折叠或错误折叠蛋白的积累以减轻内质网应激[8]。内质网应激被认为是衰老的标志之一,参与了不同组织的衰老[15-17]。PERK-ATF4信号通路是 UPR的经典通路之一。在老年大鼠视网膜中,PERK-ATF4信号通路被激活,ATF4、CHOP表达水平升高[18]。此外,PERKATF4通路也参与调控PDLSCs的成骨分化。较高浓度的TNF-α通过激活PERK-ATF4通路减弱PDLSCs的成骨能力[14,19]。在老年小鼠原代骨细胞中,UPR相关分子 ATF4、CHOP表达升高,导致骨形成减少[20]。但PERK-ATF4通路是否参与增龄相关PDLSCs成骨能力降低目前尚不明确。本研究证实O-PDLSCs中PERK-ATF4通路被激活。并在激活或抑制 YPDLSCs,O-PDLSCs中 PERK-ATF4通路后,检测PDLSCs成骨能力的变化,证实了增龄性PDLSCs通过激活PERK-ATF4通路调控成骨分化能力。相反,也有研究报道,激活 PERK-ATF4通路有助于年轻PDLSCs的成骨分化[12]。另外,循环机械力作用可诱导内质网应激并通过激活PERK-ATF4通路增强PDLSCs的成骨能力[13]。这种差异可能是由于UPR激活程度不同或细胞来源不同以及细胞所处微环境不同导致的,其具体的调控机制需要更全面深入的探索。
综上,本研究证明了 PERK-ATF4通路在 OPDLSCs中激活并介导了增龄相关PDLSCs成骨能力的降低。本研究不仅为增龄相关PDLSCs成骨分化能力的降低提供了一种新的机制,也为老年患者的牙周再生提供了新思路。
