气肿疽梭菌pVAX1-NagH基因核酸疫苗的免疫效果评价
2022-05-05曲庭伟张文璇崔春梅姜人月鲍君铎赵仁双
曲庭伟, 张文璇, 崔春梅, 姜人月, 鲍君铎, 赵仁双, 金 鑫*
(1.延边大学 农学院,吉林 延吉 133002;2.上海市锐翌生物科技有限公司,上海201199)
气肿疽病,也称为黑腿病,“黑腿”即为气肿疽梭菌所引起的较为明显的临床症状,严格来讲,该病典型临床症状为患病动物丰满肌肉部位发炎、肿胀,施力触压时可听到类似捻发音[1]。该病常呈急性发病,潜伏期较短,病情发展迅速,甚至有一些动物在未出现明显症状时便死亡[2]。已经患有此病的动物和带菌动物是该病最主要的传染源,如患病动物的排泄物,或者外伤,都会造成食物、土壤、草料、饮水等的污染,从而导致该病的传播[1]。病原菌侵入机体的具体经过尚未有明确的阐述,但目前已知其主要的入侵途径有2种:1) 是经消化道黏膜破溃侵入机体;2) 进入血液后随血流到达机体内部造成感染[2]。经多位国外学者进行研究发现,气肿疽梭菌有以下几种毒力因子:细胞毒素CctA、鞭毛蛋白FliA、唾液酸酶NanA[3-6],此外,2017年Saroj K等研究表明,气肿疽梭菌的基因组中含有2种不同的透明质酸酶基因,可降解宿主体内称为透明质酸的结缔组织,即NagH和NagJ[7],并证明透明质酸酶参与降解细胞内基质和组织连接,从而使气肿疽梭菌及其毒素能够在感染的宿主中传播[7]。
气肿疽病病程发展较快,主要预防手段为定期注射疫苗[8]。其中,核酸疫苗较普通疫苗有免疫保护力强,免疫保护力较持久,易于储存和运输等优点[9]。根据前人成功试验经验[10-12],将pVAX1选做该次试验的表达载体,pVAX1作为哺乳动物细胞表达系统中高效表达目的基因的表达载体,大小为3.0 kb,是基于pcDNA3.1上重建得到的新型真核表达载体,用卡那抗性代替安苄抗性筛选基因,能有效降低人类基因组重组的可能,且pVAX1载体为非融合载体,其产生的蛋白在结构和功能上与天然存在的蛋白质几乎相同[13]。故该试验以气肿疽梭菌NagH基因和pVAX1载体为基础,构建pVAX1-NagH真核表达质粒,对BALB/c小鼠肌肉注射pVAX1-NagH核酸疫苗,以观察该核酸疫苗是否会诱导小鼠产生免疫应答。
1 材料与方法
1.1 菌株、细胞
延边株气肿疽梭菌、pVAX1载体、Vero细胞均于延边大学动物医学预防实验室保存。
1.2 主要试剂及引物
1.2.1 主要试剂
pMD18-T Simple载体,连接缓冲液SolutionI,购自宝日医生物技术(北京)有限公司;质粒无内毒素DNA大量提取试剂盒,购自上海莱枫生物技术有限公司;Mouse IgG1 ELISA KIT、Mouse IgG2a ELISA KIT、Mouse IL-4 ELISA Kit、Mouse IFN-γELISA Kit,购自杭州联科生物有限公司;LipofectamineTM6 000,购自上海碧云天生物技术有限公司;FITCRat Anti-Mouse IgG,购自艾美捷科技;DMEM低糖培养基(含葡萄糖,HEPES,青霉素和链霉素),购自北京索莱宝科技有限公司。
1.2.2 引物
为了方便后期真核表达载体的构建,在上游添加了Kozak序列(加粗部分)(表1)。

表1 引物核苷酸序列
1.3 实验动物
5周龄雌性BALB/c小鼠,24只,购自吉林亿斯实验动物中心。
1.4 方法
1.4.1 pVAX1-NagH真核表达载体的构建
对PCR阳性产物进行凝胶回收,并将凝胶回收产物与pVAX1载体连接。按照如下体系混和:目的基因NagH片段4 μL,载体1 μL,连接缓冲液Solution I 10 μL;16 ℃连接12 h;将连接物转化至50 μLTrans5α感受态细胞中,使用涂布棒,在超净工作台中将其均匀涂布在含有卡那抗性的LB固体培养基上,37 ℃培养12 h;挑取平板上清晰单个菌落,接种到液体LB培养基中,37 ℃、200 r/min震荡过夜,次日提取连接物的质粒,所得质粒进行PCR鉴定,并将鉴定为阳性的产物送往哈尔滨擎科嘉美生物科技有限责任公司进行测序。将测序正确的质粒保存于-20 ℃冰箱中备用。
1.4.2 重组质粒pVAX1-NagH的表达分析
1.4.2.1 重组质粒pVAX1-NagH的转染
在DMEM无双抗培养液中加入生长状态良好的Vero细胞进行传代,并将细胞转移至24孔细胞培养板中,在细胞生长至约铺满80%板底的时候进行转染。取3 μL LipofectamineTM6 000和97 μLOpti-MEM培养液混合均匀,制备成混合液1;取10 μL pVAX1-NagH质粒与90 μL Opti-MEM培养液,制备成混合液2,混合均匀后静置5 min。将混合液1和混合液2混匀后室温静置30 min。将DMEM无双抗培养液换成Opti-MEM培养液,对24孔板中的Vero细胞清洗2次。每孔加入500 μL的培养液(Opti-MEM), 37 ℃培养5 h后弃废液,最后在每孔中加1.5 mL DMEM低糖培养液,培养48 h。
1.4.2.2 IFAT检测NagH基因的表达
在转染后,丢弃培养液,PBS清洗3次,加入10%冷丙酮,固定10 min,再次用PBS缓冲液清洗2次,向各孔中加入500 μL稀释后的一抗(鼠抗气肿疽梭菌NagH),37 ℃静置90 min,用PBS缓冲液清洗3次。再向各孔中加500 μL稀释后的二抗(FITCRat Anti-Mouse IgG),37 ℃静置60 min,最后用PBS清洗3次。在荧光倒置显微镜下观察结果。
1.4.3 动物试验
24只5周龄雌性BALB/c小鼠随机分为3组,分别为pVAX1-NagH组,pVAX1组,PBS组进行免疫,该试验采用双侧股四头肌注射法进行免疫,方法为每间隔14 d免疫1次;分别在1免(0 d)前,2免(14 d)前,3免(28 d)前和所有免疫结束后进行尾静脉采血,分离血清。免疫策略见表2。
1.4.3.1 检测小鼠血清中IgG的指标水平
取100 μL用ELISA包被液(碳酸盐缓冲溶液)稀释的NagH抗原(25 μg/mL)加入到96孔板中,4 ℃静置过夜;弃废液后每孔加入150 μL PBST进行洗板,每5 min重复1次,共重复3次;使用含2%脱脂乳的PBST封闭液,进行封闭,37 ℃避光静置2 h;将待测血清100倍稀释后,每孔加100 μL,37 ℃避光静置1 h,结束后进行3次洗板;将HRP Rat Anti-Mouse IgG与PBS缓冲液按照1∶5 000的比例混合稀释,每孔加入100 μL,37 ℃避光静置1 h,结束后进行3次洗板;每孔加100 μL OPD显色液,室温避光15 min;每孔加50 μL终止液,参考以往成功试验[10-11]的酶标仪波长条件,使用酶标仪在450 nm波长条件下测定其OD值。
1.4.3.2 检测小鼠血清中IgG1、IgG2a、IFN-γ、IL-4的指标水平
按照相应ELISA检测试剂盒说明书中的步骤进行操作,检测小鼠血清中IgG1、IgG2a、IFN-γ、IL-4水平。
1.4.4 统计学方法
该试验采用GraphPad Prism软件进行数据分析及图表绘制。P<0.05表示具有显著性差异。
2 结果与分析
2.1 IFAT检测NagH基因的表达
转染后进行间接免疫荧光检测,结果显示转染了质粒的Vero细胞在显微镜下有绿色荧光出现,而另外2组细胞在镜下均无荧光。说明pVAX1-NagH质粒中的NagH基因能够在Vero细胞中稳定表达(图1)。

A: pVAX1-NagH(200×); B: pVAX1对照组(200×); C: 正常细胞对照组(200×)
2.2 免疫效果评价
2.2.1 小鼠血清中IgG指标变化
应用间接ELISA检测方法来测定血清中IgG水平,可见pVAX1-NagH组在第1次免疫后,抗体水平持续上升,且显著高于其他2组(P<0.05),而pVAX1组和PBS组之间则无显著性差异(P>0.05)(图2)。
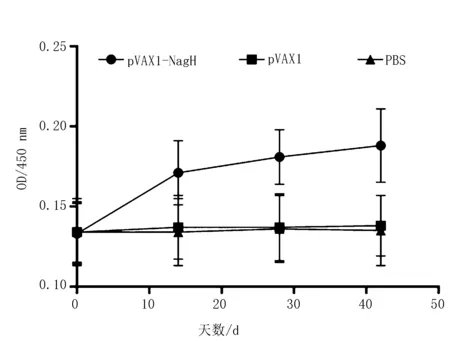
图2 各组免疫小鼠血清中IgG指标变化
2.2.2 小鼠血清中IgG1指标变化
Mouse IgG1 ELISA KIT检测小鼠血清IgG1水平。可见pVAX1-NagH组在免疫后的抗体水平总体呈上升趋势,虽然在第3次免疫后上升趋势并不显著,但始终显著高于其他2组(P<0.05),而pVAX1组和PBS组之间则无显著性差异(P>0.05)(图3)。
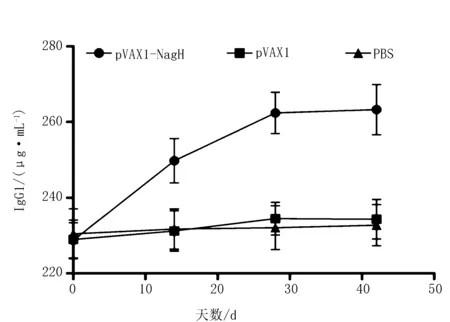
图3 各组免疫小鼠血清中IgG1指标变化
2.2.3 小鼠血清中IgG2a指标变化
Mouse IgG2a ELISA KIT检测小鼠血清IgG2a水平。可见pVAX1-NagH组在免疫后的抗体水平显著高于其他2组(P<0.05),而pVAX1载体组和PBS组之间则无显著性差异(P>0.05)(图4)。
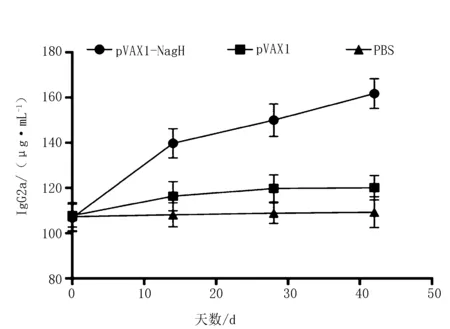
图4 各组免疫小鼠血清中IgG2a指标变化
2.2.4 小鼠血清中IFN-γ指标变化
Mouse IFN-γELISA KIT检测小鼠血清IFN-γ水平。可见pVAX1-NagH组在免疫后的抗体水平在免疫后的前28 d中呈现上升趋势,且显著高于pVAX1组和PBS组(P<0.05),但其抗体水平在第4次检测时未能维持在最高水平,而呈现了下降趋势。pVAX1组和PBS组之间则无显著性差异(P>0.05)(图5)。
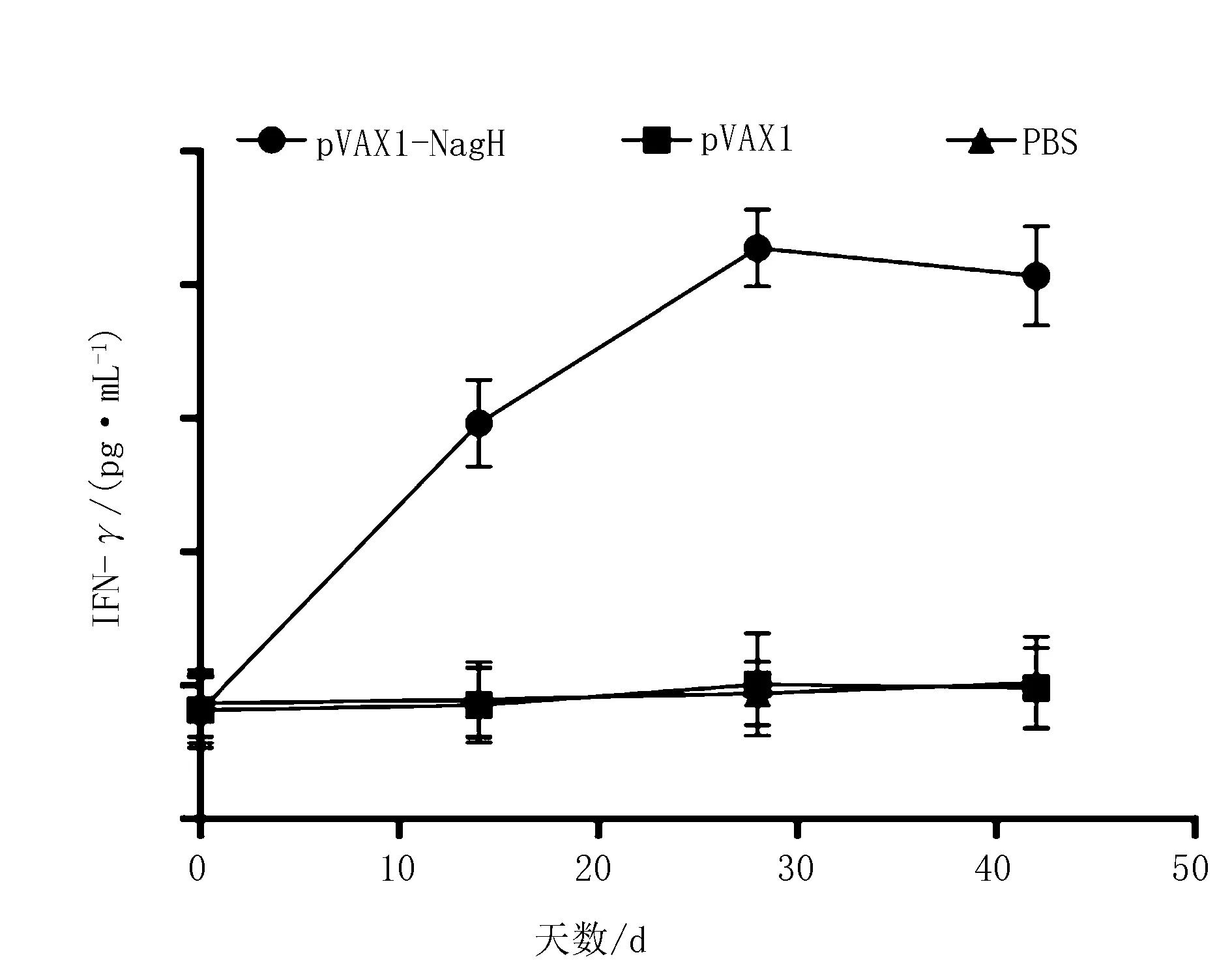
图5 各组免疫小鼠血清中IFN-γ指标变化
2.2.5 小鼠血清中IL-4指标变化
Mouse IL-4 ELISA KIT检测小鼠血清IL-4水平。可见pVAX1-NagH组在免疫后的抗体水平显著高于其他2组(P<0.05),而pVAX1组和PBS组之间则无显著性差异(P>0.05)(图6)。
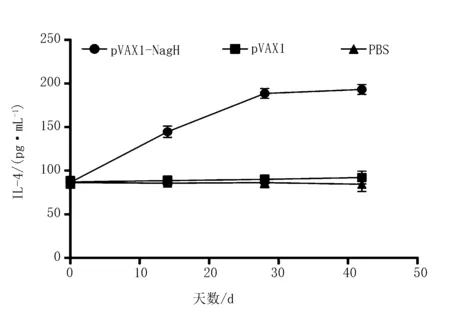
图6 各组免疫小鼠血清中IL-4指标变化
3 讨论与结论
近年来,我国对气肿疽疾病的控制已经达到良好成效,在预防方面做了充分准备,定期注射疫苗,加强卫生治理,减少体表创伤,提高畜舍管理水平[8]。免疫是机体的一种特异性生理反应, 通过识别和排除抗原性异物维持体内外环境的稳定。动物机体的免疫功能是在淋巴细胞和其他有关细胞及产物的相互作用下完成的, 这些具有免疫作用的细胞及产物以及与其相关的组织和器官, 构成了机体的免疫系统[14]。在引物设计过程中,参考以往成功试验[9,15],加入了Kozak序列,增强了翻译的效率。在注射疫苗时,采用了双侧股四头肌注射法进行免疫,据称,肌肉注射DNA比其他组织摄取DNA的效率高100~1 000倍, 故该试验采用双侧股四头肌注射法进行免疫[16]。
在机体免疫过程中,Th1细胞主要参与细胞免疫应答,杀灭细菌和病毒等病原体,主要生产IFN-γ, IL-2和TNF-β等[17],其通过刺激B细胞的增殖分化,在IFN-γ的辅助作用下促进IgG2a的产生,而Th2主要参与体液免疫应答在变态反应性疾病中发挥作用,主要产生IL-4、IL-6和IL-10等[18],其在IL-4的辅助作用下促进IgG1的产生,Th1和Th2通过相互协调作用,共同完成机体的免疫调节[17-20]。该试验通过检测IFN-γ、IgG2a作为Th1细胞免疫水平的依据,通过检测IL-4、IgG1水平作为体液免疫水平的依据。
结果显示在接受了免疫接种后,通过对血清抗体含量的分析发现,各组小鼠均出现了不同程度的免疫反应。其中,pVAX1-NagH免疫组的小鼠血清抗体水平逐渐上升,且IgG1与IgG2a水平高于pVAX1空载体组和PBS对照组,IFN-γ和IL-4细胞因子水平高于pVAX1空载体组和PBS对照组,IgG1、IgG2a、IL-4和IFN-γ指标在小鼠血清中的水平不但与对照组形成显著差异,而且在最后一次接种后2周的时间里能够始终保持在较高水平。说明pVAX1-NagH疫苗组明显能够诱导机体产生良好的免疫应答。但根据第42天的检测结果显示,IFN-γ的水平出现了一定程度的下降,该情况的出现可能由多种原因导致,这可能显示着该重组质粒不能很好地引起小鼠血清中IFN-γ水平的升高,对细胞免疫效果并未达到理想状态。就此次试验而言,亦不能完全排除饲养等人为因素造成一定误差的可能。
根据以往成功试验结果[10-11,21],分析可得NagH的核酸疫苗免疫效果与FliA、NanA和CctA的免疫效果趋势相近,说明NagH与FliA、NanA、CctA同样可以起到刺激小鼠免疫反应的作用,在预防气肿疽梭菌疾病和维护公共卫生安全方面更进一步。
