bFGF对氧化应激状态下小鼠卵母细胞糖代谢能力的影响
2022-05-05李瑞冬方南洙金庆国柳海星李钟淑
李瑞冬, 方南洙, 金庆国, 柳海星, 李钟淑
(延边大学 农学院,吉林 延吉 133002)
卵母细胞是哺乳动物特有的生殖细胞,卵母细胞的质量决定着母畜的繁殖率以及仔畜的健康以及品质的优良。为了提高家畜的繁殖率,通常会采用IVM技术以及胚胎移植技术从体外人工提高动物的繁殖率。然而在体外的操作过程中存在着某些因素会影响卵母细胞的质量,从而降低试验的成功率,其中常见的因素就是氧化应激[1]。
氧化应激是一种细胞内氧化还原水平不平衡导致的细胞的应激状态,其主要诱因ROS会与细胞内各种分子结合反应产生各种有害的自由基,因此氧化应激能够导致细胞生物膜、遗传物质等的破坏。其次ROS作为一种第2信使也在时刻的对下游的基因表达起着调节的作用,如ROS对Keap1-Nrf2-ARE、PI3K/Akt通路的调节可以提高细胞的抗氧化、增殖分化以及糖代谢的能力[2]。糖代谢能力的下降将会导致细胞的衰老,进而引发各方面的疾病[3]。因此,过量的ROS导致细胞内细胞通路的异常运作,对细胞活力有着不良的影响。近来也有研究表明,氧化应激还能够通过干扰胰岛素信号通路导致小鼠的糖代谢紊乱,从而对小鼠的健康产生不良影响[4]。
因此,为了对抗这种不良影响,外源性抗氧化物质的添加显的格外重要。目前已经发现的抗氧化物质有很多,但大多数都是从植物中提取而来,其含量甚微甚至远不及内源性抗氧化剂,如褪黑素、α-硫辛酸、辅酶Q等。碱性成纤维细胞生长因子(bFGF)是一种自身能够合成的细胞蛋白因子,其广泛存在于人体组织中,其次在快速增殖的组织中,如胚胎[5-6]。bFGF已知的生物学作用主要体现在组织损伤的修复,血管的生成以及创伤的愈合中[7-8],近些年研究发现,bFGF还对氧化应激造成的损伤细胞具有一定的保护作用[9-11]。然而有关bFGF在卵母细胞氧化应激方面的研究迄今还是一片空白。
因此,该试验以6~8周的雌性小白鼠为试验材料,旨在通过比较正常组(正常培养液)、氧化组(含有250 μmol/L过氧化氢)、抗氧化组(150 ng/L bFGF+250 μmol/L)3组细胞中的氧化应激标志物ROS、MDA、8OHdG水平、细胞内还原物质谷胱甘肽(GSH)、线粒体功能如膜电位荧光强度、能荷水平,以及细胞代谢途径中无氧途径酶pk,hk,6-pfk的活性以及调节无氧途径与有氧途径的pdk1酶活性的变化,探究bFGF对氧化应激条件下的小鼠卵母细胞的保护作用以及对细胞糖代谢途径调节的作用。
1 材料与方法
1.1 材料
1.1.1 对象
雌性昆明小鼠,购自延边大学实验动物中心,6~8周周龄,体重25~30 g。在IVC条件下饲养,温度为26 ℃,固定的光周期暗周期各12 h,自由采食,自由饮水。在饲养适应一周后进行试验,操作均符合试验动物福利的相关规定。
1.1.2 主要试剂及仪器
血促性素(PMSG,宁波第二激素厂,货号110254564),M2培养液(SIGMA,货号M7167),M16P培养液(M7292),矿物油,即用型透明质酸酶,碱性成纤维细胞生长因子(bFGF,索莱宝,货号50037-M07E),GSH 荧光染色剂(CellTrackerTMBlueCMF2HC Dye,Thermo Fisher Scientific,货号C12881),JC-1[CBIC2(3),碧云天,货号C2005]。ELISA酶联试剂盒(上海远慕),实体显微镜(Nikon,TMS),荧光显微镜(Nikon,ECLIPSE Tis 634268),二氧化碳培养箱(ESCO,CCL-170B-8)。
1.1.3 主要试剂的配制
1) bFGF的配制 bFGF的配制按照说明进行配制,将bFGF粉末溶解于70 μL无菌水中,配制成浓度为0.15 mg/mL的原液,后加入M16使其浓度为150 ng/mL。
2) 过氧化氢的配制 过氧化氢的浓度按照相关文献确定为250 μmol/L[12],其配置方法为:取10 μL 30%过氧化氢原液,加入990 μL M16形成A液,然后取A 10 μL 溶于990 μL M16中获得B液,然后取250 μL B液与750 μL M16混合即得250 μmol/L的过氧化氢。
1.2 方法
1.2.1 卵母细胞的收集与培养
选取符合试验标准的健康雌性小鼠,腹腔注射10 IU的PMSG 2 d后脱颈处死,打开腹腔,取出卵巢,剔除脂肪后置于M2液滴中,显微镜下用手术刀切碎卵巢并加入透明质酸酶,吸取至5 mL微量离心管中,移至培养箱中进行酶消化作用 5 min。取出微量离心管吸取沉淀。用合适的玻璃针拾取卵母细胞。卵母细胞在M2培养液中洗涤3~5次,洗去杂质后,培养箱中培养20 h。
1.2.2 ROS、MDA、8OHdG的检测
氧化应激标志物的检测严格按照试剂盒说明书进行。试剂盒采用双抗体一步夹心法酶联免疫吸附实验(ELISA)。用酶标仪在450 nm波长下测定吸光度(OD值),计算样品浓度。
1.2.3 GSH荧光强度检测
按照试剂说明书配置好CMF2HC工作液后分装,使用时提前解冻并加入990 μL M16后待用,将培养后的卵母细胞用1 g/L PBS-PVA洗涤3次后置于含有染色剂的小滴中,培养箱内孵育15 min,取出用PBS-PVA洗涤3次,洗去染料,置于新的PBS-PVA液滴中并覆盖矿物油,荧光显微镜下进行紫外荧光激发,得到的荧光染色照片用 Image J 1.49对荧光图片量化分析,结果用平均荧光强度相对值表示。
1.2.4 线粒膜电位荧光强度检测
按照试剂说明书配置好JC-1工作液后分装,使用时提前解冻并加入990 μL M16后待用,将培养后的卵母细胞用1 g/L PBS-PVA洗涤3次后置于含有染色剂的小滴中,培养箱内孵育20 min,取出用PBS-PVA洗涤3次,洗去染料,荧光显微镜下进行紫外荧光激发,得到的荧光染色照片用 Image J 1.49对荧光图片量化分析,结果用平均荧光强度相对值表示。
1.2.5 卵母细胞活力、能荷以及细胞糖代谢酶活力的检测
检测方法同1.2.2。
1.2.6 数据统计分析
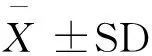
2 结果与分析
2.1 bFGF对小鼠卵母细胞的抗氧化标志物水平的影响
由表1可见,与正常组相比,100 μmol/L过氧化氢处理组的卵母细胞内总氧化应激标注物含量显著高于正常组(ROS、MDA、8OHdG,n=90,P<0.05),与此一致,100 μmol/L过氧化氢处理组的卵母细胞内氧化应激标注物含量显著高于抗氧化处理组(n=90,P< 0.05),而正常组与抗氧化处理组卵母细胞内总ROS含量相比,差异不显著(P=0.08>0.05);正常组与抗氧化处理组卵母细胞内MDA含量相比,差异显著(P<0.05);正常组与抗氧化处理组卵母细胞内8OHdG含量相比,差异显著(P<0.05)。

表1 bFGF对小鼠卵母细胞内氧化应激标志物含量影响
2.2 bFGF对小鼠卵母细胞内GSH荧光水平的影响
为探究bFGF对小鼠卵母细胞内还原当量GSH含量的影响,现采用CMF2HC Dye对卵母细胞进行活细胞染色,每组20个细胞,避光染色后在荧光显微镜激发拍摄后用ImageJ 1.49 对荧光图片量化分析,结果用平均荧光强度相对值表示。bFGF对小鼠卵母细胞内GSH含量的影响见图1。
注:(A)不同实验组卵母细胞内谷胱甘肽荧光强度。(B)谷胱甘肽荧光强度量化分析图,
2.3 bFGF对小鼠卵母细胞活力及能荷水平的影响
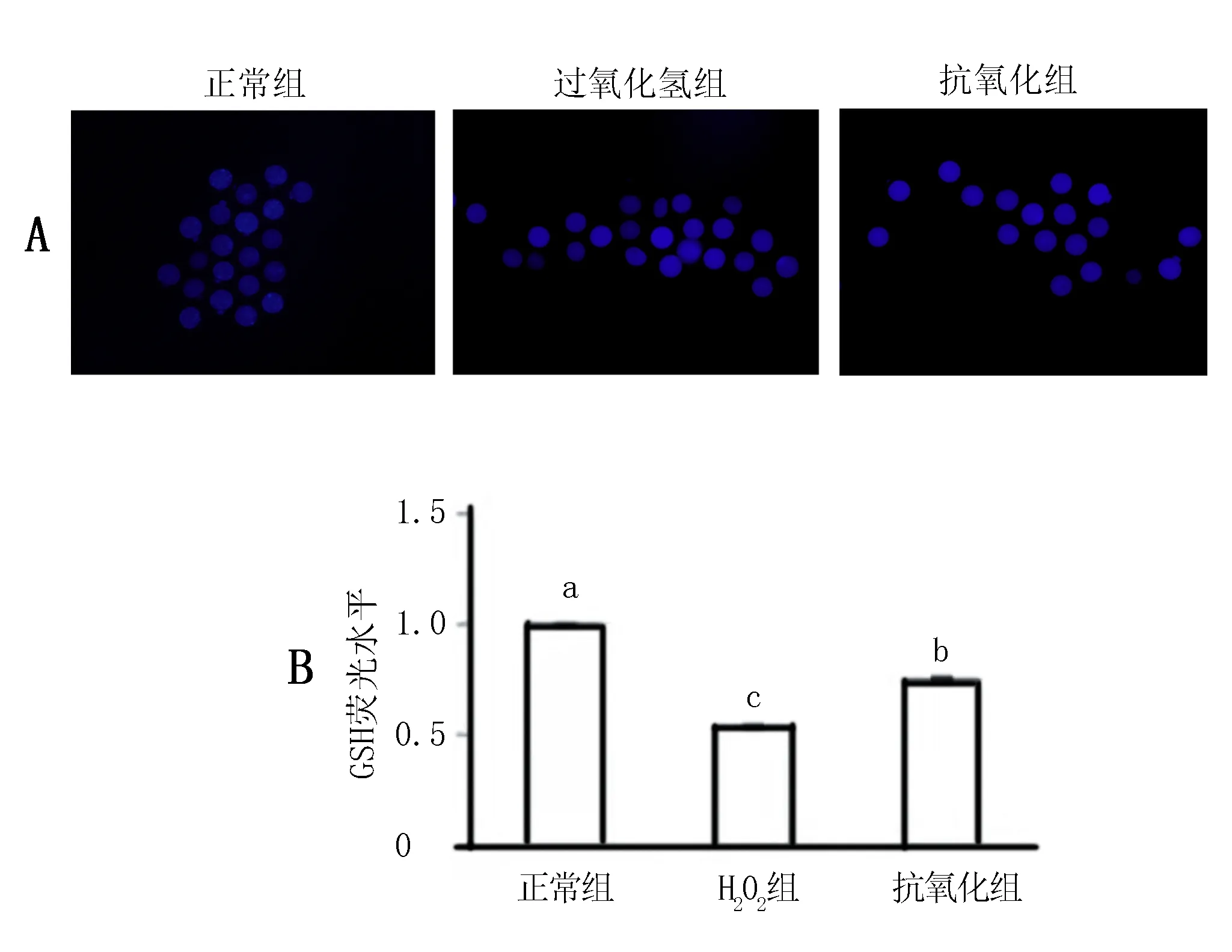
细胞内ATP、ADP、AMP的动态比是衡量细胞活力的一种指标,其中,能荷的换算更能体现出细胞活力的情况。结果显示:正常组卵母细胞能荷比值接近于0.95,而过氧化氢组能荷接近0.5,显著低于正常组(P<0.05),抗氧化组细胞能荷水平大致在0.7左右,显著高于过氧化氢组(P<0.05),正常组与抗氧化组相比,差异显著(P<0.05),试验表明bFGF能够显著提高氧化应激状态下小鼠卵母细胞的能荷水平(表2,图2)。

表2 bFGF对小鼠卵母细胞内ATP、ADP、AMP含量及能荷影响
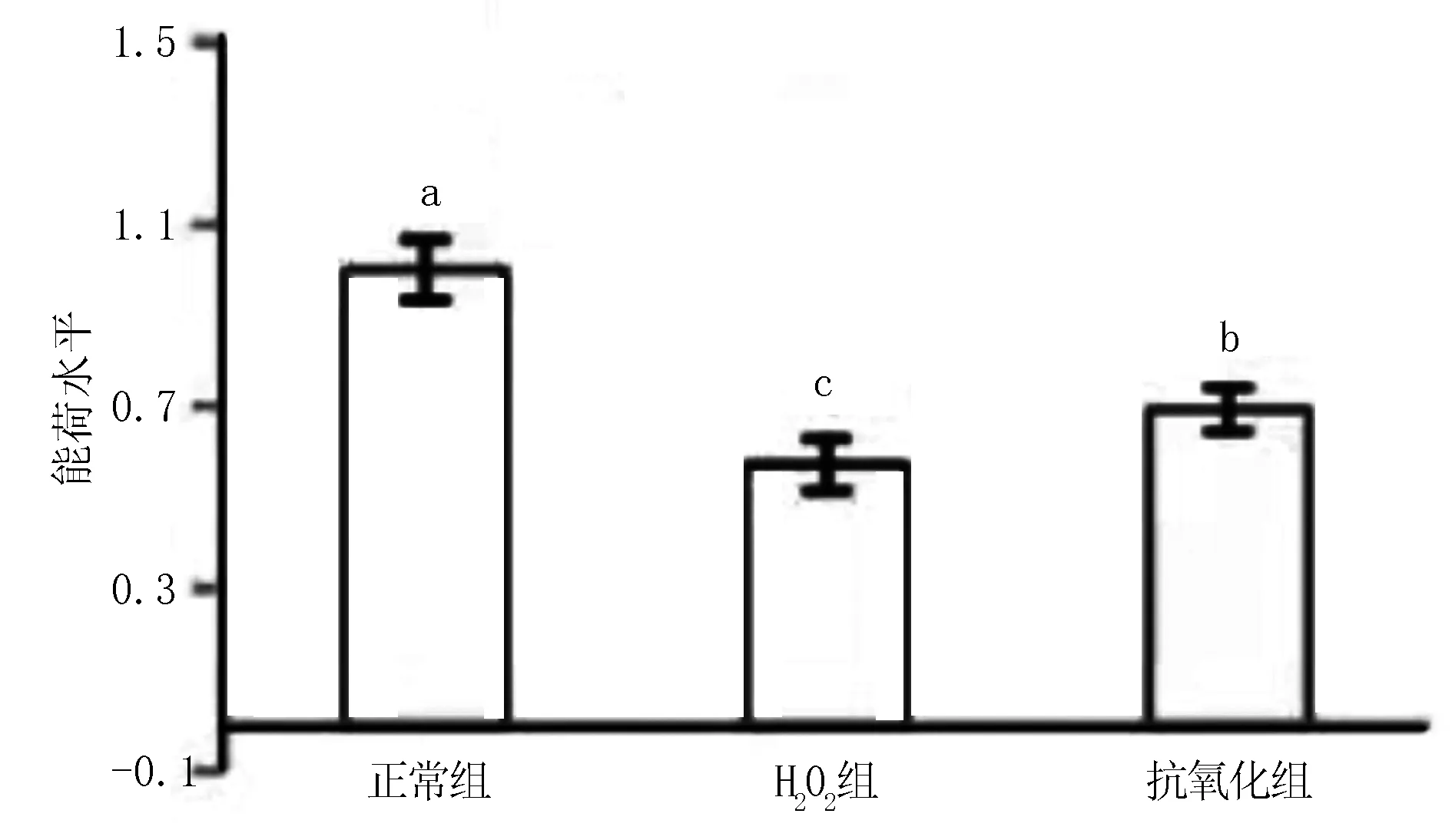
图2 bFGF处理对氧化应激条件下小鼠 卵母细胞能荷水平量化分析图
2.4 bFGF对小鼠卵母细胞内线粒体膜电位荧光水平的影响
线粒体是细胞内能量的中转站,因此细胞的活性应与线粒体的膜电位相关,因此采用JC-1染色剂分别对3组卵母细胞进行染色,处理结果如图3,通过数据可以看出,正常组膜电位荧光强度显著高于过氧化氢组(P<0.05),过氧化氢组膜电位荧光强度显著低于抗氧化组(P<0.05)。

注:(A)不同处理组内细胞线粒体膜电位荧光强度比较,(B)线粒体膜电位荧光强度量化分析图。
2.5 bFGF对氧化应激条件下小鼠卵母细胞代谢酶活力影响
由图4数据分析可知,hk、6-pfk、pk酶的酶活力均显著低于H2O2处理组,而pdk1则恰恰相反,抗氧化组4种酶活性均显著高于H2O2处理组(P<0.05)。然而正常组与抗氧化组相比,pdk1、6-pfk酶活力差异显著(P<0.05),而pk、hk酶2组之间无显著性差异(P>0.05)。表明bFGF的添加有效调控了糖代谢酶的活性:恢复了氧化应激导致的糖酵解途径活化,并恢复了细胞正常的有氧代谢途径(n=90,P<0.05)。
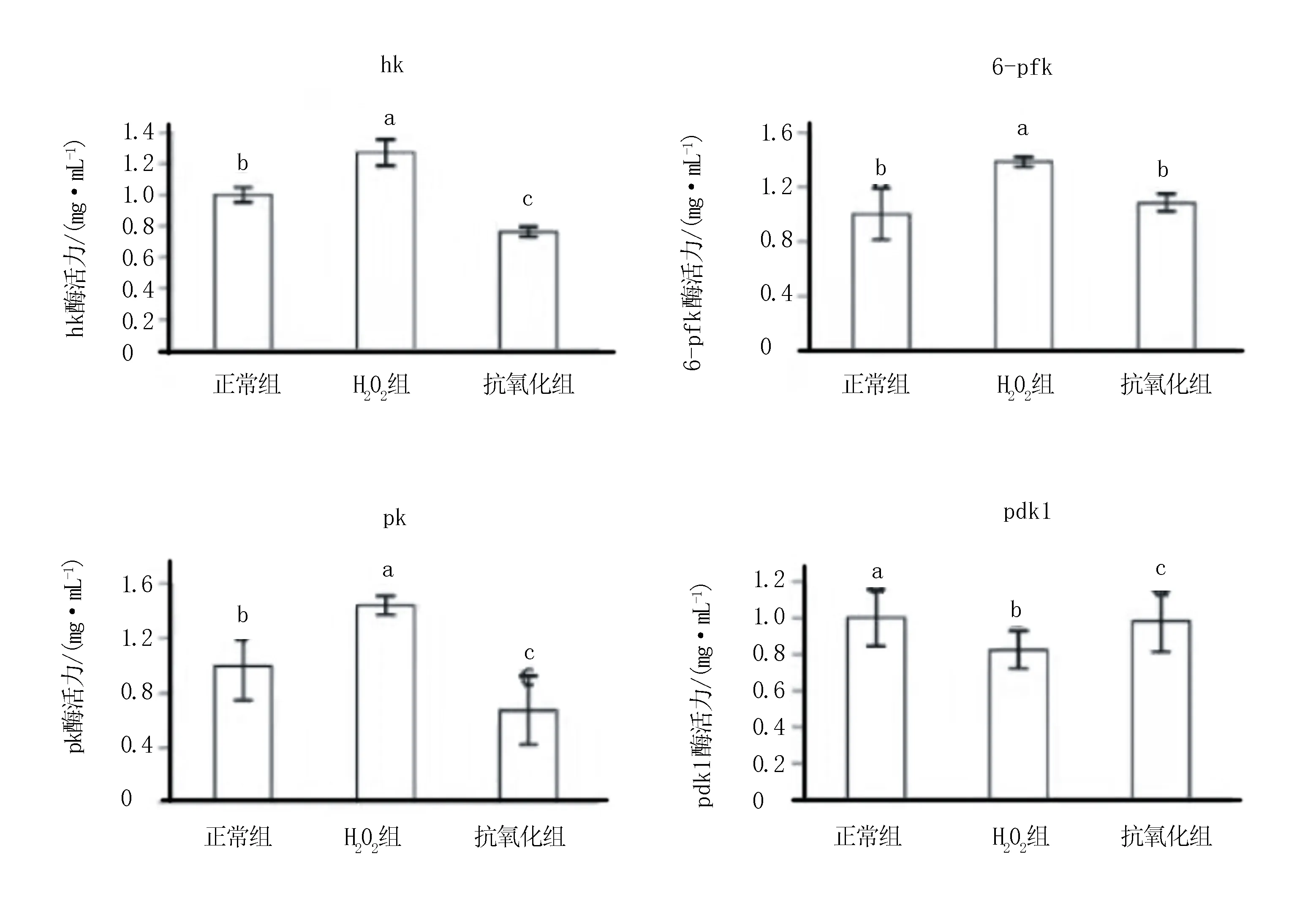
图4 bFGF对小鼠卵母细胞内pdk1、pk、hk、6-pfk活性的影响
3 讨论
卵母细胞的质量不仅对家畜的繁殖率和动物仔畜的品质有很大影响,而且还会影响着畜牧业未来的发展。氧化应激作为影响卵母细胞质量的主要因素不仅影响着卵母细胞的结构,更加对细胞的功能产生严重的影响,其不仅会对线粒体膜造成损伤,还会加速细胞的衰老或死亡。氧化应激标志物作为检测氧化应激水平指标对于疾病的判断及预测有很大的作用[13-15]。谷胱甘肽作为一种内源性抗氧化剂,能够防止自由基、过氧化物、脂质过氧化物和重金属等活性氧对重要细胞成分造成的损害[16]。因此,细胞内还原型谷胱甘肽的水平通常也用来衡量细胞抵御氧化应激的能力[17-19]。由于氧化应激对细胞的膜结构造成了不可逆的危害,因此对于线粒体的功能也是产生影响的,线粒体功能通常通过细胞内对ATP水平和膜电位的测定来体现。周秀芬,姜宏[20]表明,线粒体膜电位与ROS的含量呈负相关,且线粒体膜电位越低精子的活力越低。此外细胞的糖代谢水平也与膜电位有很大关联,线粒体膜电位的高低与线粒体的氧化磷酸化能力呈正相关[21]。
细胞的糖代谢即取决于线粒体的功能结构,也取决于其内部酶的活力。蒋欣,徐阳表明,卵母细胞的发育及质量与糖代谢酶的调控息息相关[22]。因此该试验设计并研究bFGF对氧化应激状态下小鼠卵母细胞糖代谢酶活力的影响。
结果显示,经过bFGF处理的卵母细胞显著降低了氧化应激,标注物的含量显著高于正常组(ROS、MDA、8OHdG,n=90,P<0.05)。 bFGF处理后也显著恢复了细胞的GSH荧光水平并且提高了线粒体膜电位和ATP的水平(P<0.05),从而提高细胞的活力。此外,试验数据还显示在过氧化氢的处理下,糖酵解途径的酶活力得到显著的激活,而三羧酸循环中的限速酶活力得到了抑制,在bFGF添加后,糖酵解途径酶活力恢复正常,由此证明bFGF的加入改善了氧化应激对细胞糖代谢酶活性及途径的调控有显著作用。
4 结论
该试验结果表明,100 ng/L bFGF能够显著提高细胞内还原当量GSH含量以及降低氧化应激标志物ROS、MDA和8OHdG的相当含量从而对抗细胞的氧化应激,另外,bFGF的添加显著提高了线粒体膜电位以及ATP和能荷的相对含量,从而提高细胞线粒体的功能,增强细胞活力,最后bFGF的加入显著改善了氧化应激对细胞糖代谢酶活性造成的不良影响。
