血尿酸、载脂蛋白A1及总谷胱甘肽对早期帕金森病的影响
2022-04-28汤海燕谈鹰王庄张冰
汤海燕 谈鹰 王庄 张冰

[摘要] 目的 研究血尿酸、載脂蛋白A1及总谷胱甘肽是否为早期帕金森病的患病风险因素。方法 选择2018年5月至2020年3月浙江省湖州市中心医院神经内科收治的早期帕金森病患者102例(帕金森病组)与健康体检者98名(健康对照组)。测定两组血清尿酸、载脂蛋白A1及总谷胱甘肽水平,比较两组三项指标的差异,分析帕金森病组不同年龄和性别生化指标的差异以及三项指标与患病的关系。 结果 帕金森病组血清尿酸[(276.52±78.04)μmol/L vs.(343.17±67.27)μmol/L]、载脂蛋白A1[(1.29±0.27)g/L vs.(1.40±0.28)g/L]及总谷胱甘肽水平[(940.44±239.15)μmol/L vs.(1183.37±165.41)μmol/L]明显低于健康对照组(P<0.01)。帕金森病组女性尿酸值低于男性,高龄患者血总谷胱甘肽值更低(P<0.01)。通过logistic多因素回归分析发现低水平血尿酸、载脂蛋白A1及总谷胱甘肽均为帕金森病患病的危险因素(P<0.05)。ROC曲线显示血清尿酸、载脂蛋白A1及总谷胱甘肽的曲线下面积分别为0.735(95%CI 0.665~0.805)、0.617(95%CI 0.539~0.695)及0.813(95%CI 0.752~0.874)。其中尿酸为362.25 μmol/L时特异度为87.3%,总谷胱甘肽为1014.00 μmol/L时敏感度为85.7%。 结论 帕金森病患者血清尿酸、载脂蛋白A1及总谷胱甘肽水平较低,提示帕金森病存在氧化应激能力的缺陷。低水平血清尿酸、载脂蛋白A1及总谷胱甘肽是帕金森病患病的独立风险,尿酸和总谷胱甘肽分别有较高的辅助诊断早期帕金森病的特异度和敏感度。
[关键词] 帕金森病;尿酸;载脂蛋白A1;谷胱甘肽
[中图分类号] R742.5 [文献标识码] B [文章编号] 1673-9701(2022)08-0092-04
Effects of serum uric acid, apolipoprotein A1 and total glutathione on early Parkinson′s disease
TANG Haiyan TAN Ying WANG Zhuang ZHANG Bing
Department of Neurology, Huzhou Central Hospital in Zhejiang Province, Affiliated Hospital of Huzhou University, Huzhou 313000, China
[Abstract] Objective To study whether serum uric acid, apolipoprotein A1 and total glutathione are risk factors for early Parkinson′s disease (PD). Methods A total of 102 early PD patients who were admitted to the Department of Neurology, Huzhou Central Hospital in Zhejiang Province (the PD group) and 98 subjects with healthy physical examinations (the healthy control group) from May 2018 to March 2020 were enrolled. The levels of serum uric acid, apolipoprotein A1 and total glutathione were measured in the two groups, and the differences in the three indicators were compared between the two groups. The differences in biochemical indicators in patients of different ages and genders in the PD group were analyzed, and the relationships between the three indicators and the disease were also analyzed. Results The levels of serum uric acid ([276.52±78.04] μmol/L vs. [343.17±67.27] μmol/L), apolipoprotein A1 ([1.29±0.27] g/L vs. [1.40±0.28] g/L) and the total glutathione ([940.44±239.15] μmol/L vs. [1183.37±165.41] umol/L) in the PD group were significantly lower than those in the healthy control group (P<0.01). The uric acid value of women in the PD group was lower than that of men, and the blood total glutathione value of elderly patients was much lower (P<0.01). Logistic multivariate regression analysis found that low levels of serum uric acid, apolipoprotein A1 and total glutathione were all risk factors for PD (P<0.05). The receiver operating characteristic (ROC) curve showed that the areas under the curve for serum uric acid, apolipoprotein A1 and total glutathione were 0.735 (95% CI 0.665-0.805), 0.617 (95% CI 0.539-0.695) and 0.813 (95% CI 0.752-0.874), respectively. The specificity was 87.3% when uric acid was 362.25 μmol/L, and the sensitivity was 85.7% when total glutathione was 1014.00 μmol/L. Conclusion The low levels of serum uric acid, apolipoprotein A1 and total glutathione in PD patients suggest that PD has caused defects in the ability of oxidative stress. Low levels of serum uric acid, apolipoprotein A1 and total glutathione are independent risks for PD. Uric acid and total glutathione respectively shows higher specificity and sensitivity in assisting diagnosis of early PD.
[Key words] Parkinson′s disease; Uric acid; Apolipoprotein A1; Glutathione
帕金森病(Parkinson′s disease,PD)是最常见的运动障碍疾病[1],其主要临床特征为静止性震颤、运动迟缓、肌强直以及中后期出现姿势步态异常。PD以黑质多巴胺能神经元变性缺失为主要病理特征,在神经元变性期间,神经元细胞内抗氧化系统受损,氧化水平升高且自由基大量产生。尿酸(uric acid,UA)是嘌呤碱和核酸代谢的最终产物,作为机体内天然的抗氧化剂,具有清除自由基的功能,可抑制DNA损伤,进而延缓神经退行性疾病进展[2]。近几年也有关于血脂水平和PD发病相关性的研究,但结论不一。而谷胱甘肽(glutathione,GSH)为人体内一项重要的抗氧化指标,有研究报道其可能参与PD的氧化应激发病机制[3]。本研究通过比较早期PD患者与健康人群的血清UA、载脂蛋白A1(apolipoprotein A1,ApoA1)及总谷胱甘肽(t-GSH)水平,探讨三类血生化指标与PD的相关性,并且探讨上述生化指标在辅助诊断早期PD中的意义,现报道如下。
1 对象与方法
1.1 研究对象
选取2018年5月至2020年3月浙江省湖州市中心医院神经内科门诊及住院的PD患者102例(PD组),其中男45例、女57例,平均年龄(66.55±8.65)岁,平均病程3(1,5)年。所有PD患者均符合2015年国际运动障碍协会诊断标准[4]明确为原发性PD,且根据Hoehn-Yahr分级[5]均评定为1~2.5级的早期PD患者。排除标准:①继发性帕金森综合征、帕金森叠加综合征及其他神经系统变性疾病者[6];②恶性肿瘤、胃肠疾病、肝肾功能不全、痛风及其他严重躯体疾病影响生化指标者[7];③近3個月内有影响血脂、尿酸的药物使用史者[7]。另选取同期健康体检者98名为对照组,其中男43例、女55例,平均年龄(65.97±9.11)岁,无神经系统疾病史,排除标准同PD组。所有研究对象均为本地居民,饮食结构与生活习惯相似,均签署知情同意书,并经医院医学伦理委员会批准。
1.2 生化指标检测方法
所有患者均于就诊当日或次日清晨空腹抽取肘静脉血,放置于EDTA抗凝剂试管中,通过离心得到血清,采用雅培全自动生化分析仪检测UA、ApoA1,同步采用高效液相色谱法检测血清t-GSH;同期健康对照组同时检测以上三项指标。
1.3 统计学方法
采用SPSS 20.0统计学软件进行数据分析。计数资料以[n(%)]表示,组间比较采用χ2检验;计量资料中PD组病程不符合正态分布,以[M(P25,P75)]表示,其余变量均符合正态分布,以均数±标准差(x±s)表示,组间比较采用t检验;采用二元多因素logistic回归分析对PD的患病风险因素作相关性分析,P<0.05为差异有统计学意义。绘制生化指标ROC曲线,计算曲线下面积和截断值,判断各指标辅助诊断PD的特异度和敏感度。
2 结果
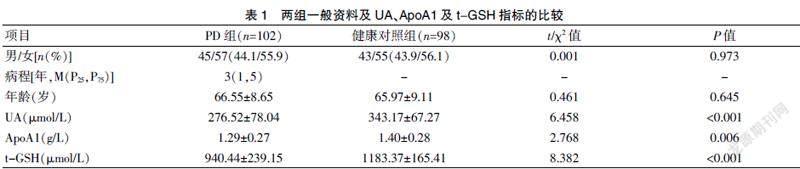
2.1 两组一般资料及血生化指标的比较
PD组和健康对照组的性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。而PD组血清UA水平较健康对照组明显偏低(P<0.001),血清ApoA1水平较健康对照组偏低(P<0.05),且两组血清t-GSH比较PD组亦较对照组明显降低(P<0.001)。见表1。
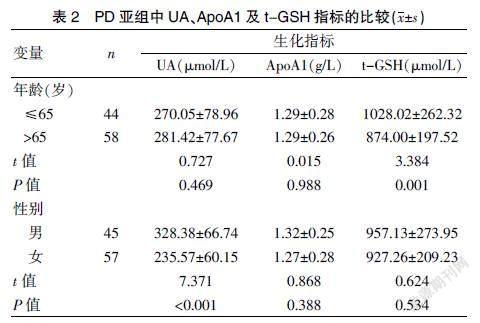
2.2 PD亚组比较血生化指标的差异
将PD组按年龄段划分,发现>65岁PD组血清t-GSH水平较≤65岁PD组明显偏低(P<0.05),而两组间UA及ApoA1指标比较,差异无统计学意义(P>0.05);将PD组按性别不同划分,发现女性较男性组血清UA水平偏低(P<0.001),而ApoA1及t-GSH值两组比较,差异无统计学意义(P>0.05)。见表2。
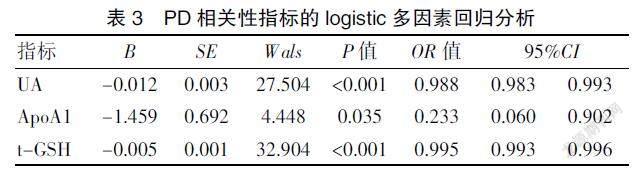
2.3 血清各生化指标与PD患病的相关性多因素分析
将是否患PD作为因变量,将血清UA、ApoA1及t-GSH作为自变量做二元多因素logistic回归分析,结果显示,低水平UA、ApoA1及t-GSH均为PD患病的独立危险因素(P<0.05)。见表3。
表3 PD相关性指标的logistic多因素回归分析
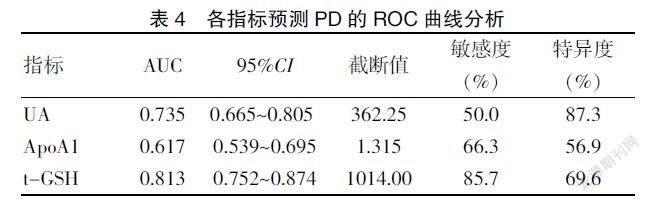
2.4 血清UA、ApoA1及t-GSH水平ROC曲线分析
将两组有差异的血清UA、ApoA1及t-GSH指标进一步进行ROC曲线描绘,结果显示血UA、ApoA1及t-GSH的曲线下面积分别为0.735(95%CI 0.665~0.805)、0.617(95%CI 0.539~0.695)及0.813(95%CI 0.752~0.874),并提示血清UA、ApoA1及t-GSH截断值分别为362.25 μmol/L、1.315 g/L及1014.00 μmol/L时,有一定的诊断敏感度和特异度。其中血清UA≤362.25 μmol/L时辅助诊断早期PD的特异度为87.3%,t-GSH≤1014.00 μmol/L时辅助诊断早期PD的敏感度为85.7%。见图1、表4。
3 讨论
PD患者由于血UA水平的下降致使体内氧自由基相对增多,从而导致细胞功能及结构破坏,造成黑质多巴胺能神经元大量变性坏死。另早期有研究发现PD患者额叶皮层脂质筏中存在许多脂质成分的改变[8],由此可导致脂质筏相关蛋白功能缺陷及异常信号转导,从而导致神经变性疾病的发生。ApoA1是高密度脂蛋白的主要成分,通过促进高密度脂蛋白与卵磷脂胆固醇酰基转移酶的结合而逆转胆固醇。有研究利用分子影像多巴胺转运体(dopamine transporter,DAT)显像技术发现血浆ApoA1水平与DAT再摄取程度显著相关[9],ApoA1水平越低,DAT缺乏越严重,预示ApoA1水平同样能导致PD易感。GSH是一种普遍存在的硫醇三肽,其与细胞内酶协同减少超氧自由基的生成,参与PD的氧化应激代谢[10]。
本研究PD患者较健康对照出现明显的血清UA和ApoA1下降,符合孙梅芬等[11]发现血清UA与血脂水平与PD的临床特征相关的研究。入组的PD均为早期病程,通过多因素回归分析,发现血清UA降低为PD患病的独立危险因素,且ROC曲线发现截断值为362.25 μmol/L时诊断的特异度为87.3%,更加证实UA作为天然抗氧化剂确实参与早期PD发病的氧化应激损害机制。验证Wang等[12]研究发现PD患者血清UA降低为PD发病的风险性生化指标的结论。也符合刘佳等[13]较高尿酸水平能降低帕金森病发病风险的研究结果。ApoA1的诊断特异度和敏感度虽不高,但多因素回归分析亦发现该指标为PD易患风险,与Swanson等[14-15]在PD患者发现ApoA1基因亚型且发现ApoA1与早发型PD的发病年龄和运动症状的严重程度相关的结论符合。同时PD组的血清t-GSH较健康同龄对照明显下降,亦验证王倩等[16]得出的GSH等氧化应激指标的异常参与PD的发生和发展的结论,并且回归分析也发现血清t-GSH对早期PD的患病风险产生独立作用,ROC曲线t-GSH截断值为1014.00 μmol/L时辅助诊断早期PD的敏感度达到85.7%。
同时,本研究发现在PD患者中,女性的血清UA水平明显低于男性,说明在PD患者中不同性别存在UA水平的差异。而Sakuta等[17]则发现男性PD患者存在UA的下降,而女性PD的UA水平与健康对照一致。另外研究发现同样是早期PD患者,高龄患者与年轻患者的UA水平无明显差异,而刘久江等[18]则发现女性PD患者中发病年龄越大,则UA值越高。通过统计学分析也明确了早期PD患者中高龄患者的t-GSH更低,该结果与周红等[19]发病年龄越晚,血GSH水平更低的研究结论相符合。
目前,中晚期PD患者因临床症状明显而易于诊断,但一部分早期PD并不表現典型的行动迟缓或静止性震颤而不能立即明确诊断。同时对于PD的临床诊断依靠的是神经专科医生的病史询问和体格检查,甚至一些支持标准,如多巴胺能药物治疗是否有效应答等评估依旧凭借的是观察者的临床判断,带有一定的主观性。目前客观有效的辅助检查包括分子影像DAT功能显像、经颅黑质超声等均可应用于PD的早期诊断,特别是DAT显像可以反映早期PD的多巴胺能神经元丢失,为诊断提供有力证据[20],但此类检查并非普及于各家医院。因此若能在早期PD患者中发现体液标本的实验室检查依据,是相对操作可行的辅助诊断措施。
本研究样本量不大,与以往文献报道有异同之处;且尚未分析其余相关生化指标对PD患病的影响。但经过统计学分析,本研究发现血清UA、ApoA1及t-GSH在早期PD患者表现低水平状态,且三者对PD患病均产生独立风险,对于早期PD的协助诊断,ROC曲线验证UA≤362.25 μmol/L时特异度和t-GSH≤1014.00 μmol/L时敏感度较高。故临床医生若无法明确诊断早期PD,可参考上述生化指标,有助于PD的早期识别。
[参考文献]
[1] Barnett R. Parkinson′s disease[J].Lancet,2016,387(10 015):217.
[2] Khan AA,Quinn TJ,Hewitt J,et al. Serum uric acid level and association with cognitive impairment and dementia:Systematic review and meta-analysis[J].Age(Dordr),2016,38(1):16.
[3] 韦慧君,杜孟,白宏英.血清褪黑素、谷胱甘肽与帕金森氧化应激的相关性[J].中国医学科学院学报,2019,41(2):183-187.
[4] Postuma RB,Berg D,Stern M,et al. MDS clinical diagnostic criteria for Parkinson′s disease[J].Mov Disord,2015,30(12):1591-1601.
[5] Hoehn MM,Yahr MD. Parkinsonism:Onset,progression and mortality[J].Neurology,1967,17(5):427-442.
[6] 胡巧霞,陈季志,查芹.血总胆固醇及血尿酸与帕金森病的关系探讨[J].浙江实用医学,2017,22(1):32-33,46.
[7] 王守章,刘红军.老年帕金森病患者血脂、同型半胱氨酸和尿酸水平的变化[J].中国老年学杂志,2017,37(19):4778-4779.
[8] Fabelo N,Martin V,Santpere G,et al. Severe alterations in lipid composition of frontal cortex lipid rafts from Parkinson′s disease and incidental Parkinson′s disease[J].Mol Med,2011,17(9-10):1107-1118.
[9] Qiang JK,Wong YC,Siderowf A,et al. Plasma apolipoprotein A1 as a biomarker for Parkinson disease[J].Ann Neurol,2013,74(1):119-127.
[10] Smeyne M,Smeyne RJ. Glutathione metabolism and Parkinson′s disease[J].Free Radic Biol Med,2013,62:13-25.
[11] 孙梅芬,周丽丽.帕金森病患者的临床特征与血脂血尿酸水平的相关性[J].中国实用神经疾病杂志,2016,19(15):83-85.
[12] Wang LJ,Hu W,Wang J,et al. Impact of serum uric acid albumin and their interaction on Parkinson′s disease[J].Neurol Sci,2017,38(2):331-336.
[13] 刘佳,但小娟,张慧.血尿酸水平及生活环境因素与帕金森病的相关性[J].中华神经科杂志,2016,49(7):548-552.
[14] Swanson CR,Li K,Unger TL,et al. Lower plasma apolipoprotein A1 levels are found in Parkinson′s disease and associate with apolipoprotein A1 genotype[J].Mov Disord,2015,30(6):805-812.
[15] Swanson CR,Berlyand Y,Xie SX,et al. Plasma apoli- poprotein A1 associates with age at onset and motor severity in early Parkinson′s disease patients[J].Mov Disord,2015,30(12):1648-1656.
[16] 王倩,秦伟伟,龙治华,等.帕金森病患者血清Cys C与炎症因子氧化应激反应的关系[J].中国实用神经疾病杂志,2019,22(2):149-153.
[17] Sakuta H,Suzuki K,Miyamoto T,et al. Serum uric acid levels in Parkinson′s disease and related disorders[J].Brain Behav,2017,7(1):e00 598.
[18] 劉久江,钱逸维,徐邵卿,等.不同性别帕金森病患者血尿酸水平的相关性研究[J].临床神经病学杂志,2016, 29(4):241-244.
[19] 周红,袁永胜,张克忠,等.早发型与晚发型帕金森病患者血浆抗氧化应激指标分析[J].中华老年心脑血管病杂志,2014,16(9):903-905.
[20] Vriend C,Van Balkom TD,Van Druningen C. Processing speed is related to striatal dopamine transporter availa-bility in Parkinson′s disease[J].Neuroimage Clin,2020,(26):102 257.
(收稿日期:2021-03-16)
