鸡gga-miR-31-5p 启动子真核表达载体的构建及其转录因子结合位点预测
2022-04-27邓哲宇王乙婷王颖洁吴宇慧赵宗仪左其生张亚妮
邓哲宇,王乙婷,王颖洁,胡 菜,吴宇慧,赵宗仪,左其生,张亚妮
(扬州大学 动物科学技术学院,江苏省动物遗传繁育与分子设计重点实验室,江苏 扬州 225009)
微小RNA(micro RNA,miRNA)是一类非编码、由具有发卡结构的单链前体RNA(precusor miRNA,pre-miRNA)经核酸酶Dicer剪切产生约为22个核苷酸长度的单链小RNA。随着高通量测序技术在生物研究中的大量应用,众多的miRNA被发现参与调控精子的发生过程。研究表明,miR-124a与Scp3作用,通过与粗线期精母细胞或精子细胞的H1t/GC-box 结合,进而激活 H1t 组蛋白启动子;miR-29b通过与Dnmt3a、Dnmt3b作用调控PGC向雌性生殖细胞分化;miR-18通过下调热休克蛋白2(HSP2)的表达而在小鼠精子发生过程中起到一定的调控作用;miR-34c通过靶向作用2以促进小鼠精原干细胞的分化;众多研究结果提示,miRNA在雄性生殖细胞的分化中起关键性的调控作用。本实验前期研究表明,miR-31可与8基因的3’端非编码区域(3-untranslated region,3′UTR)结合而抑制8表达,调控减数分裂的发生。
目前关于miR-31的研究大部分是集中于癌症方面:miR-31过表达会使人肺腺癌细胞周期阻滞在S期;miR-31通过抑制eNOS表达参与高糖诱导的内皮细胞功能障碍发生发展过程;miR-31通过下调结直肠癌中抑癌基因-1的表达从而增加转录因子HIF-1a的活性,最终间接上调HIF-1a所调控的下游肿瘤相关癌基因的表达。而关于调控其表达的机制尚未明确,仅唐燚等发现在小鼠肌原细胞系C2C12细胞中过量添加维甲酸可以促进miR-31-5p的表达。
启动子是基因表达调控的重要顺式元件,其活性的高低直接影响着蛋白的表达水平。根据启动基因表达方式的不同,启动子可以分为组成型启动子、诱导型启动子和组织特异型启动子三大类,它们通过不同的方式在基因表达中发挥重要作用。目前,已有不少的启动子被克隆,用于表达载体的构建。研究启动子功能应用比较广泛的方法是构建5′侧翼区或3′侧翼区部分片段的报告基因表达载体,通过瞬时转染法分析报告基因表达的情况来获得该片段是否具备启动子的功能及其转录活性的强弱。
鉴于此,本研究克隆了如皋黄鸡gga-miR-31-5p启动子5′侧翼区2 180 bp片段的启动子序列,置换pEGFP-N1的CMV启动子构建其pEGFP重组载体,瞬时转染DF-1细胞,初步确定gga-miR-31-5p启动子活性区域,同时利用在线预测软件对其启动子区域的转录因子进行预测,以期弄清机体内gga-miR-31-5p的转录影响因素,为后续进一步研究精子发生提供研究基础。
1 材料与方法
1.1 试验材料
1.1.1 种蛋、细胞和质粒
新鲜受精蛋来自中国农业科学院家禽研究所;鸡胚胎成纤维细胞系(DF-1)、pEGFP-N1、pEGFP-Linker为实验室保存。
1.1.2 试剂
PrimeSTARMax DNA Polymerase、6×loading Buffer和DL 5000 DNA Marker购自大连宝生物公司TaKaRa;限制性内切酶Ⅰ/dⅢ购自Bio-lab;通用型DNA纯化回收试剂盒(DP214)和无内毒素质粒小提中量试剂盒(DP118)购自天根生化科技(北京)有限公司;2×SoSoo连接酶、琼脂糖和大肠埃希菌DH5α感受态细胞购自北京擎科新业生物技术有限公司; FuGENEHD(E2311)购自Promega公司;Opti、胎牛血清、胰酶购自Gibco;Corning DMEM高糖培养基购自康宁公司;引物合成及测序由北京擎科新业生物技术有限公司完成。
1.1.3 仪器
PCR仪、浓度测定仪器、离心机、荧光酶标仪、CO培养箱购自Thermo;电泳系统购自北京六一公司;荧光定量PCR仪、凝胶成像系统购自Bio-Rad; SW-CJ医用型超净台购自苏州安泰空气技术有限公司;荧光倒置显微镜购自日本Olympus;正置荧光显微镜购自Nikon;数显电热恒温水浴锅购自上海跃进医疗器械厂;孵化箱购自德州市德城区瑞泰孵化设备研制中心。
1.2 试验方法
1.2.1 gga-miR-31-5p启动子区域预测与生物学分析
利用UCSC(http://genome.ucsc.edu/)和NCBI(http://www.ncbi.nlm.nih.gov/ gene/)对gga-miR-31-5p的premiRNA(GeneID:NR_031499.1)上游区域进行预测分析,选取上游2 180 bp序列,利用在线预测软件Promoter 2.0 Prediction Server(http://www.cbs.dtu.dk/servic-es/Promoter/)、PROMO HOME PAGE(http://alg gen.lsi. upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3) 和AliBaba 2.1(http://gene-regulation.com/pub/prog rams/alibaba2/in dex.html)对gga-miR-31-5p启动子区及其潜在的转录因子结合位点进行预测和分析。
1.2.2 pEGFP-miR-31-promoter重组质粒的构建与定性分析
基因组DNA的提取和gga-miR-31-5p启动子区克隆。参考《分子克隆实验指南》(第三版),采用常规的苯酚抽提法提取基因组DNA。利用UCSC和NCBI寻找gga-miR-31-5p的premiRNA上游区域序列。利用NEBuilder(https://nebuilderv1.neb.com/?tdsourcetag=s_pcqq_aiomsg)设计pEGFP-miR-31-promoter重组质粒同源重组引物F1/R1:F1:5′-taccgccatgcattagttattaatCCTGCAAGGTCACAGTGAAAC-3′,R1:5′-ccgtcgactgcagaattcgaagcttCTTGTTAGAAAGCCATCTG-3′(引物序列中小写字母为pEGFP-N1ⅠdⅢ两侧同源臂,扩增序列长度2 229 bp)。以18.5 d胚龄如皋黄鸡睾丸基因组DNA为模板,通过PrimeSTARMax DNA Polymerase进行PCR扩增gga-miR-31-5p启动子区域,反应体系:PrimeSTARMax DNA Polymerase 10 μL,F1 (10 μmol·L) 1 μL,R1(10 μmol·L) 1 μL,基因组1 μL ,ddHO 7 μL。反应程序: 98 ℃ 2 min;98 ℃ 10 s,58 ℃ 15 s,72 ℃ 20 s,35个循环;72 ℃ 7 min;4 ℃保存。反应结束后将PCR 产物经1.5%琼脂糖凝胶电泳分离检测,紫外灯下切下目的片段,并使用天根DNA纯化回收试剂盒进行目的片段回收,命名为miR-31-2180。
pEGFP-N1质粒酶切。利用限制性内切酶ⅠdⅢ对pEGFP-N1载体进行线性化并去除其CMV启动子,反应体系为:Ⅰ 1 μL,dⅢ 1 μL,10×Cutsmart Buffer 5 μL,质粒 1 μg,ddHO补足至50 μL,37 ℃水浴15 min,线性化的载体经1.5%琼脂糖凝胶电泳分离,紫外灯下切下目的片段,并使用天根DNA纯化回收试剂盒进行目的片段回收,命名为AH-pEGFP,-20 ℃保存备用。
pEGFP-miR-31-promoter重组质粒连接转化。利用同源重组酶将回收的PCR产物(gga-miR-31-5p启动子)与线性化的AH-pEGFP连接,反应体系为:2×SooSo Mix 5 μL,AH-pEGFP 3μL,miR-31-2180 2 μL。样品充分混合后,置于PCR仪中,50 ℃ 运行15 min。将连接产物10 μL加入至50 μL DH5α感受态细胞中,轻轻混匀,冰浴5 min,42 ℃水浴热激45 s,迅速置于冰中2 min,之后加入无抗生素LB液体培养基,置于37 ℃ 180 r·min摇床中1 h,瞬离浓缩菌液,弃上清800 μL,剩余菌液吹打均匀后取100 μL,利用无菌三角棒涂布于含卡那霉素的LB固体培养基中,37 ℃恒温倒置培养10~16 h。待LB固体培养基中长出单菌落后,利用灭菌后的白枪头挑取单菌落置于1 mL含卡那霉素的LB液体培养基中,37 ℃ 180 r·min摇床中摇菌8~12 h。
pEGFP-miR-31-promoter重组质粒鉴定。利用pEGFP-N1的通用引物对上述获得的菌液进行菌液PCR鉴定(N1F: 5′-acttgagcgtcgatttttgtgatgct-3′,N1R: 5′-CGTCGCCGTCCAGCTCGACCAG-3′,通用引物为pEGFP-N1酶切位点ⅠdⅢ两侧引物,扩增产物含有启动子片段,大小应为153 bp+插入片段+99 bp,pEGFP-N1进行扩增产物大小为911 bp)。反应体系:PrimeSTARMax DNA Polymerase 10 μL,N1F (10 μmol·L) 1 μL,N1R (10 μmol·L) 1 μL,菌液1 μL,ddHO 7 μL。反应程序:98 ℃ 2 min;98 ℃ 10 s,60 ℃ 10 s,72 ℃ 20 s,35个循环;72 ℃ 7 min;4 ℃保存。反应结束后向PCR 产物中加入6× loading buffer 混匀后经1.5%琼脂糖凝胶电泳分离检测,鉴定阳性菌液送北京擎科新业生物技术有限公司进行测序。测序阳性的菌液命名为pEGFP-miR-31-2180。
质粒DNA的提取。将pEGFP-miR-31-2180或pEGFP-N1载体按照1∶1 000的比例接种到7 mL含卡那霉素的LB液体培养基中,37 ℃,180 r·min,摇床培养12~14 h,待菌液浑浊呈发白状态是(值约为0.6)离心收集菌体。超净台保种2管,各1 mL。参照文献[10]进行质粒提取。
pEGFP-miR-31启动活性定性分析。将生长状态良好的DF-1细胞接种于24孔板,每孔约1.5×10个细胞,待细胞完全贴壁,汇合度达60%左右时,参照Fugene使用说明书,∶=3∶1,每孔500 ng质粒,将重组质粒pEGFP-miR-31-2180转染至DF-1细胞中,同时设置阳性对照组(pEGFP-N1转染细胞)、阴性对照组(pEGFP-Linker),转染48 h 后于荧光倒置显微镜下观察荧光表达情况。
gga-miR-31-5p启动子区转录因子结合位点的预测。利用UCSC(http://genome.ucsc.edu/)和NCBI(http://www.ncbi.nlm.nih.gov/gene/)对gga-miR-31-5p的premiRNA(GeneID:NR_031499.1)上游区域进行预测分析;利用在线预测软件Promoter 2.0 Prediction Server(http://www.cbs.dtu.dk/servic-es/Promoter/)、PROMO HOME PAGE(http://alg gen.lsi. upc.es/cgi-bin/promo_v3/promo/prom oinit.cgi?dirDB=TF_8.3) 和AliBaba 2.1(http://gene-regulation.com/pub/programs/alibaba2/in dex.html)对gga-miR-31-5p启动子区潜在的转录因子结合位点进行预测和分析。
2 结果与分析
2.1 鸡gga-miR-31-5p启动子区系列片段PCR扩增
为分析调控gga-miR-31-5p转录的关键因子,以18.5 d如皋黄鸡睾丸组织所提取全基因组DNA为模板,扩增出pre-miR-31上游2 180 bp片段,经1.5%琼脂糖凝胶电泳检测后发现,所获得的gga-miR-31-5p启动子区的PCR产物在2 000 bp marker附近存在特异性条带,大小与预期相符(图1),表明初步成功获得目的DNA片段。

M,DL5000 Marker;1,pEGFP-miR31-2180.图1 gga-miR-31-5p启动子片段PCR扩增结果Fig.1 PCR results of gga-miR-31-5p promoter fragment
2.2 鸡pEGFP-miR-31-promoter重组载体构建
利用同源重组技术将该片段连接至切除CMV启动子的pEGFP-N1载体中,经产物转化和挑菌扩摇后,利用pEGFP-N1通用引物N1F和N1R对重组质粒进行菌液PCR检测,并以pEGFP-N1载体作为对照(911 bp),PCR产物经琼脂糖凝胶电泳检测,发现在2 000~3 000 bp区域获得相应片段,大小与预期结果相符(图2);测序结果表明,miR31-2180重组载体构建成功(图3);并将其命名为pEGFP-miR-31-2180。
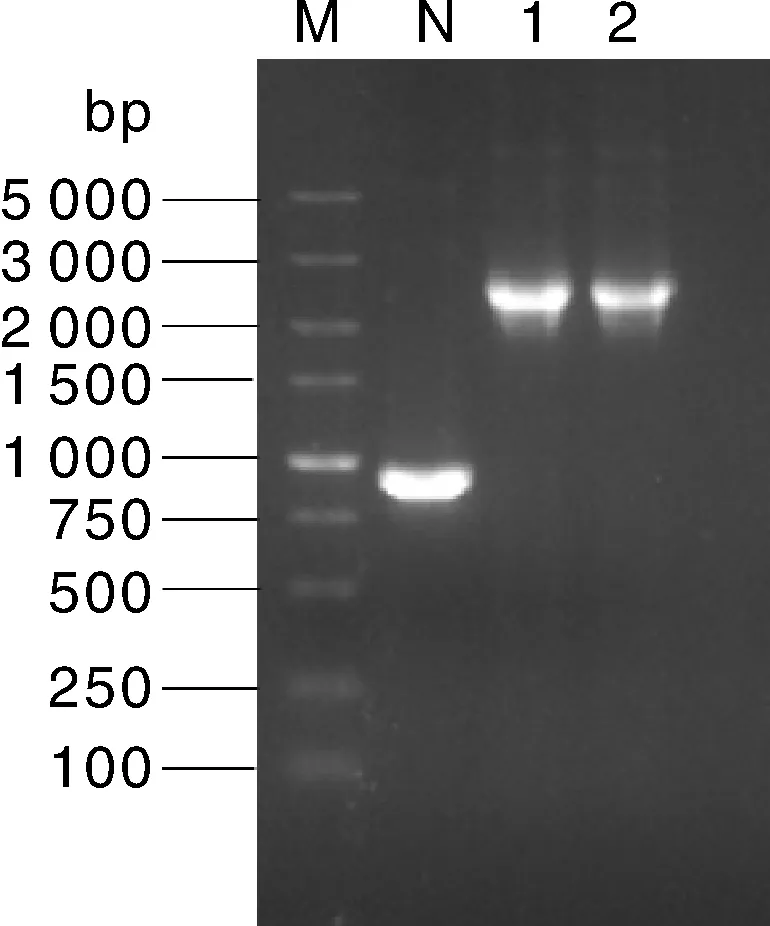
M, DL5000 Marker;N, pEGFP-N1;1 and 2, pEGFP-miR31-2180.图2 gga-miR-31-5p启动子系列载体菌液PCR结果Fig.2 PCR results of gga-miR-31-5p promoter
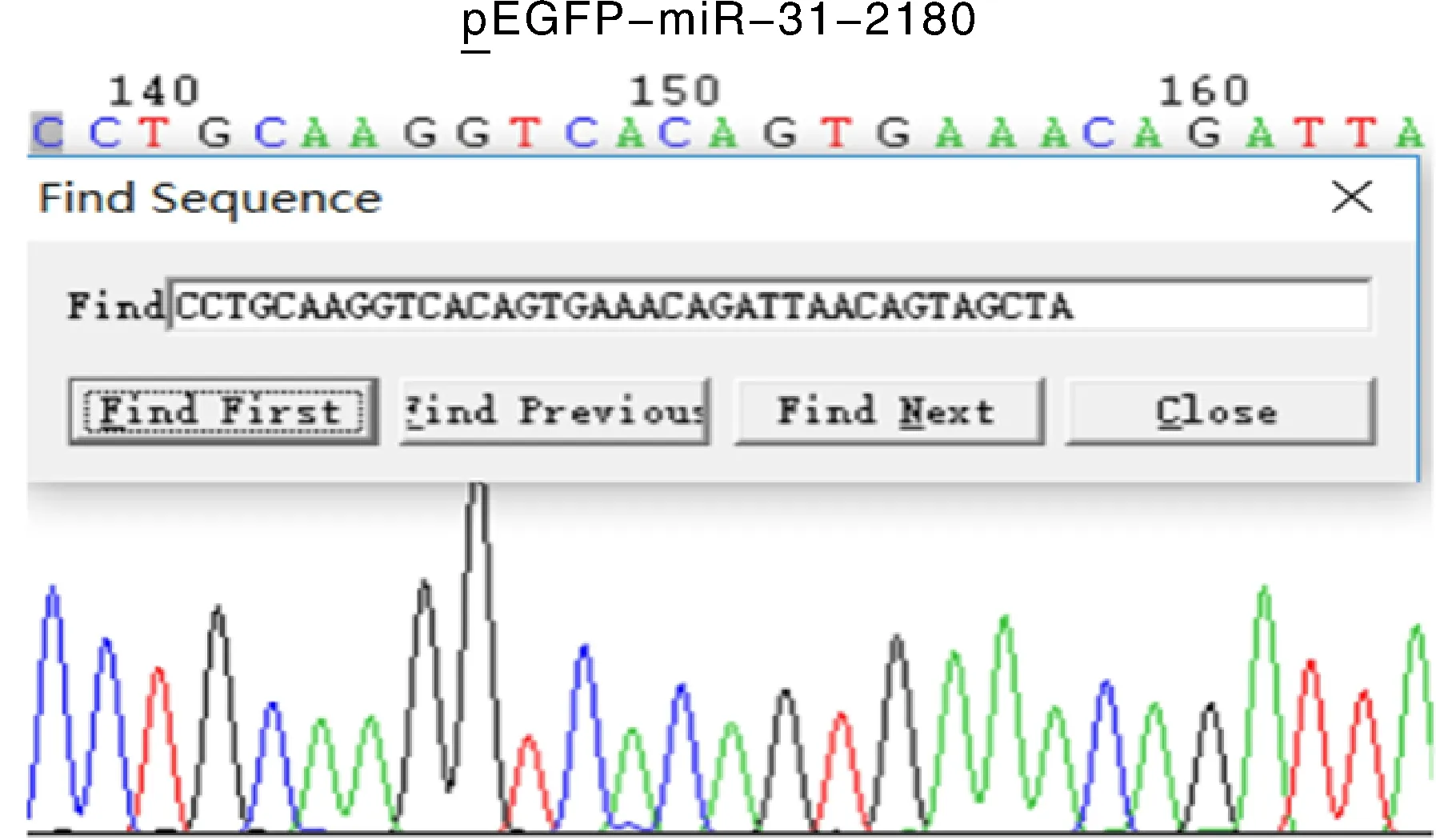
图3 pEGFP-miR-31-2180载体测序结果Fig.3 Sequencing results of pEGFP-miR-31-2180 vectors
2.3 鸡gga-miR-31-5p启动子活性的定性分析
为检测片段-2 180~+1 bp 是否具有启动子活性,将pEGFP-miR31-2180、pEGFP-N1和pEGFP-Linker分别转染DF-1细胞。结果表明,经pEGFP-miR31-2180转染的DF-1细胞表达GFP(图4),但其荧光强度弱于CMV驱动的阳性对照质粒pEGFP-N1(图4),而缺失CMV的阴性对照质粒pEGFP-Linker在细胞中未检测到GFP的表达(图4)。 因此,-2180~+1 bp片段具有启动子活性。
2.4 gga-miR-31-5p启动子区核心元件预测
利用AliBaba 2.1(http://gene-regulation.com/pub/programs/alibaba2/index.html)分别对-2180~+1 bp区域进行转录因子预测(表1),发现gga-miR-31-5p的启动区域含有AP-1、ATF、GR、RARα、c-Jun、HNF-4a、REV-ErbA、ER和HNF-1等结合位点等转录因子结合位点(表2)。由于在其启动子区检测到了RARa转录结合位点,进一步说明gga-miR-31-5p的转录极有可能受到RA调控。

图4 鸡gga-miR-31-5p启动子-2 180~+1 bp片段的活性检测Fig.4 Activity detection of gga-mir-31-5p promoter -2 180-+1 bp in chicken

表1 gga-miR-31-5p启动子区域转录因子预测
3 讨论
miRNA的正确转录由复杂的调控系统调节,转录因子与miRNAs前体(pre-miRNAs)启动子区的相互作用是其重要的组成部分。外界环境的各种刺激或不同发育阶段的各种信号会促使不同的转录因子与转录调控元件结合,激活或抑制miRNAs的转录,影响到成熟miRNAs的表达水平及其生物学功能,继而影响miRNA在机体发育中的作用。彭耀中等发现,1基因可能通过调节miRNA-148b-3p 启动子区域甲基化水平而影响肿瘤细胞的增殖;刘海亭等发现,早期生长反应因子(EGRl)可抑制miR-616的表达而上调CDC34的表达;吴大鹏等发现,X-inactivation gene(XIST)通过结合于miR-193a-3p的启动子区而调节阻抑剪切因子(Rsf-1)的表达,从而影响骨肉瘤的进展;陈诚等发现,过表达 TEAD1 可显著提升 miR-182 的表达而参与调控参与黑素瘤细胞转移;Jiang等通过荧光素酶报告基因检测发现,miR-378的启动子区域在其上游-698~-94 bp处含有SREBP和C/EBP结合位点;肌肉组织形成相关转录因子SRF和MyoD可调控心肌特异性表达的miR-1调节;Yin等发现,卵巢颗粒细胞中的类固醇因子-1(SF-1)能与miR-383的启动子区域结合而促进miR-383的表达;Janga等发现,miR-32位于其宿主基因跨膜蛋白245(transmenmbrance protein 245,TMEm245)的第14个内含子中,与其宿主基因共表达;且他们产生在内含子剪接之前,这些miRNAs和它的宿主基因mRNA来自于相同转录本,所以,调控这些miRNAs和它们相应的宿主基因表达应是相同机制。
本研究将如皋黄鸡gga-miR-31-5p前体RNA 5′侧翼区-2 180~+1 bp片段作为gga-miR-31-5p启动子片段进行启动子活性定性分析。以DF-1细胞为转染宿主细胞,Fugene介导转染,发现pEGFP-miR31-2180转染的DF-1细胞表达GFP,但其荧光强度较阳性对照质粒pEGFP-N1弱,而缺失CMV启动子的阴性对照质粒pEGFP-Linker在细胞中则未检测到GFP的表达。说明如皋黄鸡的gga-miR-31-5p前体RNA 5′侧翼区-2 180~+1 bp片段是具备其启动子活性的,但其启动活性及效率上不及作为阳性对照的CMV启动子。
为了深入了解gga-miR-31-5p的表达调控机制,进一步根据鸡gga-miR-31-5p启动子序列及其启动子活性定性分析实验结果,利用在线转录因子预测网站对如皋黄鸡gga-miR-31-5p 前体5′侧翼区2 180 bp片段序列进行分析,结果显示,该区域存在C/EBP alpha、c-Jun、GR、HNF-4α、HNF-1、HOXA4、ICSBP、IRF1、REV-ErbA、RAP1等转录因子结合位点;本实验室前期研究结果亦发现这些转录因子在不同细胞中存在差异表达,这些转录因子是否是引起gga-miR-31-5p表达差异的关键因子需要进一步的探究;前期研究亦表明,转录因子c-jun在有丝分裂向减数分裂转变过程中具有潜在的调控作用,Hoxa4则是在早期减数分裂表达,这些转录因子的调控作用是否经由gga-miR31-5p-stra8信号链起作用尚不清楚。gga-miR-31-5p启动子区域同样含有ER受体结合位点,研究表明,ERα基因敲除雄性小鼠缺乏雄激素转换为雌激素的芳香化酶,引起生殖缺陷和生殖细胞减少;在哺乳动物中ERβ亚型在睾丸所有生殖细胞中表达。因此,在生精过程中存在ERβ调控pre-miR-31的转录,通过影响gga-miR-31-5p-stra8信号,从而影响精子形成的可能。
4 结论
采用PCR方法成功克隆了如皋黄鸡的gga-miR-31-5p启动子区-2 180~+1 bp,成功构建了pEGFP-miR31-2 180重组载体,转染DF-1细胞后发现-2 180~+1 bp具有启动子活性,进一步确定该区域为gga-miR-31-5p启动子区;并发现该启动子区存在C-jun、RARα和ER等转录因子结合位点。
