真实世界中帕妥珠单抗用于HER-2阳性乳腺癌新辅助治疗的疗效评价
2022-04-26黄乐珍毛思颖张艳芳郭莉
黄乐珍 毛思颖 张艳芳 郭莉
广东省中医院乳腺科(广州510000)
帕妥珠单抗(pertuzumab,P)因在西方经典临床研究中证实了其有效性和安全性,目前已成为人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)阳性乳腺癌患者新辅助治疗联合用药的首选推荐[1-3]。在国内于2020年被纳入中国医保后开始较广泛使用,由于国内上市较晚,目前国内关于真实世界中在HER-2 阳性乳腺癌新辅助治疗中应用帕妥珠单抗联合化疗的疗效及安全性鲜有报道。 本研究回顾性分析广东省中医院乳腺科完成含帕妥珠单抗方案的新辅助治疗及手术的HER-2 阳性Ⅱ-Ⅲ乳腺癌患者的临床资料,现报道其疗效及不良反应。
1 对象与方法
1.1 研究对象及治疗方案 回顾性分析2019年3月1日至2022年1月20日在广东省中医院乳腺科诊断HER-2 阳性的Ⅱ-Ⅲ乳腺癌患者的临床资料,最终共纳入60 例女性,平均(48±10)岁。纳入标准:(1)经活检确诊为HER-2 阳性Ⅱ-Ⅲ乳腺癌患者;(2)至少含一个可测量靶病灶;(3)完成含帕妥珠单抗的新辅助治疗方案及根治性手术。排除标准:(1)临床或病理资料不完整;(2)未完成既定周期新辅助治疗;(3)疾病进展后更换新辅助治疗方案的病例。
所有患者靶向治疗均为帕妥珠单抗联合曲妥珠单抗(trastuzumab,H),每21 天给药,给药剂量:首次帕妥珠单抗840 mg,维持420 mg;首次曲妥珠单抗8 mg/kg,维持4 mg/kg。新辅助化疗方案包括表柔比星(epirubicin,E)联合环磷酰胺(cyclophosphamide,CTX)序贯多西他赛(docetaxel,T)即ECT、T 联合卡铂(carboplatin,Cb)即TCb、单药T。每21 天给药。给药剂量:表柔吡星90 ~95 mg/m2、环磷酰胺600 mg/m2、多西他赛75 mg/m2、卡铂血药浓度—时间曲线下面积=5 ~6 mg/(mL·min)。每周期治疗前排除化疗禁忌证及疾病进展,酌情化疗前后应用促粒细胞集落刺激因子。每3 个月应用心脏彩超评估左心室射血分数(left ventricular ejection fraction,LVEF)。每3 ~4 个周期应用乳腺MRI 或胸部CT 行临床疗效评价,新辅助治疗结束后10 ~14 d 接受根治性手术。
1.2 指标检测及疗效评价 常规免疫组化检查结果包括雌激素(estrogen receptor,ER)、孕激素(progesterone receptor,PR)、HER-2。判读遵循美国临床肿瘤协会(American Society of Clinical Oncology,ASCO)及美国病理学家协会(College of American Pathologists,CAP)2020 版雌孕激素受体检测指南[4],及2018年HER-2 指南[5-6]。ER 和PR 阴性为肿瘤细胞核<1%染色,1%~10%染色为弱阳性,≥10%染色为阳性。HER-2 免疫组化检测判读标准:3+为阳性,即>10%浸润癌细胞呈强、完整、均匀的细胞膜着色。2+为不确定,即>10%浸润癌细胞呈弱-中等强度的完整细胞膜染色。0/1+为阴性,即无染色或肿瘤细胞呈微弱的、不完整细胞膜着色。免疫组化不确定时需进一步原位杂交检测或更换标本检测。阳性为HER-2 平均拷贝数≥6.0 个信号/细胞或HER-2 平均拷贝数≥4.0 个信号/细胞且HER-2/CEP17比值≥2。阴性为HER-2平均拷贝数/细胞<4.0 且HER-2/CEP17 比值<2.0。其余情况建议重新计数,综合两次结果进行判读。
利用乳腺MRI 或胸部CT 于开始治疗前及每3 ~4 个周期治疗后对靶病灶进行检查,应用RECIST1.1 标准[7]行临床疗效评价。所有靶病灶消失及全部病理性淋巴结短直径减少至<10 mm 评价为完全缓解(complete response,CR)。与基线相比,靶病灶总长径之和缩小≥30%为部分缓解(partial response,PR)。靶病灶直径和增加≥20%且直径和绝对值增加至少5 mm,或出现一个或多个新病灶评价为疾病进展(progressive disease,PD)。介于PR与PD之间为疾病稳定(stable disease,SD)。本研究记录总体疗效评估。临床总缓解率(overall response rate,ORR)=(CR+PR)病例数/病例总数×100%。
对比治疗前及手术后组织病理标本,采用Miller-Payne 组织学分级系统[8]进行病理疗效评价。G5:原肿瘤瘤床部位已无浸润性癌细胞,但可存在导管原位癌。G4:浸润性癌细胞显著减少超过90%,仅残存散在小簇状癌细胞或单个癌细胞。G3 为浸润性癌细胞减少介于30% ~90%。G2:浸润性癌细胞减少总数不超过30%。G1:浸润性癌细胞无改变或仅个别癌细胞发生改变。本研究病理完全缓解(pathological complete response,pCR)为乳房原发灶无浸润性癌,即breast pCR(bpCR)。病理评价有效为G3+G4+G5。
安全性评价:由专职乳腺癌个案管理师记录每周期患者的不良反应及血液、心脏毒性,采用不良事件通用术语标准(common terminology criteria for adverse events,CTCAE)5.0版进行不良事件评价。
1.3 统计学方法 应用SPSS 26.0 软件进行数据分析。计量资料用()表示。计数资料用例(%)表示。
2 结果
2.1 一般资料 纳入的60 例患者中,术前新辅助治疗完 成TCbHP 方案25 例,EC-THP 方 案32 例,THP方案3例,全部完成根治性手术治疗。见表1。
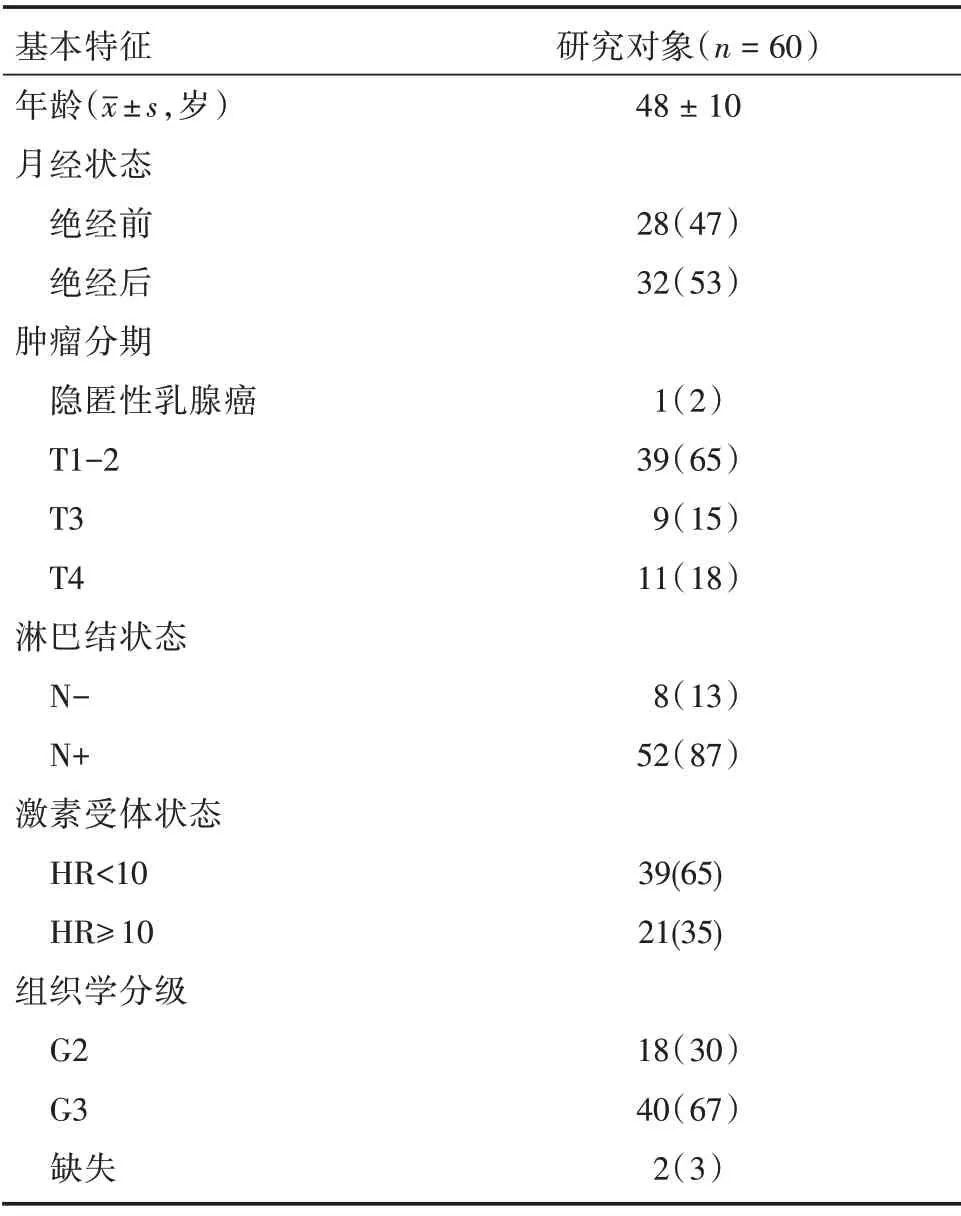
表1 一般资料及临床病理特征Tab.1 Patients′general information and clinicopathological features 例(%)
2.2 疗效评价 临床疗效评价:60 例患者中,7 例评价为CR(12%),42 例为PR(70%),11 例为SD(18%),无PD 病例。临床总缓解率(ORR)为82%。EC-THP、TCbHP、THP 组间ORR 分别为88%、80%、33%。病理疗效评价:G1 为0 例、G2 为6 例、G3 为10 例、G4 为12 例、G5(pCR)为32 例。pCR 率为53%。新辅助治疗病理有效率(G3+G4+G5)为90%。EC-THP、TCbHP、THP组间pCR分别为56%、48%、33%。
2.3 安全性评价 全部患者依从性良好,均未出现LVEF 下降>10%的情况,未发生严重不良反应事件。腹泻(53%)及骨髓抑制(50%)发生率较高,骨髓抑制情况发生后,经促粒细胞集落刺激因子治疗均可改善,未出现粒缺性发热发生。腹泻均为1-2 度,经对症处理后均可缓解,未发生3 度以上腹泻发生。见表2。
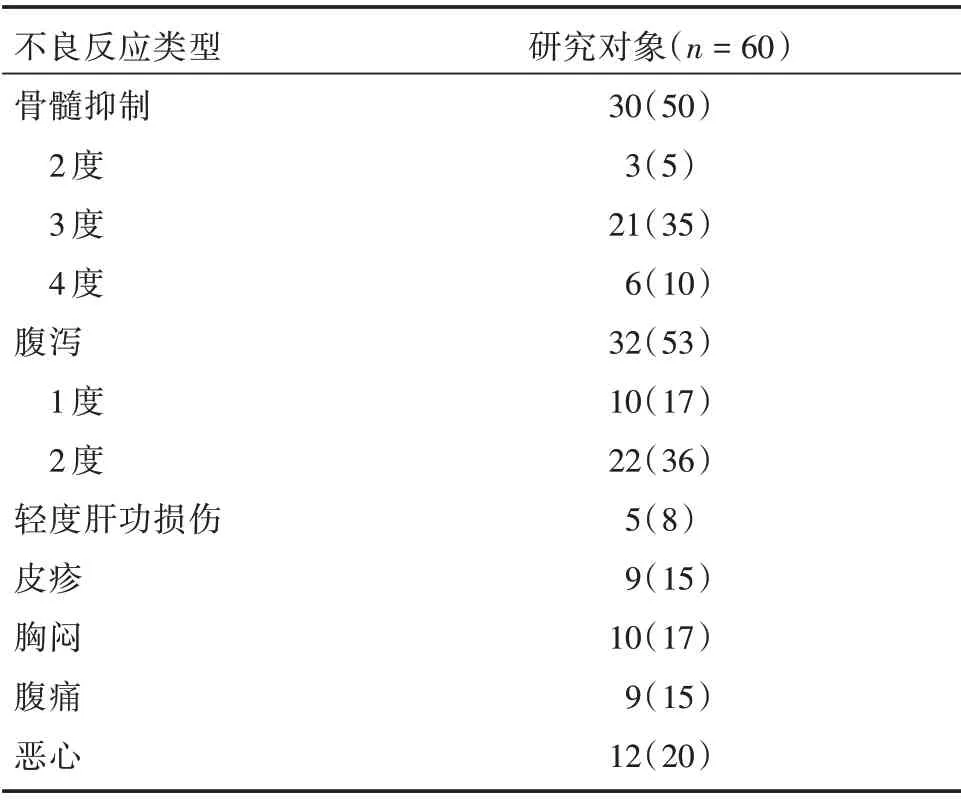
表2 不良反应事件统计表Tab.2 Adverse events statistics 例(%)
3 讨论
2020年全球乳腺癌的发病率位居第一,并仍处于快速上升期。乳腺癌患者中HER-2 阳性者约15% ~20%[9-11],是最具侵袭性的亚型之一。随着抗HER-2 靶向药物的出现,乳腺癌的综合治疗方式不断被更新[12]。欧美经典的NeoSphere 研究结果显示[13],联合帕妥珠单抗治疗后pCR 率提高了16.8%(P=0.014 1),开启了HP 曲帕联合新辅助双靶治疗。随后的TRYPHAENA 研究结果显示[14],无论HP 双靶联合哪种化疗方案,均可取得较高pCR 率。荟萃分析[15-16]也为应用曲帕双靶治疗显著提高pCR 率提供了循证医学证据。多项研究也已证实,HER-2 阳性乳腺癌患者新辅助治疗获得的pCR 对远期生存具有获益[17-18]。目前以HP 曲帕双靶为基础作为HER-2 阳性患者新辅助治疗的标准方案在国内外均已成为共识,EC-THP、TCbHP方案均推荐为首选治疗方案。由于国内上市较晚,目前国内关于真实世界中在HER-2 阳性乳腺癌新辅助治疗中应用HP 联合化疗的疗效及安全性的文章鲜有报道。
针对西方人群的NeoSphere 研究中,多西他赛联合曲帕双靶组的pCR 率为45.8%。采用联合化疗的TRYPHAENA 研究中,紫衫联合铂类化疗组较蒽环序贯紫杉化疗组有更高的pCR 率(66.2%vs.57.3%)。Train-2 研究中也显示,去蒽环化疗组与非去蒽环化疗组,pCR 率相当(68%vs.67%),且去蒽环类化疗组心脏毒副作用更少[19]。在联合化疗的治疗方案中,去蒽环类化疗似乎逐渐显示出优势。而本研究中,三种化疗方案均有使用,入组87%(52 例)为淋巴结阳性患者,65%(39 例)为雌激素受体<10%患者,总体pCR 率53%。EC-THP、TCbHP、THP 各组pCR 率分别为56%、48%、33%。结果显示含蒽环类化疗方案具有更高的pCR 率。在实际临床实践中,淋巴结阳性患者更易接受新辅助治疗方案。本研究提示,对于该类患者在含帕托珠单抗治疗基础上,含蒽环类联合化疗方案有更好获益可能。
针对亚洲人群的PEONY 研究中,使用单药多西他赛化疗联合HP 曲帕双靶新辅助治疗组pCR率为39.3%[20]。国内鲜有报道真实世界数据。程元甲等[21]报道10 例使用TCbHP 新辅助治疗患者pCR 率高达80.0%;黄世芬等[22]报道49 例HP 曲帕双靶治疗组总体pCR 率为55.1%,EC-THP 组与TCbHP 组pCR 率分别为76.9%、47.2%。由于国内药物使用时间较短,新辅助治疗时间周期较长,更多数据的报道需更长时间累积结果。本研究入组60 例患者,其结果对临床使用具有指导价值。
在副反应方面,本研究中全部患者未因不良反应事件导致化疗周期延迟。腹泻(53%)、骨髓抑制(50%)为常见主要不良反应。所有骨髓抑制情况发生后,经促粒细胞集落刺激因子治疗后均可改善,未出现粒缺性发热发生。腹泻程度均较轻,经对症处理后均可缓解。本研究证明无论联合哪种化疗方案,含帕妥珠单抗新辅助治疗方案的不良反应可控。
本研究证实了含帕妥珠单抗新辅助治疗方案在真实世界中的有效性及安全性。但由于单中心入组例数较少,样本量不足,结论具有局限性,无法对不同类型患者使用具体不同方案治疗效果进行统计学分析。另外,国内帕妥珠单抗使用时间较短,未能对患者进行长期追踪随访,尚未能验证其远期疗效。期待未来联合多中心入组更多患者使用及长期随访后,得出更多更细致的数据分析,为临床使用做出鉴别及推荐,为乳腺癌患者带来更大福音。
