miR-25对食管癌EC109细胞侵袭和迁移能力的影响及临床意义
2022-04-21李卿李轶君张国锐
李卿,李轶君,张国锐
食管癌起病隐匿,早期可无症状,手术切除是治疗食管癌最主要的手段,但患者手术后仍可发生肿瘤复发转移,以致死亡[1-2]。该病重在早期诊断,而目前尚缺乏可靠、准确的分子标志物。因此,探索食管癌发生的相关分子机制,寻找新的早期诊断标志物成为食管癌研究的重点和难点。研究表明,miR-25 在肿瘤中异常表达,能影响乳腺癌[3]、肺癌[4]、胃癌[5]、肝癌[6]等多种肿瘤的进展,但在食管癌中的报道少见。盐诱导激酶1(salt-inducible kinase 1,SIK1)是一种蛋白编码基因,在细胞生长、细胞周期、代谢、机体稳态等方面发挥关键作用[7-10]。本研究通过检测食管癌组织和癌旁组织中miR-25的表达差异,探讨过表达和干扰miR-25表达通过SIK1影响食管癌细胞侵袭和迁移的机制,并进一步验证外泌体来源的miR-25能否作为食管癌无创诊断的标志物,为食管癌的早期诊断和优化治疗提供理论依据。
1 资料与方法
1.1 临床标本 收集2015 年1 月—2020 年6 月在湖南省郴州市第一人民医院胸心外科行手术治疗的食管癌患者,选择经病理或消化内镜诊断明确的处于早期(0~Ⅰ期)的原发性食管癌54例,所有患者术前均未进行放疗、化疗以及其他辅助治疗。手术切除的癌组织和癌旁组织标本均于-80 ℃低温冰箱中冻存备用。按照1∶1配对原则,选择性别匹配、年龄相差5 岁且无胃肠道疾病的体检健康者54 例作为对照。本研究经本院伦理学委员会批准,所有研究对象知情并签署知情同意书。
1.2 实验材料 人食管癌细胞EC109 购于国家生物医学实验细胞资源库;DMEM 培养基、胎牛血清、青霉素-链霉素双抗、胰蛋白酶、CCK-8试剂盒、4%多聚甲醛固定液、细胞裂解液、BCA 蛋白定量试剂盒购于上海碧云天生物技术有限公司;Matrigel基质胶购于美国BD公司;lipofectamine 3000试剂盒购于美国赛默飞公司;鼠源GAPDH 一抗、兔源SIK1一抗、羊抗鼠二抗、羊抗兔二抗、ECL化学发光底物、TRIzol 法RNA提取试剂盒、pcDNA 3.1 和pmirGLO 质粒均购于生工生物工程股份有限公司;miRNA 逆转录试剂盒、荧光定量PCR(qPCR)试剂盒购于武汉爱博泰克生物科技有限公司;PCR引物序列由北京天一辉远生物科技有限公司合成;双荧光素报告酶试剂盒购于美国Promega 公司。多功能酶标仪(Multiskan FC)购于美国赛默飞公司,SDS-PAGE 电泳仪(DYCZ-24DH)购于北京六一仪器厂;CO2细胞培养箱(MCO-18AC)购于上海天呈科技有限公司;qPCR仪(ABI 7500)购于美国ABI 公司;倒置显微镜(YKDZ-400)购于上海永科光学仪器有限公司;超净工作台(SW-CJ-2FD)购于苏洁医疗器械有限公司;高速冷冻离心机(Optima XPN)购于美国贝克曼库尔特公司;透射电镜(JEOL JEM-2800)购于日本电子株式会社。
1.3 qPCR检测miR-25表达 根据说明书要求,TRIzol法提取癌组织及癌旁组织总RNA,逆转录成cDNA 后进行荧光定量PCR。PCR 引物序列见表1。反应体系:SYBR premix 10 µL,PCR 上、下游引物各 1 µL,DNA 模板 1 µL,ddH2O 7 µL,总体积20 µL。反应条件:95 ℃预变性10 min;95 ℃变性10 s,58 ℃退火25 s,共40 个循环。miRNA 的相对表达水平用U6进行标准化,相对表达量用2-ΔΔCt法进行计算。

Tab.1 Primer sequence for qPCR表1 qPCR引物序列
1.4 过表达和沉默miR-25对EC109细胞生物学行为的影响
1.4.1 细胞培养 将EC109 细胞接种于含有10%胎牛血清和1%双抗的DMEM 培养基中,在37 ℃、5%CO2的恒温培养箱中培养。待细胞融合度达到80%左右进行传代培养,取处于对数生长期且状态良好的细胞进行后续实验。
1.4.2 细胞转染 EC109细胞接种于6孔板中,预培养12 h,待细胞融合度达到70%左右后将培养基更换成无血清、无双抗的DMEM 培养基。按照lipofectamine 3000 试剂盒的操作说明进行转染。转染组包含:miR-25 过表达组(miR-25 mimic 组)、过表达对照组(NC mimic 组)、miR-25 干扰组(miR-25 inhibitor 组)和干扰对照组(NC inhibitor 组)。NC mimic、miR-25 mimic、NC inhibitor 和 miR-25 inhibitor 均由苏州吉玛基因股份有限公司合成。转染完成后按照1.3中方法检测miR-25表达,以确定转染效率。
1.4.3 Transwell 检测细胞的迁移和侵袭能力 Transwell 小室用基质胶预先孵育2 h,期间将转染48 h 的细胞用胰蛋白酶消化。用不含血清和双抗的DMEM 培养基将细胞稀释为5×105个/mL,取100 µL 细胞悬液加入到Transwell 小室上室中,将 Transwell 小室置于 24 孔板中,下室加入 600 µL 含有20% 胎牛血清的DMEM 培养基,继续培养24 h。取出Transwell小室,用4%多聚甲醛固定20 min,0.1%结晶紫室温下染色15 min,最后用脱脂棉球轻轻擦去Transwell上室中未发生侵袭的细胞。细胞迁移实验则直接将消化后的细胞稀释至 5×105个/mL,取 100 µL 细胞悬液加入到 Transwell 上室中,然后在下室中同样加入600 µL 含有20%胎牛血清的DMEM 培养基,24 h 后对上室中的细胞进行固定染色。将Transwell小室晾干后置于显微镜下拍照,并分别计算细胞侵袭和迁移的数量,实验重复3次。
1.5 miR-25的靶基因预测及验证
1.5.1 Targetscan 数据库预测miR-25 的靶基因 使用Targetscan 数据库(http://www.targetscan.org/vert_71/)预测miR-25的潜在靶点是否包含SIK1基因。
1.5.2 Western blot 实验 取转染后的4组细胞,加入适量蛋白裂解液,冰上裂解30 min,12 000 r/min离心15 min,吸取上清液,使用BCA试剂盒测定蛋白浓度。对样品进行10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳。蛋白分离后转移到PVDF膜上,在室温下用5%脱脂奶粉封闭1 h。用含1%吐温20 的TBS 洗膜,加入一抗(1∶5 000)于4 ℃孵育过夜,随后用二抗(1∶10 000)37 ℃孵育1.5 h。使用增强型化学发光检测试剂盒进行显影,用凝胶成像仪捕获条带图像,然后用Image J 软件进行半定量分析。以GAPDH 作为内参,实验独立进行3次。
1.5.3 双荧光素酶报告实验 将SIK1 的野生型和突变型序列分别克隆到pmirGLO 质粒上。miR-25 mimic 和miR-25 inhibitor与SIK1 3'UTR野生型和突变型质粒共转染至EC109细胞,并以各自NC序列作为对照。48 h后,使用双荧光素酶报告基因分析系统检测荧光素酶活性。
1.6 Transwell 检测 miR-25 靶向 SIK1 对 EC109 细胞迁移和侵袭能力的影响 EC109 细胞分为pcDNA 3.1 组、SIK1 过表达组和miR-25+SIK1 过表达组。分组转染后Transwell 实验检测miR-25 靶向SIK1 对EC109 细胞侵袭和迁移能力的影响,实验步骤同1.4.3。
1.7 血浆外泌体的提取及miR-25 表达水平检测 将54 例食管癌患者和健康对照者的血浆样本300×g离心10 min,2 000×g离心 15 min,以去除细胞碎片,然后 12 000×g离心30 min,去除上清液,得到外泌体。使用0.22µm的过滤器进行过滤除菌,最后适量磷酸盐缓冲液重悬浮。外泌体提取后参照1.3中实验步骤检测miR-25的表达量,并分析食管癌患者癌组织与血浆外泌体中miR-25表达的相关性。
1.8 统计学方法 采用graphpad prism 8.0.3 软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,2组间均数比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验。相关性分析采用Pearson相关。P<0.05为差异有统计学意义。
2 结果
2.1 食管癌组织和癌旁组织中miR-25表达水平比较 食管癌组织中miR-25 相对表达水平高于癌旁组 织(6.00±3.34vs.1.49±0.78,t=9.665,P<0.01),见图1。

Fig.1 qPCR detection of the relative expression level of miR-25 in esophageal cancer tissues and adjacent tissues图1 qPCR检测miR-25在食管癌组织和癌旁组织中的相对表达水平
2.2 miR-25在EC109细胞中的转染效率 转染48 h后,miR-25 mimic 组 miR-25 表达水平较 NC mimic组上调约 8.40 倍(t=18.700,P<0.01),而 miR-25 inhibitor 组 miR-25 表达水平较 NC inhibitor 组下调约33.6%(t=10.220,P<0.01),见图2。
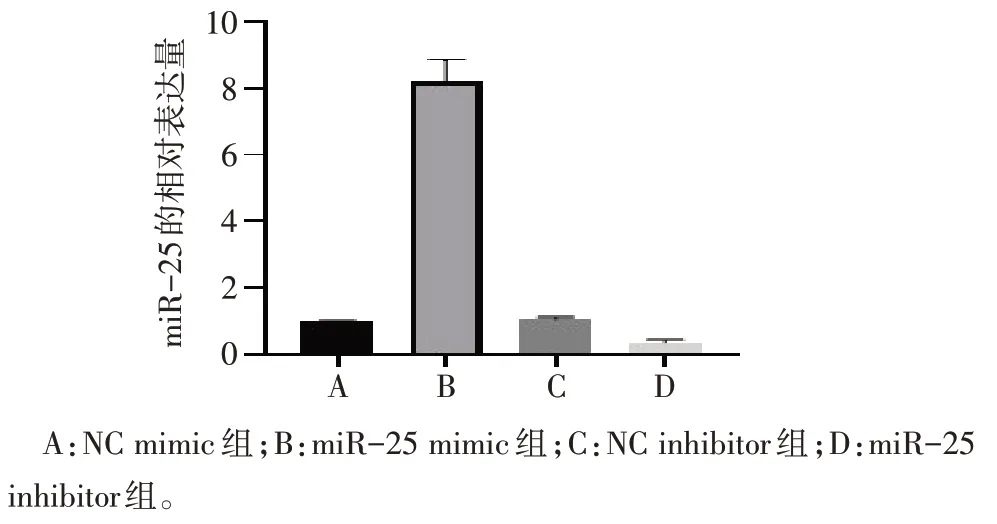
Fig.2 Overexpression and interference efficiency of miR-25 in EC109 cells detected by qPCR图2 qPCR检测miR-25在EC109细胞中的过表达和干扰效率
2.3 过表达和敲低miR-25 对EC109 细胞侵袭和迁移的影响 Transwell 实验显示,与NC mimic 组相比,miR-25 mimic 组侵袭和迁移的细胞数增多(P<0.05)。miR-25 inhibitor 组中侵袭和迁移的细胞数较NC inhibitor组下降(P<0.05),见图3、表2。

Fig.3 Migration and invasion of EC109 cells after overexpression and knockdown of miR-25 were detected by Transwell assay(×100)图3 Transwell实验检测过表达和敲低miR-25后EC109细胞的迁移和侵袭能力(×100)
Tab.2 Effects of overexpression and knockdown of miR-25 on migration and invasion of EC109 cells表2 过表达和敲低miR-25的各组EC109细胞迁移和侵袭能力变化 (n=3,个/视野,)

Tab.2 Effects of overexpression and knockdown of miR-25 on migration and invasion of EC109 cells表2 过表达和敲低miR-25的各组EC109细胞迁移和侵袭能力变化 (n=3,个/视野,)
*P<0.05,**P<0.01。
组别NC mimic组miR-25 mimic组t细胞侵袭数73.0±6.9 93.0±5.9 3.794*细胞迁移数69.3±3.2 87.4±2.1 8.153**组别NC inhibitor组miR-25 inhibitor组t细胞侵袭数73.6±7.4 36.7±5.4 6.947**细胞迁移数72.7±3.1 39.1±5.9 8.770**
2.4 miR-25 的靶基因的预测和验证 通过Targetscan 数据库预测发现 SIK1 为 miR-25 的靶基因,见图 4。Western blot 结果显示 miR-25 过表达后,SIK1 的相对蛋白表达量较NC mimic 组下降(0.25±0.07vs.0.92±0.08,t=11.680,P<0.01)。敲低miR-25后SIK1的蛋白表达量较NC inhibitor 组升高(0.79±0.05vs.0.44±0.08,t=6.369,P<0.01),见图5。

Fig.4 Targetscan database predicts the 3'UTR binding of miR-25 to SIK1图4 Targetscan预测miR-25与SIK1的3'UTR结合

Fig.5 The effect of overexpression and knockdown of miR-25 on the expression of SIK1 detected by Western blot assay图5 Western blot检测过表达和敲低miR-25对SIK1表达量的影响
2.5 双荧光素酶报告实验 结果显示,miR-25 mimic 与SIK1 3'UTR 野生型质粒共转染后,细胞荧光素酶活性降低(P<0.01),见图6。而miR-25 inhibitor 与 SIK1 3'UTR 野生型质粒共转染 EC109 细胞后,荧光素酶活性升高(P<0.01),见图7。

Fig.6 Double luciferase reporter assay confirmed the change of luciferase activity after the simultaneous action of miR-25 mimic and SIK1 3'UTR图6 双荧光素报告酶实验验证miR-25 mimic与SIK1 3'UTR同时作用后荧光素酶活性的变化
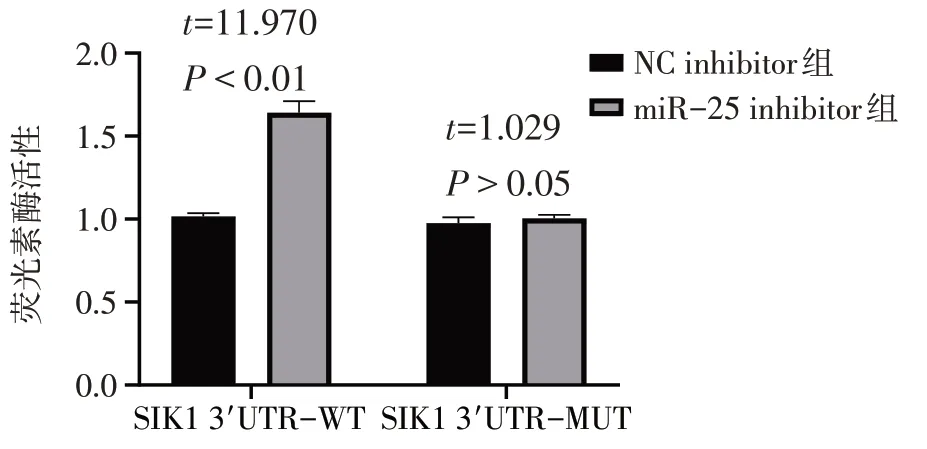
Fig.7 Double luciferase reporter assay confirmed the change of luciferase activity after the simultaneous action of miR-25 inhibitor and SIK1 3'UTR图7 双荧光素酶报告实验验证miR-25 inhibitor与SIK1 3'UTR同时作用后荧光素酶活性的变化
2.6 miR-25通过靶向SIK1促进EC109细胞的侵袭和迁移 Transwell 实验显示,与pcDNA 3.1 组相比,SIK1 过表达组EC109 侵袭和迁移的细胞数量减少,而miR-25+SIK1过表达组EC109侵袭和迁移的细胞数量较SIK1过表达组增多,见图8、表3。

Fig.8 Transwell experiment verified that miR-25 promoted the invasion and migration of EC109 through SIK1(×100)图8 Transwell实验验证miR-25通过SIK1促进EC109的侵袭和迁移(×100)
Tab.3 Effects of SIK1 overexpression on migration and invasion of EC109 cells表3 SIK1过表达各组对EC109细胞迁移和侵袭的影响(n=3,个/视野,)

Tab.3 Effects of SIK1 overexpression on migration and invasion of EC109 cells表3 SIK1过表达各组对EC109细胞迁移和侵袭的影响(n=3,个/视野,)
**P<0.01。
组别pcDNA3.1组SIK1过表达组miR-25+SIK1过表达组F细胞侵袭数97.5±6.6 46.7±6.6a 67.8±8.1ab 38.280**细胞迁移数72.5±2.2 33.2±3.9a 59.9±8.0ab 43.320**
2.7 食管癌患者和健康对照血浆外泌体中miR-25的相对表达量 食管癌患者血浆外泌体中miR-25的相对表达量高于健康对照(t=8.534,P<0.01),与在食管癌组织中的表达趋势一致,见图9。

Fig.9 qPCR detection of miR-25 expression in esophageal cancer and healthy human plasma exosomes图9 qPCR检测食管癌和健康人血浆外泌体中miR-25的表达量
2.8 miR-25 在食管癌组织和血浆外泌体中的表达相关性 外泌体中miR-25 的相对表达量与食管癌患者组织中的相对表达量呈正相关(r=0.767,P<0.01),见图10。

Fig.10 Correlation of miR-25 expression in esophageal cancer tissue and plasma图10 miR-25在食管癌组织和血浆中的表达相关性
3 讨论
食管癌是原发于食管的恶性肿瘤,好发于中老年男性。食管癌患者早期治疗预后较好,但患者整体生存率仍然较低,究其原因主要是发现食管癌时患者多已处于中晚期,导致治疗后容易复发[11-12]。因此,迫切需要寻找新的食管癌诊断标志物以早期诊断,从而改善食管癌患者预后。
外泌体是一种直径在50~150 nm 的细胞外囊泡,广泛存在于各种体液中。外泌体是脂质双分子层,能够保护囊泡内的miRNA 不被RNA 酶降解,从而保证miRNA 浓度稳定。外泌体的内容物可反映母体细胞的特性,因此外泌体在肿瘤等疾病的诊断、预后预测等方面具有较大潜力[13]。外泌体来源的miRNA 能够作为前列腺癌、结肠癌的无创的诊断标志物[14-15],能否作为食管癌早期诊断的生物标志物仍不明确。研究表明,miR-25能够参与多种肿瘤的进展,主要包括促进肿瘤的增殖、转移与侵袭[16],抑制肿瘤细胞凋亡[17],调控细胞周期[18]及自噬[19]等。在本研究中,笔者首先通过临床标本检测发现miR-25 在食管癌组织中的表达量高于癌旁组织,与Liu等[20]研究结果一致。进一步研究发现,过表达miR-25 后,EC109 细胞侵袭和迁移能力明显增强,说明miR-25可能参与了食管癌的进展。随后,本研究通过双荧光素酶报告实验证实SIK1是miR-25的靶基因。既往有研究表明,SIK1 活化可以促进p53 相关细胞失巢凋亡,并抑制细胞的克隆性生长[21],且SIK1 表达降低与乳腺癌[21]、胰腺癌[22]、肝细胞癌[23]和卵巢癌[24]的进展、转移和不良预后有关。因此,SIK1被认为是抑癌基因。然而,SIK1在食管癌中的表达状况及其临床意义尚不清楚。本研究证实,过表达SIK1能够抑制食管癌EC109细胞侵袭和迁移,而miR-25靶向抑制SIK1表达后,EC109细胞侵袭和迁移能力较过表达SIK1 组升高,提示miR-25 可能是通过影响SIK1 的表达来调节EC109 细胞的生物学特性。最后,笔者发现食管癌患者血浆外泌体中的miR-25表达水平明显高于健康人群,且与食管癌组织中的表达量呈正相关,提示外泌体miR-25可能作为食管癌早期诊断的生物标志物。
本研究证实,miR-25可能通过外泌体分泌到外周血中发挥生物学功能,具有早期诊断食管癌的潜力。后续将纳入其他分期的食管癌标本,研究不同分期的食管癌中miR-25的表达趋势,同时进一步挖掘miR-25 在食管癌中发挥的其他功能以及与SIK1相关的信号通路,以期明确其具体作用机制。
