吡格列酮对高糖高脂诱导大鼠H9C2心肌细胞凋亡的影响及其机制探讨
2022-04-21陈旭施凯佳王姣姚姗周田姜成龙陈小盼
陈旭,施凯佳,王姣,姚姗,周田,姜成龙,陈小盼
2型糖尿病为全球高发性疾病,各种急、慢性并发症涉及全身多个器官和组织,其中糖尿病心肌病(diabetic cardiomyopathies ,DCM)是一种独立于冠心病、高血压和心脏瓣膜病的心脏疾病,治疗困难且病死率较高[1-2]。2型糖尿病患者因胰岛素抵抗可致能量利用与消耗的失衡,造成糖脂代谢紊乱,使得心肌细胞逐渐出现氧化应激、凋亡以及炎症反应等变化,心功能逐渐失代偿,最终导致心力衰竭甚至猝死[3-4]。目前,临床上缺乏有效根治DCM 的方法,强化血糖和血脂的控制只能减缓而不能逆转心力衰竭的进展。吡格列酮(PGZ)是一种有效的胰岛素增敏剂,能够保护胰岛β细胞功能,改善胰岛素抵抗相关的糖脂代谢紊乱、全身性炎症反应及动脉粥样硬化等,具有抗氧化应激、抗凋亡的作用[5-6]。研究表明,PGZ 在体外可以改善H2O2、缺氧复氧等有害刺激诱导的线粒体氧化应激,减少活性氧簇(ROS)的产生,进而影响到蛋白激酶B(AKT)等信号通路的传导[7-8]。因此,PGZ 有可能通过抑制 ROS,促进 AKT通路活化,从而对心肌细胞的凋亡产生影响。目前,有关在高糖(HG)高脂环境下PGZ 对心肌细胞的作用及其机制的研究鲜见。本研究构建了高糖棕榈酸诱导的H9C2心肌细胞高糖高脂损伤模型,探讨PGZ对其影响及可能机制,为揭示PGZ 在糖尿病源性心脏疾病中的分子机制提供参考。
1 材料与方法
1.1 主要试剂与仪器 H9C2大鼠心肌细胞购自武汉Procell公司;PGZ购自上海MCE公司;DMEM培养基、胰蛋白酶购自美国Gibco 公司;胎牛血清(FBS)、青/链霉素、二甲基亚砜(DMSO)、10~180 ku 彩色预染蛋白分子Marker、BCA 蛋白测定试剂盒、SDS-PAGE制胶试剂盒、ECL显色试剂盒购自上海YEASEN 公司;磷酸盐缓冲液(PBS)购自美国HYclone 公司;棕榈酸(PA)和高脂溶剂购自西安鲲创科技发展有限公司;CCK-8 试剂购自日本同仁公司;超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒购自南京建成生物公司;AnnexinV-FITC/PI凋亡试剂盒、活性氧检测试剂盒购自上海翊圣生物科技有限公司;兔抗蛋白激酶B(T-AKT)、磷酸化蛋白激酶B(PAKT)、半胱氨酸天冬氨酸蛋白激酶3(Caspase3)、剪切半胱氨酸天冬氨酸蛋白激酶3(C-Caspase3)抗体购自美国CST生物公司;兔抗B-淋巴细胞瘤基因-2(BCL-2)、BCL-2 相关X 蛋白(BAX)、肌纤蛋白(ACTIN)抗体购自北京BIOSS 公司;N-乙酰半胱氨酸(N-acteyl-L-cysteine,NAC)购自美国GLPBIO公司;辣根过氧化物酶标记羊抗兔二抗购自武汉三鹰公司;RIPA裂解液、PMSF、上样缓冲液、电泳缓冲液、转膜液、TBST缓冲液、0.22µm PVDF膜、牛血清白蛋白(BSA)、磷酸酶抑制剂、一抗稀释液、二抗稀释液及脱脂奶粉购自北京biosharp公司。
1.2 细胞培养及分组 H9C2 心肌细胞采用含1%双抗和10%FBS的DMEM培养基培养,置于5%CO2、37 ℃培养箱中,1~2 d 换液,2~3 d 传代。细胞融合率达80%~90%后进行后续试验。
1.2.1 不同浓度PA 作用不同时间后对H9C2 细胞活力的影响 采用 0、0.05、0.1、0.2 和 0.4 mmol/L 的 PA 分别干预细胞12、24、48 h后用CCK-8法进行细胞毒性试验,选定0.1 mmol/L浓度作为后续实验浓度。
1.2.2 实验2 观察不同浓度葡萄糖作用不同时间后对细胞活力的影响,采用25、35、50、75 和100 mmol/L 的葡萄糖分别干预细胞 12、24、48 h 后进行CCK-8 试验,选定 50 mmol/L 浓度作为后续实验浓度。
1.2.3 实验3 观察在高糖棕榈酸环境下不同浓度PGZ作用不同时间对H9C2细胞活力影响,将细胞随机分为9组:对照组(25 mmol/L 葡萄糖)、溶剂组(棕榈酸溶剂+0.1%二甲基亚砜)、HGPA 组(50 mmol/L 葡萄糖+0.1 mmol/L 棕榈酸)、(2.5、5、10、20、40、80 µmol/L PGZ+HGPA)PGZ 组,分别干预细胞12、24、48 h 后进行CCK-8 试验,选定5、10 µmol/L 浓度作为后续实验浓度。
1.2.4 实验4 研究PGZ 在高糖棕榈酸环境下对H9C2 细胞凋亡的影响及其机制,将细胞分为5组:对照组(25 mmol/L葡萄糖)、溶剂组(棕榈酸溶剂+0.1%二甲基亚砜)、HGPA 组(50 mmol/L葡萄糖+0.1 mmol/L棕榈酸)、H-PGZ组(10µmol/L PGZ+HGPA)和L-PGZ 组(5 µmol/L PGZ+HGPA),干预48 h进行后续实验。
1.2.5 实验5 验证ROS对于AKT通路和H9C2细胞凋亡的影响,将细胞分为HGPA 组和NAC+HGPA 组(1 mmol/L NAC预处理 2 h+HGPA)干预 24 h,Western blot 法检测AKT 通路及凋亡相关蛋白表达。
1.3 CCK-8 法检测细胞活力 将细胞悬液以每孔1×104个细胞密度接种于96孔板内,每孔100µL,每组5个复孔,置于常规培养箱孵育,细胞融合度达80%时,根据1.2.1、1.2.2、1.2.3 分组,每孔加入10 µL CCK-8 试剂后再继续孵育细胞1.5 h,在450 nm 波段处测定其光密度(OD)值,重复3 次,取平均值。
1.4 AnnexinV-FITC/PI双染法检测细胞凋亡率 H9C2以每孔1×105个心肌细胞接种于6孔板内,每孔加培养液1 mL,待细胞融合至约80%后按1.2.4 分组干预细胞48 h,用不含EDTA 的胰酶消化并收集细胞,PBS 重悬2 次后,加入Annexin V 结合缓冲液并在避光条件下用5 µmol/L Annexin V-FITC 孵育15 min,加入10 µmol/L 碘化丙啶(PI)避光孵育5 min 后通过流式细胞仪进行分析。细胞凋亡率=Q2细胞比率+Q3细胞比率。
1.5 DCFH-DA 法检测ROS 水平 用无血清的DMEM 稀释DCFH-DA,使其终浓度为10µmol/L,按照1.2.4 分组干预细胞后分别加入1 mL稀释好的DCFH-DA,置于37 ℃培养箱内孵育20 min后流式细胞仪检测ROS水平。
1.6 微板法检测各组SOD、MDA水平 将细胞培养在6孔板内,按照1.2.4分组干预细胞后收集细胞并超声破碎,按照试剂说明书操作检测各组MDA、SOD水平,重复3次。
1.7 Western blot 法测蛋白 根据1.2.4、1.2.5 分组干预后裂解并提取各组细胞总蛋白(冰上操作),BCA法蛋白定量。按需制取SDS-PAGE 胶并放入电泳槽后进行上样。接着进行电泳,浓缩胶80 V 稳压至Marker 分离,改为分离胶120 V 稳压至溴酚蓝指示液抵达凝胶底层,停止电泳。湿法转膜2 h(冰水浴)。转膜后用5%脱脂牛奶封闭液封闭2 h。T-AKT、P-AKT、BAX、BCL-2、Caspase3、C-Caspase3、ACTIN 一抗(均1∶1 000 稀释)在4 ℃下孵育过夜。孵育后洗膜3 次。二抗(1∶10 000)摇床孵育2 h。洗膜后加ECL发光液,避光显色数分钟。Image J软件解析各实验组条带灰度值,目标蛋白的相对表达量=(目标蛋白灰度值/内参蛋白灰度值)÷(对照组目的蛋白灰度值/对照组内参蛋白灰度值)。
1.8 统计学方法 采用SPSS 25.0软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,2 组间比较采用t检验,多组间比较用单因素方差分析,组间多重比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 不同处理和不同干预时间对H9C2心肌细胞活力的影响
2.1.1 实验1 12、24及48 h,H9C2心肌细胞活力随PA浓度升高呈浓度依赖性下降(P<0.05),见图1。

Fig.1 Effects of different concentrations of PA on viability of H9C2 cells for different time points图1 不同浓度PA作用不同时间后对H9C2心肌细胞活力的影响
2.1.2 实验2 12 h时,与25 mmol/L葡萄糖组比较,35 mmol/L葡萄糖组H9C2细胞活力差异无统计学意义,50、75 及 100 mmol/L 葡萄糖组细胞活力增加(P<0.05);24、48 h时25、35、50、75以及100 mmol/L葡萄糖组细胞活力依次增加(P<0.05),见图2。
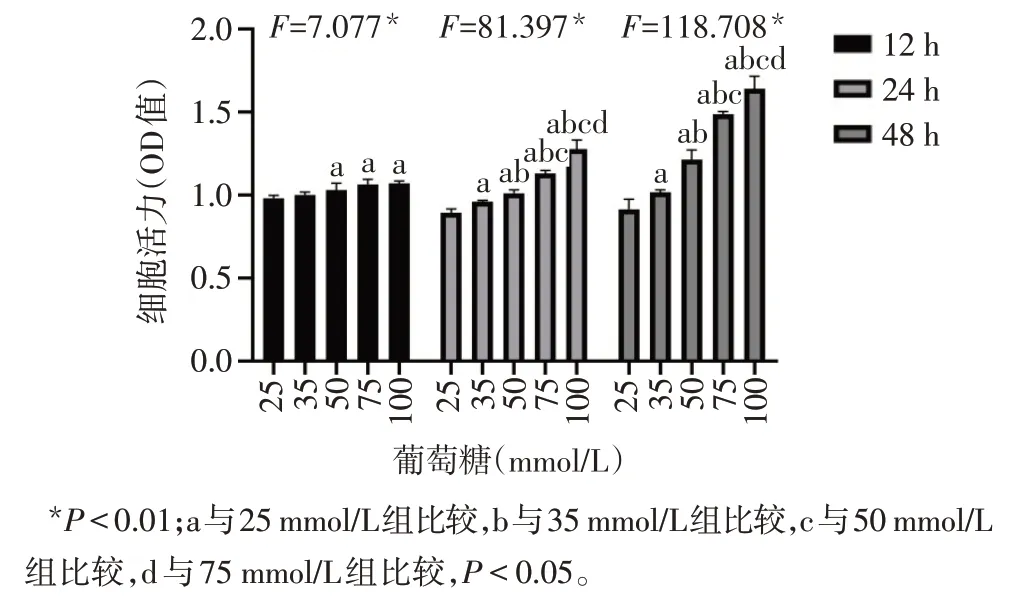
Fig.2 Effects of different concentrations of glucose on viability of H9C2 cells for different time points图2 不同浓度葡萄糖作用不同时间后对H9C2心肌细胞活性的影响
2.1.3 实验3 与对照组比较,48 h内溶剂组细胞活力差异无统计学意义,HGPA 组细胞活力降低(P<0.05)。与HGPA组比较,12 h时80µmol/L PGZ组细胞活力降低(P<0.05),其余各组差异无统计学意义,24 h 时 10 µmol/L PGZ 组细胞活力增加,40、80 µmol/L PGZ 组细胞活力下降(P<0.05),其余各组差异无统计学意义,48 h时5、10和20µmol/L PGZ组细胞活力增加,40、80µmol/L PGZ 组细胞活力降低(P<0.05),见图3。

Fig.3 Effects of different concentrations of PGZ on viability of H9C2 cells for 12,24 and 48 h图3 不同浓度PGZ干预12、24、48 h后对H9C2心肌细胞活力的影响
2.2 各组细胞凋亡率、ROS水平、SOD活性、MDA含量比较 与对照组比较,溶剂组各项指标差异均无统计学意义;与对照组和溶剂组比较,HGPA组凋亡率、ROS水平、MDA含量增加,而SOD活性降低(P<0.05);HGPA 组、L-PGZ 组、H-PGZ 组凋亡率、ROS水平、MDA 含量依次降低,而SOD 活性依次升高(P<0.05),见表1、图4。
Tab.1 Results of apoptosis rate,ROS,SOD and MDA of the different groups表1 各组凋亡率、ROS、SOD、MDA测定结果(n=3,)

Tab.1 Results of apoptosis rate,ROS,SOD and MDA of the different groups表1 各组凋亡率、ROS、SOD、MDA测定结果(n=3,)
**P<0.01;a与对照组比较,b与溶剂组比较,c与HGPA组比较,d与L-PGZ组比较,P<0.05。
组别对照组溶剂组HGPA组L-PGZ组H-PGZ组F凋亡率(%)12.97±0.39 13.00±0.47 42.23±3.52ab 31.24±2.49abc 22.65±1.03abcd 117.547**ROS水平(%)11.11±0.77 11.72±1.50 80.58±2.27ab 65.24±1.51abc 50.16±4.45abcd 492.177**SOD活性(U/mg prot)211.14±4.31 210.45±0.96 136.40±3.33ab 153.62±3.37abc 184.87±5.30abcd 241.659**MDA含量(nmol/mg prot)25.35±0.92 25.46±0.60 61.31±1.53ab 54.34±3.03abc 43.15±1.68abcd 260.367**
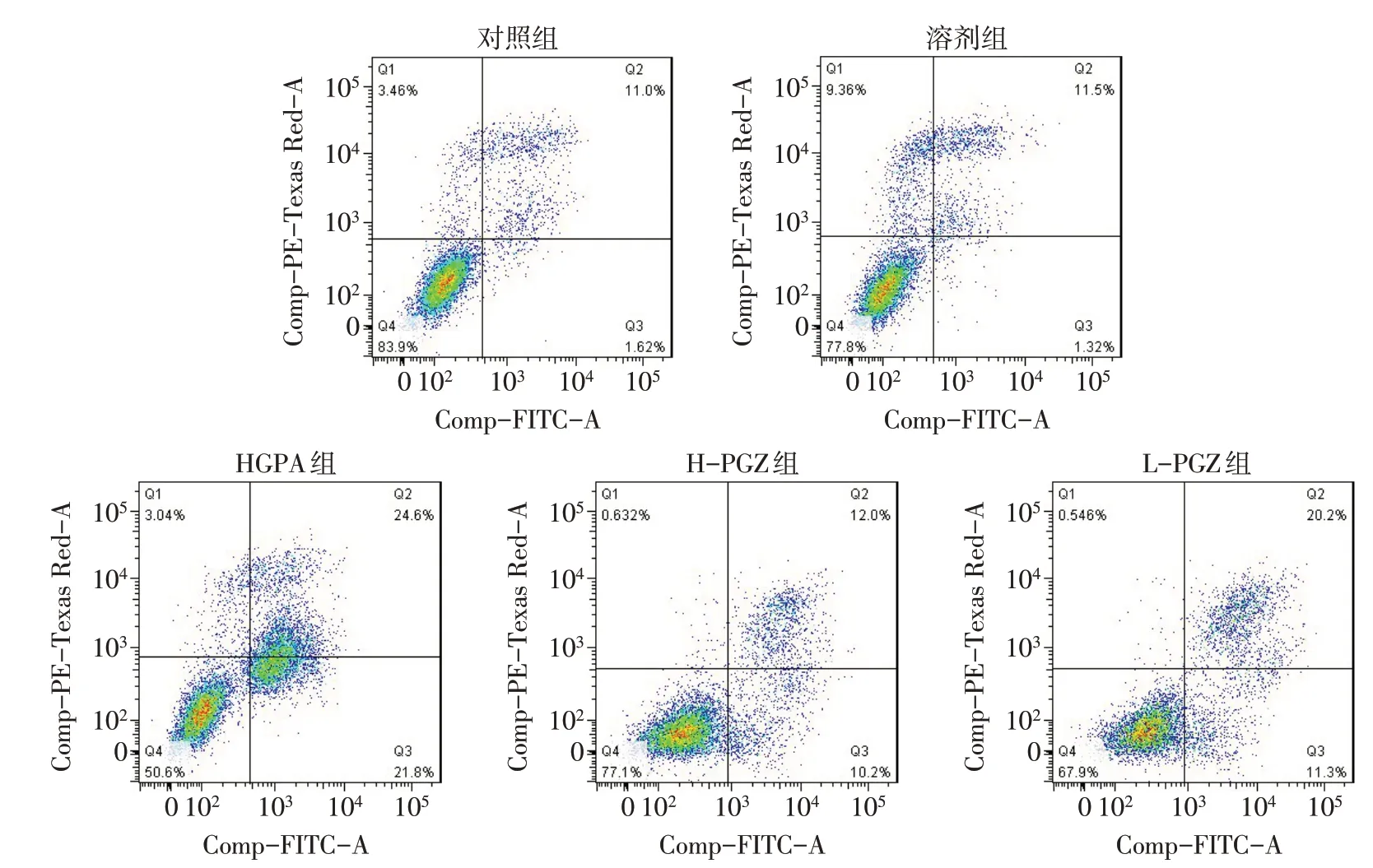
Fig.4 Apoptosis of different groups detected by flow cytometry图4 流式细胞仪检测各组凋亡情况
2.3 各组 T-AKT、P-AKT、Caspase3 等蛋白相对表达水平比较 与对照组比较,溶剂组各项指标差异无统计学意义;与对照组和溶剂组比较,HGPA组CCaspase3、BAX 表达水平升高,P-AKT、Caspase3、BCL-2 表达水平降低(P<0.05);HGPA 组、L-PGZ组、H-PGZ 组 C-Caspase3、BAX 依次下降,P-AKT、Caspase3、BCL-2 依次升高(P<0.05),见图5、表2。与 HGPA 组比较,NAC+HGPA 组 C-Caspase3 表达降低,P-AKT、Caspase3表达升高(P<0.05),见图6、表3。
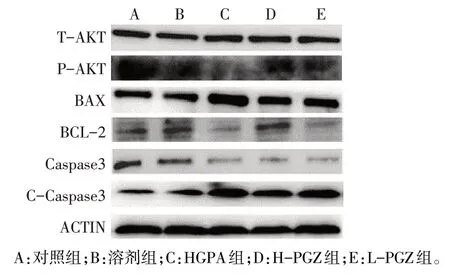
Fig.5 Comparison of protein expression results between the five groups of cells图5 各组蛋白表达结果比较

Tab.2 Comparison of protein expression results between the five groups of cells表2 各组蛋白相对表达水平比较
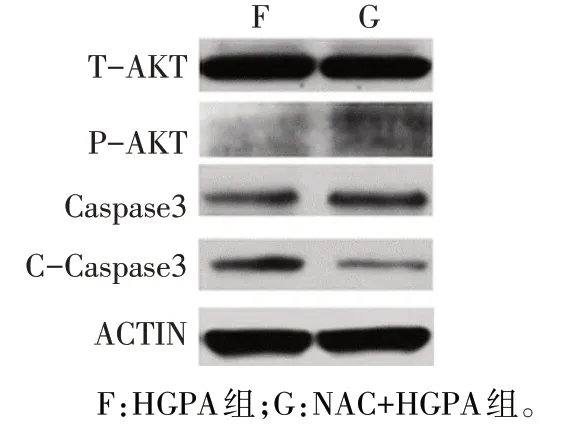
Fig.6 Comparison of protein expression results between the two groups of cells图6 各组蛋白表达结果比较

Tab.3 Comparison of protein expression results between the two groups表3 HGPA组和NAC+HGPA组蛋白相对表达水平比较
3 讨论
流行病学研究发现,2 型糖尿病的共病中高脂血症的发生率达到了65.4%,仅次于高血压,提示在2型糖尿病以及包括糖尿病心肌病在内的一系列并发症的发展过程中高血糖和高血脂关系密切[9-10]。因此,本研究采用高糖和棕榈酸共同作用建立高糖高脂损伤模型,并观察PGZ 对高糖高脂损伤模型的影响。本研究结果显示,与25 mmol/L 组比较,12 h时50、75 以及100 mmol/L 葡萄糖组细胞活力增加,24 h、48 h时25、35、50、75以及100 mmol/L葡萄糖组细胞活力依次增加,表明高糖对于细胞增殖具有促进作用。然而,有研究显示,HG 会抑制H9C2 细胞增殖[11],与本研究结果相反,原因可能为不同的培养条件和处理方法引起的通路差异所致,具体原因有待验证。另有研究显示,HG 通过下调GRIM-19 表达而促进H9C2细胞增殖[12],与本研究HG促进细胞增殖结果相似,而GRIM-19是线粒体脱氢酶Ⅰ复合物的必需成分,其下调会引起线粒体损伤[13]。既往研究显示,PA 可通过抑制AKT 磷酸化促进H9C2 细胞凋亡[8]。本研究结果亦显示,48 h 内0、0.05、0.1、0.2、0.4 mmol/L 的PA 组心肌细胞活力依次降低,表明48 h 内PA 可抑制H9C2 心肌细胞增殖,且在0~0.4 mmol/L 浓度范围内具有浓度依赖性。本研究用HG 和PA 共同作用建立高糖高脂损伤模型,由于药物作用时间的不确定性,既要保证高糖和棕榈酸能在短时间内对细胞活力有影响,又要保证较长时间后对细胞活力的影响不至于过大,综合研究结果选择 50 mmol/L 葡萄糖与0.1 mmol/L 的 PA 共同干预心肌细胞建立高糖高脂模型。
AKT 通路是心肌细胞内重要的凋亡调控通路[8]。既往研究表明,在H9C2心肌细胞内AKT磷酸化受到抑制,进而可减少抗凋亡蛋白BCL-2表达,增加促凋亡蛋白BAX表达,BCL-2/BAX失衡启动了线粒体凋亡途径,从而诱导Caspase 的级联反应,最终引起Caspase3 剪切化,而剪切化的Caspase3 是细胞凋亡的最终执行蛋白[14]。有研究显示,PGZ 可通过促进PI3K/AKT通路的活化,从而减轻糖氧剥夺损伤中H9C2细胞凋亡[15]。本研究结果显示,48 h时与对照组比较,HGPA组细胞凋亡率升高,P-AKT、BCL-2表达降低,BAX、C-Caspase3 表达升高,表明HGPA可以通过抑制AKT 磷酸化,促进抗凋亡蛋白BCL-2与凋亡蛋白BAX 表达失衡,诱导Caspase3 剪切化并促进细胞凋亡;与 HGPA 组比较,10 µmol/L 和5 µmol/L PGZ组细胞凋亡率降低,P-AKT、BCL-2表达升高,BAX、C-Caspase3 表达降低,证实了PGZ 可能通过增加AKT 的磷酸化,抑制HGPA 诱导的抗凋亡蛋白BCL-2与凋亡蛋白BAX的表达失衡,进而减轻Caspase3活化所引起的心肌细胞凋亡。
氧化应激反应是DCM 发生发展的重要分子机制,也被认为是DCM发展的“导火线”[16]。SOD是体内重要的抗氧化酶,MDA 则是体内重要的过氧化物,SOD和MDA的变化反映了体内氧化和抗氧化的失衡状态[17]。本研究发现,48 h 时与对照组比较,HGPA组ROS和MDA增加,SOD减少,与HGPA组比较,10 µmol/L 和5 µmol/L PGZ 组ROS 和MDA 减少,SOD 增加,且 10 µmol/L 组比 5 µmol/L 组变化更明显,证实PGZ可通过增加抗氧化酶SOD,减少HGPA所诱导的ROS 及其氧化产物MDA 的产生,抑制HGPA 所致的细胞内氧化应激状态,且10µmol/L 比5µmol/L 效果更明显。研究显示,AKT 通路为心肌细胞内影响凋亡的重要通路,受到ROS的调节,ROS可以抑制AKT 磷酸化,从而促进细胞凋亡[8]。NAC是目前公认的有效的ROS 抑制剂。为了证实ROS对AKT 通路和凋亡的影响,本研究中采用抗氧化剂NAC与HGPA共同干预心肌细胞24 h,与单纯HGPA组比较,NAC+HGPA 组 P-AKT 升高,C-Caspase3 表达降低,进一步表明抑制ROS可以促进AKT通路的活化,减少心肌细胞凋亡。
综上所述,PGZ 对ROS 有抑制作用,可以促进AKT通路的活化,减少心肌细胞凋亡,其机制可能是通过抑制ROS并进一步促进AKT通路活化,从而减轻高糖棕榈酸诱导的H9C2心肌细胞凋亡。
