活性肽灌胃对阿尔茨海默病大鼠的神经保护作用及海马组织Wnt/β-catenin信号通路活性影响
2022-04-20杨新柱赵效国马依拉买买提吕逸霏李莉
杨新柱,赵效国,马依拉·买买提,吕逸霏,李莉
1 新疆医科大学公共卫生学院,乌鲁木齐 830054;2 新疆医科大学第一附属医院临床营养科
阿尔茨海默病(AD)是一种中枢神经系统性疾病,在老年人群中高发,是老年痴呆最常见的类型之一[1]。AD 主要表现为渐进性记忆与理解功能障碍,神经精神方面表现为性格发展及语言功能障碍,严重影响患者的职业、社交与生活能力[2]。AD 的病因、发病机制尚不明了,其特征性病理表现为β淀粉样蛋白(Aβ)异常沉积形成的老年斑、tau 蛋白过度磷酸化导致的中枢神经细胞纤维缠结(NFTs)及神经元大量丢失等,目前尚无有效的治疗药物[3-5]。活性肽是通过脂质体包裏技术特殊处理的特种乳清蛋白,其获取需首先通过蛋白水解获得各分子量多肽的集合,然后采用分子膜过滤将上述多肽混合物依照目标分子量进行筛选,最终得到目标分子量的大分子多肽。活性肽在体内高效利用,可调节和提高体内生长激素水平,促进全身蛋白质合成,调节和平衡人体内的各项激素水平,其作为内源性干细胞激活剂可全面修复、恢复受损细胞及衰老细胞功能,从而提高和改善人体器官的各项机能。2019年9月—2022年1月,本研究观察了活性肽对AD大鼠的神经保护作用,并探讨其可能的机制,为AD 的药物预防及治疗提供新的实验依据。现报告如下。
1 材料与方法
1.1 材料 实验动物:雄性SD 大鼠72 只,12~16周龄,体质量(250±50)g,由新疆医科大学实验动物管理中心供应,质量合格编码[SCXK(新)2019-0002];大鼠在SPF 级实验室常规饲养,保持足够的通风和照明条件,每笼饲养3~4 只,自由进食和饮水。主要药物及试剂:活性肽(乳清蛋白粉复合粉)购自上海十多生物科技有限公司,D-半乳糖(DGal)、盐酸多奈哌齐购自上海麦克林生化科技有限公司;β-连环蛋白(β-catenin)抗体购自英国Abcam公司,糖原合成酶激酶3β(GSK-3β)抗体、GAPDH 抗体均购自北京博奥森海洋生物科学技术公司;动物组织总RNA 提取试剂盒、第一链合成试剂盒、荧光定量试剂盒均购自北京天根生化研究股份公司,BCA 蛋白含量测定试剂盒、SDS-PAGE 凝胶制备试剂盒均购自北京索莱宝科技有限公司。主要仪器:Morris 水迷宫视频图像监控分析控制系统购自成都泰盟科技有限公司,QutantStudio6实时荧光PCR 仪、Nanddrop000/000C 分光光度计均购自美国Thermo公司。
1.2 动物分组与处理方法 72 只SD 大鼠适应性饲养1周,随机分成空白组、模型组、多奈哌齐组、活性肽低剂量组、活性肽中剂量组、活性肽高剂量组,每组12 只。除空白组外,其余各组腹腔注入D-gal 150 mg/kg、1 次/天,以建立AD 模型,空白组腹腔注入等量生理盐水,连续注入60 d。多奈哌齐组、活性肽低剂量组、活性肽中剂量组、活性肽高剂量组建模的同时分别灌胃给予多奈哌齐0.9 mg/(kg·d)及活性肽420、630、840 mg/(kg·d),1次/天,连续60 d。
1.3 学习记忆能力观察 采用Morris 水迷宫测试。各组分组处理60 d,开展Morris 水迷宫实验,实验共历时6 d,分为定位航行实验及空间探索实验。①定位航行实验:将各组大鼠从固定的象限中央面向池壁放入水中,记录其120 s 内找到平台的时间,即为逃逸潜伏期;超过120 s 而未找到者,引导其爬上平台并停留10 s,训练进行5 d,2 次/天。②空间探索实验:各组大鼠第6 天撤去平台,记录其120 s 内进入有效区域(1.5倍原平台所在区域)的次数。
1.4 海马组织病理观察 采用HE 染色。各组分组处理60 d,随机选取4 只大鼠,1%戊巴比妥钠0.45 mL/100 g腹腔注射麻醉,待大鼠昏迷后置于解剖盘,暴露其心脏,将灌流针在左心室插入并固定;切开右心耳,缓慢灌注提前冰冻(4 ℃)的无菌生理盐水150 mL,至大鼠鼻尖苍白,肝、肺脏颜色从红转白,右心耳流出澄清液体后,再灌注4%多聚甲醛200 mL;待大鼠四肢抽搐痉挛,断头取脑,并于冰台上剥离大脑双侧海马,4%多聚甲醛固定,制片备用。依次进行梯度乙醇脱水、组织透明、浸蜡、包埋后,将海马组织冠状切成4µm 厚度的石蜡切片。切片经烘烤数小时后,脱蜡液脱蜡、透明、脱水处理后,在无菌水浸洗后,苏木素染色1 min,1%盐酸乙醇分化,再次充分冲洗;1%伊红染色1 min,梯度脱水、脱蜡液透明、中性树胶封片。在光学显微镜下观察各组海马组织病理改变。
1.5 海马组织β-catenin 阳性表达情况观察 采用免疫组化法。取各组海马组织冠状切片,复水后将切片用3%过氧化氢溶液室温浸泡10 min,蒸馏水水洗3 min,磷酸盐缓冲液(PBS)充分洗片3 次,每次5 min;置枸橼酸盐缓冲液中,微波修复(92~98 ℃)12 min;室温冷却至常温,PBS 冲洗3 次;抗原修复后,置于5%BSA中封闭30 min;去除封闭液,滴加稀释后的多克隆兔抗β-catenin(1∶500),4 ℃冰箱孵育过夜。次日使用PBS 冲洗3 次,在切片组织表面滴加稀释后的辣根过氧化物酶标记二抗,37 ℃恒温箱孵育30 min;PBS 冲洗3 次,向组织表面均匀滴加DAB 显色液显色60 s,直至在显微镜下观察到组织出现棕黄色,自来水终止;苏木素复染1 min,盐酸分化,梯度乙醇脱水,中性树胶封片。显微镜下观察各组海马组织β-catenin蛋白定位及数量等。
1.6 海马组织GSK-3β、β-catenin mRNA 表达检测采用Real-time PCR法。取各组分组处理60 d的剩余大鼠,心脏灌注后取出大脑,分离海马组织,置于液氮中速冻并转移至-80 ℃冰箱保存。称取海马组织20 mg,加入裂解液、研磨珠,在自动研磨仪研磨数次后,提取海马总mRNA。检测各样本mRNA 纯度,在260、280 nm 处测定吸光度A260/A280为1.9~2.0 时,进行逆转录。使用实时荧光定量PCR 仪进行扩增,GSK-3β、β-catenin及内参GAPDH的引物序列由上海生工生物工程股份公司设计合成,引物序列见表1。PCR 扩增条件:95 ℃、15 min,循环1 次;95 ℃、10 s,60 ℃、32 s,循环40 次;65~95 ℃绘制溶解曲线。采用2-ΔΔCt法计算目的基因相对表达量。

表1 GSK-3β、β-catenin及内参GAPDH的引物序列
1.7 海马组织GSK-3β、β-catenin蛋白表达检测 采用Western blotting 法。将1.6 中冻存的各组大鼠海马组织取出,剪成200~500 mg的组织,加入250~500µL RIPA 裂解液及蛋白酶抑制剂和磷酸酶抑制剂,于研磨仪充分匀浆。4 ℃条件下14 000 r/min 离心10 min,取上清液。BCA 蛋白定量试剂盒测定蛋白浓度,绘制标准曲线,计算各样本浓度,加入RIPA使各样本浓度归一化。采用聚丙烯酰胺凝胶(SDSPAGE)制胶、电泳,湿转法将蛋白转移到PVDF 膜上,5%脱脂奶粉封闭2 h。将PVDF 膜浸泡在稀释后的β-catenin(1∶5 000)、GSK-3β(1∶1 000)的一抗中,4 ℃摇床孵育过夜;次日将洗涤后的PVDF 膜浸泡在二抗(1∶5 000)中,室温孵育1 h。洗膜后将PVDF 膜浸泡在ECL 化学发光剂中,取出后凝胶成像仪曝光显色。用Image J软件分析条带灰度值,以GAPDH 为内参,计算蛋白相对表达量。
1.8 统计学方法 采用SPSS22.0统计软件。计量资料采用Shapiro-Wilk正态性检验方法,呈正态分布以±s表示,多组间比较采用方差分析,两组间比较采用t检验;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠逃避潜伏期及进入有效区域的次数比较 与空白组比较,模型组大鼠逃逸潜伏期明显延长,进入有效区域的次数明显减少(P均<0.05)。与模型组比较,多奈哌齐组、活性肽高剂量组大鼠逃逸潜伏期均缩短、进入有效区域的次数明显增多(P均<0.05),而活性肽低、中剂量组变化不明显(P均>0.05)。多奈哌齐组和活性肽高剂量组大鼠逃逸潜伏期、进入有效区域的次数比较无统计学差异(P均>0.05)。见表2。
表2 各组大鼠逃避潜伏期及进入有效区域的次数比较(±s)
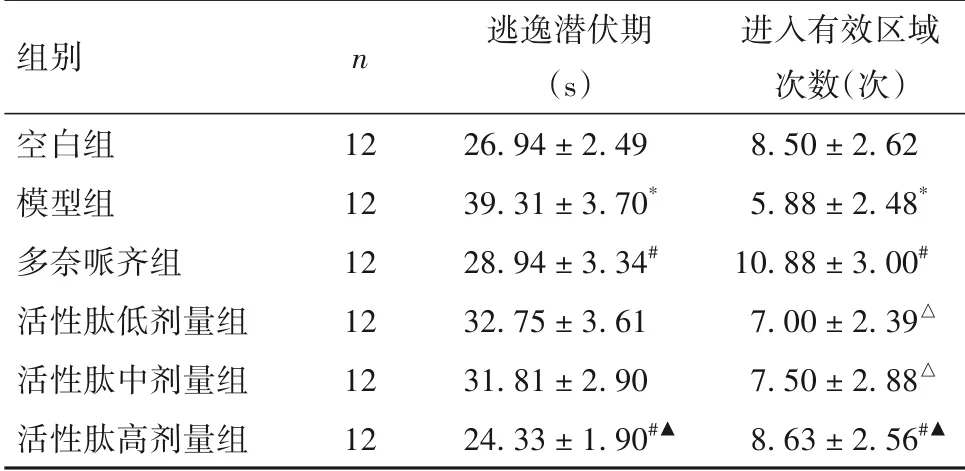
表2 各组大鼠逃避潜伏期及进入有效区域的次数比较(±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与多奈哌齐组比较,△P<0.05;与活性肽低、中剂量组比较,▲P<0.05。
组别空白组模型组多奈哌齐组活性肽低剂量组活性肽中剂量组活性肽高剂量组n 12 12 12 12 12 12逃逸潜伏期(s)26.94±2.49 39.31±3.70*28.94±3.34#32.75±3.61 31.81±2.90 24.33±1.90#▲进入有效区域次数(次)8.50±2.62 5.88±2.48*10.88±3.00#7.00±2.39△7.50±2.88△8.63±2.56#▲
2.2 各组大鼠海马组织病理变化比较 与对照组比较,模型组大鼠海马区锥体细胞排列紊乱,较多神经细胞体积缩小,出现细胞核固缩,并且神经元数量明显下降,锥体细胞也出现较多损伤。与模型组比较,多奈哌齐组和活性肽低、中、高剂量组神经元数量明显增多、形态较完整,其中活性肽高剂量组与多奈哌齐组海马区锥体细胞大多数形态较正常、细胞排列较为整密、核仁结构清晰、着色均匀。见OSID码图1。
2.3 各组大鼠海马组织β-catenin阳性表达比较 各组大鼠海马组织β-catenin蛋白主要定位于细胞质,阳性细胞呈黄褐色。与对照组比较,模型组大鼠海马组织β-catenin蛋白阳性细胞着色浅,而且阳性细胞数较少,细胞较分散。与模型组比较,多奈哌齐组和活性肽低、中、高剂量组大鼠海马组织β-catenin蛋白阳性细胞数量均增多,染色较深。见OSID码图2。
2.4 各组大鼠海马组织GSK-3β、β-catenin mRNA表达比较 与空白组比较,模型组大鼠海马组织GSK-3β mRNA 表达升高、β-catenin mRNA 表达降低(P均<0.05);与模型组比较,多奈哌齐组和活性肽低、中、高剂量组大鼠海马组织GSK-3β mRNA 表达均降低,β-catenin mRNA 表达均升高(P均<0.05)。多奈哌齐组和活性肽高剂量组大鼠海马组织GSK-3β、β-catenin mRNA 表达比较均无统计学差异(P均>0.05)。见表3。
表3 各组大鼠海马组织GSK-3β、β-catenin mRNA表达比较(±s)

表3 各组大鼠海马组织GSK-3β、β-catenin mRNA表达比较(±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与多奈哌齐组比较,△P<0.05;与活性肽低、中剂量组比较,▲P<0.05。
组别空白组模型组多奈哌齐组活性肽低剂量组活性肽中剂量组活性肽高剂量组n 4 4 4 4 4 4 GSK-3β mRNA 1.01±0.18 1.81±0.68*0.79±0.34#1.41±0.10 1.16±0.46#0.85±0.37#β-catenin mRNA 1.00±0.11 0.38±0.22*1.87±0.52#1.20±0.52#△1.56±0.15#1.61±0.16#
2.5 各组大鼠海马组织GSK-3β、β-catenin蛋白表达比较 与空白组比较,模型组大鼠海马组织GSK-3β蛋白表达升高、β-catenin蛋白表达降低(P均<0.05);与模型组比较,多奈哌齐组和活性肽低、中、高剂量组大鼠海马组织GSK-3β蛋白表达均降低,β-catenin蛋白表达均升高(P均<0.05)。多奈哌齐组和活性肽高剂量组大鼠海马组织GSK-3β、β-catenin 蛋白表达比较均无统计学差异(P均>0.05)。见表4、图1。
表4 各组大鼠海马组织GSK-3β、β-catenin蛋白表达比较(±s)

表4 各组大鼠海马组织GSK-3β、β-catenin蛋白表达比较(±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与多奈哌齐组比较,△P<0.05。
组别空白组模型组多奈哌齐组活性肽低剂量组活性肽中剂量组活性肽高剂量组n 4 4 4 4 4 4 GSK-3β 0.72±0.50 1.07±0.11*0.70±0.16#0.71±0.18#0.62±0.09#0.72±0.16#β-catenin 0.79±0.76 0.53±0.38*0.99±0.15#0.75±0.17△1.09±0.17#1.00±0.75#

图1 各组大鼠海马组织β-catenin、GSK-3β蛋白表达条带图(Western blotting法)
3 讨论
AD 病因复杂多样,其发病机制尚不十分明确,目前没有有效的治疗手段[6]。在世界老龄化日益加重的趋势下,AD 发病率逐年上升,已成为一个不容忽视的公共健康问题[7]。研究表明,D-gal 能导致动物亚急性衰老,在细胞内大量堆积可引起细胞代谢功能紊乱,以致体内活性氧增多,从而损害生物膜及其他高分子功能和结构,并导致机体多器官、多系统功能衰退[8]。此外,AD 患者脑组织中出现明显的过氧化反应,D-gal可通过产生过量活性氧和氧自由基引起氧化应激损伤和抗氧化机制失衡,加快脑组织退化过程[9-11]。本研究通过腹腔注射D-gal 建立AD模型,结果显示与空白组比较,模型组大鼠海马区锥体细胞排列紊乱,较多神经细胞体积缩小,出现细胞核固缩,并且神经元数量明显下降,锥体细胞也出现较多损伤,且逃逸潜伏期升高、进入有效区域的次数降低,提示AD 模型建立成功。本研究结果显示,与模型组比较,多奈哌齐组及活性肽低、中、高剂量组大鼠逃逸潜伏期均降低,进入有效区域的次数均升高,以多奈哌齐组、活性肽高剂量组变化更明显;提示活性肽有助于提高AD 大鼠的学习记忆能力,且高剂量活性肽效果更好,与多奈哌齐效果相当。
Wnt/β-catenin 信号通路与中枢神经系统的生长发育有着密切关系,在成年海马神经发生中对神经细胞的增殖、分化具有关键作用,Wnt信号通路的持续激活可以促进神经细胞的增殖、分化[12]。GSK-3β 和β-catenin 是Wnt信号通路中的重要蛋白,一般正常细胞质中游离β-catenin 水平极低,不能产生Wnt 信号;当信号通路的某些成分发生质或量的变化时,Wnt 信号通路被激活,Wnt 信号与细胞表面受体结合,使细胞质内GSK-3β 复合体受到抑制,阻止β-catenin 磷酸化过程,进而使β-catenin 进一步聚集,从而转移到细胞核中,激活转录并调节靶基因表达[13-15]。近期研究也证明,当Wnt/β-catenin 信号通路被抑制时,会导致GSK-3β 表达升高和β-catenin表达水平降低,进而引起Aβ 异常沉积和tau 蛋白过度磷酸化,最后导致AD 的发生[16-17]。本研究结果显示,模型组大鼠海马组织GSK-3β mRNA 和蛋白表达高于空白组,β-catenin mRNA 和蛋白表达低于空白组,说明AD 大鼠海马中Wnt/β-catenin 信号通路被抑制;而多奈哌齐组和活性肽低、中、高剂量组大鼠海马组织GSK-3β mRNA 和蛋白表达均低于模型组,β-catenin mRNA 和蛋白表达均高于模型组,且多奈哌齐组和活性肽高剂量组比较并无统计学差异;说明活性肽可以激活Wnt/β-catenin 信号通路,高剂量活性肽对于AD 大鼠的神经保护作用及Wnt/βcatenin信号通路激活作用与多奈哌齐效果相当。
综上所述,活性肽对AD 大鼠具有神经保护作用,且剂量越高效果越好,其机制可能与激活Wnt/β-catenin 信号通路有关,为AD 的早期预防和治疗奠定了实验基础。
