子宫内膜再生细胞通过表达PD-L1对大鼠肠道缺血再灌注损伤的抑制作用观察
2022-04-20叶奎彭秋凤史刚刚曲鑫王浩
叶奎,彭秋凤,史刚刚,曲鑫,王浩
1 天津市第四中心医院血管外科,天津 300142;2 天津医科大学第二医院肛肠外科;3 天津医科大学总医院普通外科;4 天津普通外科研究所
肠道缺血再灌注损伤(IRI)是指由于不同病因导致肠道血供中断,恢复血供后出现损伤加重甚至不可逆损伤的现象[1]。肠道IRI发生后,由于局部肠道组织氧化应激加剧,局部炎症反应亢进,肠道屏障被破坏,肠道细菌移位,继而诱发全身炎症反应综合征[2]。近些年来,基于干细胞的治疗方法对于缺血性疾病以及肠道IRI 的治疗效果较好[3]。子宫内膜再生细胞(ERC)作为一种来源于育龄期女性月经血的新型类间充质干细胞,具有减轻机体缺血损伤、促进损伤修复、调节机体免疫平衡等作用,在再生医学以及细胞治疗领域中应用广泛[4]。既往研究发现,程序性死亡配体1(PD-L1)能够在ERC表面表达,且能够作为发挥免疫调节作用的有效靶点[5]。但是,目前ERC 能否通过表达PD-L1 减轻肠道IRI 及其潜在机制均不明确。为此,我们于2021 年1 月—9 月进行了如下研究。
1 材料与方法
1.1 材料 实验动物:Wistar 雄性大鼠50 只,7~8周龄,体质量200~220 g,均购自中国食品药品检定研究院[生产许可证为SYXK(京)2019-0001]。主要试剂:胎牛血清(FBS)和DMEM 细胞培养基均购自美 国Hyclone 公 司;抗 大 鼠CD45、CD79、CD90、CD105、HLA-DR 及抗人PD-L1等流式抗体均购自美国eBioscience 或Biolegend 公司,大鼠白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)细胞因子检测试剂盒均购自北京达科为生物科技有限公司,二胺氧化酶(DAO)和D-乳酸(DLac)均购自南京森倍伽生物科技有限公司;青—链霉素、HE染色试剂盒、淋巴细胞分离液(Ficoll配制)均购自北京索莱宝生物技术有限公司;重组人干扰素γ(IFN-γ)购自美国Peprotech 公司,抗PD-L1 单克隆抗体(克隆号:M1H2)购自赛默飞科技有限公司。
1.2 ERC的制备及鉴定
1.2.1 ERC 制备 本研究经天津医科大学总医院伦理委员会审批通过(伦理审批文书批号:IRB2021-WZ-132)。将15 mL 淋巴细胞分离液置于50 mL 离心管中备用,利用月事杯收集2 位健康育龄期(25~35 周岁)女性志愿者的月经血,用含青—链霉素的磷酸盐缓冲液(PBS)和月经血按照1∶1 的体积比进行混合,缓慢滴加15 mL 混合液于淋巴细胞分离液上,2 000 r/min进行密度梯度离心,取中间云雾层细胞。用10 mL PBS 重悬细胞,洗涤3 次,用含15%FBS 的DMEM 培养基重悬细胞,接种于培养皿上。3 d后第一次更换一半培养基,之后每2~3 d更换全部培养基,待细胞密度达90%时,用0.25%胰酶消化细胞,含10% FBS 的DMEM 培养基进行传代培养。
1.2.2 ERC 鉴定 取传代至第3 代的细胞,胰酶消化后观察细胞形态并进行流式细胞术鉴定。细胞形态观察结果显示,月经血来源的单核细胞分离后72 h呈现米粒样,更换培养基后细胞逐渐变为梭形,7~10 d 后细胞逐渐长成类似于间充质干细胞样的巢状集落(OSID 码图1A);流式细胞术检测结果显示,该ERC 能够高表达CD90 和CD105,低表达或不表达CD79、HLA-DR、CD45(OSID 码图1B),符合间充质干细胞的表面鉴定标准。
1.3 IFN-γ 对ERC 表 面PD-L1 表 达 影 响 的 观 察按照既往发表文献[6]的方法,取传代至第4 代的ERC,细胞贴壁后向培养体系中加入重组人IFN-γ 5 ng/mL,72 h 后收集细胞,通过流式细胞术检测细胞表面PD-L1表达情况。结果显示,IFN-γ刺激前后ERC 表面PD-L1 阳性表达率分别为29.577% ±1.279%、62.823% ± 3.651%,二者比较P<0.01;证实IFN-γ可以刺激ERC高表达PD-L1(OSID码图2)。
1.4 动物模型构建与分组处理 所有大鼠饲养以及动物操作均在天津医科大学总医院普通外科研究所完成,动物实验操作经过天津医科大学总医院动物福利伦理委员会批准(批件号:IRB2021-DW-31)。50只Wistar大鼠提前12 h禁食,自由饮水,随机分为假手术组、模型组、PD-L1 过表达ERC 组、ERC 治疗组、PD-L1 低表达ERC 组,每组10 只。除假手术组外,均利用肠系膜上动脉结扎30 min 后恢复血供的方法[7]建立肠道IRI大鼠模型,假手术组开腹后分离肠系膜上动脉但不结扎。建模后,PD-L1 过表达ERC 组、ERC 治疗组和PD-L1 低表达ERC 组分别通过尾静脉注射的方法,给予5 ng/mL IFN-γ 预刺激72 h 后的ERC、普通ERC、10 µg/mL 抗人PD-L1 抗体作用72 h后的ERC各5×106个。
1.5 肠道组织损伤情况观察 采用HE 染色。各组分组处理72 h后处死,收集肠道组织,10%甲醛固定48 h,进行脱水、包埋、切片、染色,具体实验步骤参照HE 染色试剂盒说明书。按照Chiu's 评分评价肠道组织损伤情况,评分标准:正常肠绒毛结构为0分,绒毛顶端黏膜下出现间隙、毛细血管充血为1分,黏膜下间隙扩大、肠黏膜与黏膜下层分离为2分,黏膜与黏膜下层分离延伸到肠绒毛两侧为3分,绒毛变钝、固有层及其血管暴露、炎症组织浸润为4分,固有层消化崩解、出血或形成溃疡为5分。
1.6 血清肠道屏障功能相关指标及炎症因子水平检测 各组分组处理72 h处死前,收集外周血,分离获得血清,采用ELISA 法检测血清肠道屏障功能相关指标D-Lac、DAO 及炎症因子IL-1β、TNF-α、IL-6,严格按照试剂盒说明书进行操作。
1.7 统计学方法 采用SPSS13.0 统计软件。计量资料采用夏皮罗—威尔克正态性检验,呈正态分布以-x±s表示,多组间比较采用方差分析,组间比较采用t检验;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组肠道组织损伤评分比较 假手术组、PD-L1 过表达ERC 组、ERC 治疗组、PD-L1 低表达ERC 组、模型组肠道组织损伤评分分别为(0.500 ±0.534)、(2.000±0.535)、(2.875±0.641)、(3.750±0.463)、(4.125 ± 0.641)分,组 间 两 两 比 较P均<0.05。
2.2 各组血清D-Lac、DAO、TNF-α、IL-6、IL-1β水平比较 假手术组、PD-L1 过表达ERC 组、ERC 治疗组、PD-L1 低表达ERC 组、模型组血清D-Lac、DAO、TNF-α、IL-6、IL-1β 水平均依次升高,组间两两比较P均<0.05。见表1。
表1 各组血清D-Lac、DAO、TNF-α、IL-6、IL-1β水平比较(±s)
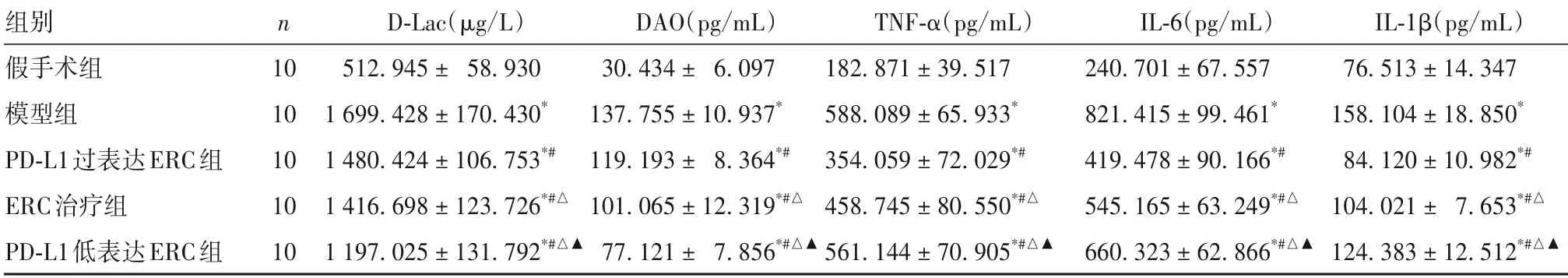
表1 各组血清D-Lac、DAO、TNF-α、IL-6、IL-1β水平比较(±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与PD-L1过表达ERC组比较,△P<0.05;与ERC治疗组比较,▲P<0.05。
组别假手术组模型组PD-L1过表达ERC组ERC治疗组PD-L1低表达ERC组n 10 10 10 10 10 D-Lac(µg/L)512.945± 58.930 1 699.428±170.430*1 480.424±106.753*#1 416.698±123.726*#△1 197.025±131.792*#△▲DAO(pg/mL)30.434± 6.097 137.755±10.937*119.193± 8.364*#101.065±12.319*#△77.121± 7.856*#△▲TNF-α(pg/mL)182.871±39.517 588.089±65.933*354.059±72.029*#458.745±80.550*#△561.144±70.905*#△▲IL-6(pg/mL)240.701±67.557 821.415±99.461*419.478±90.166*#545.165±63.249*#△660.323±62.866*#△▲IL-1β(pg/mL)76.513±14.347 158.104±18.850*84.120±10.982*#104.021± 7.653*#△124.383±12.512*#△▲
3 讨论
肠道IRI 是一种继发于肠系膜上动脉栓塞、失血性休克、小肠移植等疾病的严重并发症,该过程有多种因素共同参与;肠道在缺血阶段组织细胞代谢水平下降,大量损伤相关模式分子和促炎因子释放,在恢复血供时大量含氧血流灌注加重损伤,从而促进炎症细胞因子释放,局部组织炎症反应剧烈,大量炎症细胞浸润,导致肠道屏障破坏,肠道细菌移位至外周血,造成全身系统性炎症反应[8-11]。近年来,以干细胞为基础的治疗策略有望成为预防或抑制IRI的有效措施[3,5,12]。间充质干细胞作为一种成体干细胞,一方面能够抑制局部炎症反应,另一方面能够释放大量促血管生成因子以及营养因子,从而促进局部损伤组织的修复。ERC 是一种新型的类间充质干细胞,来源于育龄期女性的月经血。课题组前期研究发现,ERC 能够有效抑制小鼠肢体缺血,促进肾脏缺血再灌注损伤的修复,抑制刀豆蛋白A 诱导的急性肝损伤,治疗小鼠实验性结肠炎以及诱导小鼠异位心脏移植术后的免疫耐受等,为IRI 的治疗提供了广阔的应用前景[13-16]。PD-L1 是程序性死亡受体的配体,能够与PD-1 结合,从而抑制免疫排斥反应[17]。本课题组前期研究发现,ERC 能够通过表达PD-L1 来诱导调节性T 细胞(Treg)生成,促进M2型巨噬细胞极化,从而抑制局部炎症反应和调节免疫,最终诱导小鼠心脏移植后的免疫耐受[9,18]。在缺血性疾病中,ERC 可能释放大量的血管内皮生长因子(VEGF),有助于促进局部组织损伤修复和微循环形成。
本研究首先利用IFN-γ 刺激ERC,从而使其高表达PD-L1,这一结果也得到既往发表文献的支持[19]。在正常的生理状态下,人体内血液中D-Lac水平较低,而当肠道细菌大量增殖酵解,导致肠道屏障功能紊乱时,大量D-Lac 释放入血,使得外周血中D-Lac 水平升高。DAO 是哺乳动物肠道黏膜上层绒毛细胞中具有高度活性的细胞内酶分子,外周血DAO 升高提示肠道屏障功能被破坏。同时,外周血细胞因子水平能够反映机体的炎症状态。本研究结果显示,假手术组、PD-L1 过表达ERC 组、ERC 治疗组、PD-L1低表达ERC组、模型组肠道组织损伤评分及血清D-Lac、DAO、TNF-α、IL-6、IL-1β 水平均依次升高;提示高表达PD-L1 的ERC 相较于未处理的ERC 或低表达PD-L1 的ERC 能够对肠道IRI 发挥更好的治疗效果,同时可以减轻肠道屏障功能损伤、降低促炎细胞因子表达,也证实了ERC 表面表达PDL1是其发挥治疗效果的重要靶点。本研究阻断PDL1 后的ERC 相较于模型组仍然具有良好的治疗效果,这说明了PD-L1 不是ERC 发挥功能的惟一效应分子,ERC 可能还存在其他发挥效应功能的分子,仍有待进一步研究[19]。
综上所述,ERC 能够通过表达PD-L1 而减轻大鼠肠道IRI 损伤,其机制可能与降低肠道屏障功能损伤及炎症反应有关,但是其具体的调控通路及调控因子仍需深入研究。在未来的工作中,我们可以通过基因转染技术来促进ERC 表面PD-L1 过表达,以获得治疗级别的种子细胞,甚至可以进一步获取高表达PD-L1的ERC细胞外泌体,从而进行肠道IRI的治疗。
