E3泛素-蛋白连接酶Parkin介导线粒体自噬参与荷瘤小鼠心肌损伤
2022-04-18邓世杰李兴会蔡卫斌
邓世杰,李兴会,蔡卫斌
(1.广东省疾病模式动物工程技术研究中心//中山大学实验动物中心,广东广州 510006;2.中山大学中山医学院生物化学教研室,广东广州 510080)
癌症患者生存率的提高往往伴随其他系统损伤。癌后心血管病是幸存癌症患者中易发和致死原因之一[1]。癌后心血管损伤不仅可由癌症治疗手段引起,肿瘤本身也能直接导致[2-4]。在抗癌治疗前,癌症患者心肌损伤标志物如NT-proBNP,MR-proANP 水平升高与死亡率密切相关[5-6]。因此,研究荷瘤状态下心肌损伤的原因显得尤为重要。心脏是高耗能器官,富含线粒体,心肌细胞线粒体通过氧化磷酸化生成ATP 为心脏提供能量。线粒体自噬是一种特异性清除受损线粒体的自噬现象,在正常情况下,心肌细胞通过线粒体自噬途径清除受损线粒体,是机体控制线粒体质量的重要途径。E3 泛素-蛋白连接酶Parkin(E3 ubiquitin ligase Parkin)是由park2基因编码的蛋白质,最初的研究发现park2基因缺失能够引起帕金森病。Parkin 含有465 个氨基酸残基、相对分子质量为52 000,其N 端与泛素同源,称为泛素样结构域。Parkin 广泛表达于脑、心脏等组织器官,主要游离在胞质。当细胞受刺激时,Parkin 会在线粒体外膜上大量聚集,并与泛素激活酶E1、泛素结合酶E2和泛素分子一起泛素化修饰受损线粒体外膜蛋白,启动自噬清除异常的线粒体。Parkin 转移到线粒体上是启动线粒体自噬的关键。Parkin 在心脏中表达水平较高,其介导的线粒体自噬对于心脏功能维持有重要作用[7,8]。许多研究阐述了Parkin 蛋白在各器官的功能,包括证明PINK1-Mfn2-Parkin 途径是线粒体质量控制的最佳通路之一[9],Parkin 缺失使得其对心肌损伤敏感性增加[10]。此外,Parkin介导的线粒体自噬途径是完成围产期心脏发育的基础[11]。这些研究均提示,Parkin 与维持心脏生理稳态密切相关。Parkin 介导的线粒体自噬是否参与荷瘤状态下心肌损伤是值得探讨的重要科学问题。基于此,本研究将使用移植瘤模型小鼠研究荷瘤状态心肌损伤特征与线粒体损伤特征,并使用park2-/-小鼠研究Parkin 与荷瘤状态心肌损伤之间的关系及其机制。
1 材料与方法
1.1 材料
1.1.1 试 剂 Masson 染色试剂盒购自SolarBio公司,ECL化学发光检测试剂盒与BCA蛋白浓度测定试剂盒购于Millipore 公司,辣根过氧化物酶标记(HRP)的抗鼠二抗与抗兔二抗购于Cell Signaling Technology 公司,Parkin 抗体、LC3 抗体购于Abcam公司,内参GAPDH 抗体为BioTech 公司,Fluo-3 探针、Rhod-2 探针购于翊圣生物,DHE-ROS 探针购于南京建成,JC-1 探针购于碧云天,B16 黑色素瘤购于中国科学院典型培养物保藏委员会细胞库,普通小鼠饲料购自广东省医学实验动物中心,戊巴比妥钠购自Sigma公司。其余试剂均为分析纯。
1.1.2 设备小动物超声实时影像系统型号为Vevo®3100,qPCR 仪型号为ABI QuantStudio 6,显影仪型号为Bio-Rad Chemidoc MP,透射电子显微镜型号为Tecnai G2Spirit Twin。
1.1.3 实验动物 野生型SPF级C57BL/6J小鼠,购于中山大学实验动物中心(许可证号:SCXK(粤)2016-0029),SPF 级park2-/-小鼠(B6.129S4-Prkntm1Shn/J,Strain #006582)购于Jax 实验室。本研究对实验动物的使用和处理严格遵守中山大学实验动物中心管理要求。动物实验及相关操作获得中山大学实验动物管理与使用委员会(IACUC)批准(批准编号:SYSU-IACUC-2021-000574)。
1.2 方法
1.2.1park2-/-小鼠筛选与鉴定 3周龄小鼠鼠尾酚氯仿法抽提基因组DNA 用于PCR 鉴定。通过PCR鉴定小鼠基因型,引物序列使用JAX LAB 中B6.129S4-Prkntm1Shn/J(Strain #006582)小鼠的鉴定方法条目。Western Blot 检测Parkin 蛋白表达水平,筛选出park2-/-小鼠子代进行后续实验。
1.2.2 实验动物的分组与饲喂 动物房严格按照《GB14925-2010动物实验间的环境技术指标》执行昼夜明暗交替时间为12/12 h,室内温度(22±2)℃,湿度(55±5)%,小鼠自由采食和饮水。将12 只C57BL/6J 小鼠和12 只park2-/-小鼠适应性喂养1 周后,分别随机分为2 组(group control,group TB),饲养普通饲料(chow diet,CD)直至观察终点。
1.2.3 小鼠皮下移植瘤模型建立 选取6~8 周龄小鼠进行荷瘤前适应性喂养。B16 黑色素瘤细胞复苏后稳定传代2 代,待生长稳定后使用浓度为2.5 g/L 的胰蛋白酶消化,离心后弃去上层液体后使用生理盐水重悬,调整密度为每毫升5.0 ×106个细胞。将小鼠用左手大拇指和食指捏住颈部皮肤,然后将鼠尾用左手无名指和小指固定于左手大鱼际。将右侧腋窝用体积分数75% 酒精消毒3次。右手持吸有肿瘤细胞和生理盐水混合液的注射器,在右侧腋窝的位置进针,注意不要突破腹膜,将针头保持于皮下位置。然后近水平位置将针头几乎完全插入皮下,将混有肿瘤细胞注射入皮下(肿瘤细胞量约1×106个),快速退针,左手食指轻压针孔约1 min 后将小鼠放回饲养笼中。皮下移植瘤操作完成后计作荷瘤第0 天(Day 0)。对照组小鼠在相同部位进行等体积生理盐水皮下注射操作。
1.2.4 小鼠心脏超声检查操作 喂养至观察时间点(Day 14)后,对各组进行小动物心脏超声检测其功能学数据分析。使用异氟烷气体麻醉小鼠后,呈仰卧位固定于超声动物区,带上异氟烷面罩。对探测区域涂抹脱毛膏进行脱毛处理并暴露皮肤,在动物皮肤或探头上涂抹兽用专用耦合剂。调整动物平板角度与地面呈10 °,使小鼠头高脚低位,小鼠心率保持450 次/min 以上。垂直探头使声束垂直进入小鼠胸壁,调整获得小鼠心脏超声图像,将探头带标记段左右旋转5°~10°,并旋动动物平板旋钮移动动物x 轴,找到使探头长轴与小鼠左室长轴平行的位置,取得满意的左心室长轴图像。选取左心室长轴图像标准为流出道与心尖部清晰且呈直线联通、可见开闭的二尖瓣。保持上述体位及动物心率,探头带标记端向左旋转90°再次进行探测,调整动物平板旋钮移动y 轴,获得满意的左心室短轴图像。选取左心室短轴图像的标准为:心腔最大位、可见清晰的运动状态的乳头肌。
1.2.5 小鼠组织取样操作 处死前禁食不禁水8 h,称重,使用浓度为30 g/L 的戊巴比妥钠麻醉。分离心脏组织,剪开右心耳,于心尖处使用PBS 灌注至流出液清澈。将心脏剪下后置于PBS 中洗净擦干,部分置于40 g/L 多聚甲醛固定进行后续实验,部分剪块置于-80 ℃保存。
1.2.6 蛋白质免疫印迹分析 用含1 mmol/L PMSF的RIPA裂解液裂解组织,提取心脏组织总蛋白,并用BCA 蛋白定量试剂盒测定蛋白浓度。各组蛋白样品上样量均为40 μg,SDS-PAGE 电泳分离样品,240 V 恒流冰上电转120 min,将PVDF 膜置于质量分数5%BSA 封闭液中室温封闭1 h。使用相应的一抗按照说明书稀释后4 ℃孵育过夜。室温孵育二抗2 h,ECL 发光法显影,显影条带用Image J 软件进行灰度分析。
1.2.7 心脏冰冻切片染色 使用40 g/L 多聚甲醛固定心脏组织,梯度蔗糖脱水后使用OCT包埋。切成厚度为5~6 μm的切片放入-80 ℃保存。HE染色前取出切片室温复温30 min,PBS 洗去OCT 后使用苏木素染色3~10 min。流水冲洗后使用盐酸乙醇分化3 s,流水冲洗后使用伊红染色5 min。梯度乙醇脱水,二甲苯透明后封片观察。Masson染色步骤参照试剂盒说明书。免疫荧光染色前复温30min,洗去OCT,0.1%曲拉通破膜5 min,质量分数5%BSA 封闭1 h,配置相应一抗4 ℃孵育过夜,室温孵育二抗1 h,hoechst封片剂封片观察。
1.2.8 免疫荧光染色 Fluo-3 探针、Rhod-2 探针、DHE-ROS 探针及JC-1 探针使用方法均参照试剂盒说明书操作。
1.2.9 原代心肌细胞提取及共培养 使用2.5 g/L的胰蛋白酶过夜消化新鲜收集的乳鼠心脏,轻柔吹打分离新鲜心肌细胞后六孔板中培养至70%满,随即使用孔径为0.04 μm 的共培养小室架于板孔上方,小室内提前培养1 mL 复苏后稳定传代2 代的B16 黑色素瘤细胞,培养密度为2.0×106个/mL。共培养24 h后收获心肌细胞样本进行后续实验。
1.3 实验观察指标
1.3.1 PCR分析基因型 3周龄小鼠鼠尾酚氯仿法抽提基因组DNA用于PCR鉴定小鼠基因型。park2引物序列使用JAX LAB 中B6.129S4-Prkntm1Shn/J(Strain#006582)小鼠的鉴定方法条目。具体引物序列如下:Common:5’-GCAGAATTACAGCAGTTACCTGG-3’,WT:5’-CCTACACAGAACTGTGACCTGG-3’,KO:5’-ATGTTGCCGTCCTCCTTGAAGTCG-3’。若park2被完全敲除即纯合子,PCR 仅扩增出500 bp 条带;若为杂合子,PCR 扩增出500 bp 和250 bp 两条带;野生型小鼠,PCR 仅扩增出250 bp条带。
1.3.2 心脏超声数据分析指标 检测方法参照1.2.3 步骤。采集心脏长轴左心室收缩末期内径(left ventricular end-systolic dimensions,LVDs)、左心室舒张末期内径(left ventricular end-diastolic dimensions,LVDd)、左心室收缩末期容积(left ventricular end-systolic volume,LVVs)、左心室舒张末期容积(left ventricular end-diastolic volume,LVVd)、射血分数(ejection fraction,EF)、缩短分数(fractional shortening,FS)、左心室前壁厚度(left ventricular anterior wall thickness,LVAW)、左心室后壁厚度(left ventricular posterior wall thickness,LVPW)。
1.3.3 蛋白质免疫印迹分析 ECL 发光法显影,显影条带用Image J 软件进行灰度分析,计算不同组别样品中Parkin和LC3 Ⅱ/LC3 I的相对表达量。
1.3.4 心脏冰冻切片染色 镜下拍摄不同组别小鼠心脏HE染色图像与Masson染色图像。
1.3.5 免疫荧光染色 Fluo-3 探针、Rhod-2 探针、DHE-ROS 探针及JC-1 探针使用方法均参照试剂盒说明书操作。使用荧光显微镜对荧光强度进行拍摄,使用Image J软件进行荧光强度分析。
1.3.6 透射电子显微镜拍摄 制样流程与上机流程由技术员操作。图像采集观察不同组别小鼠心肌细胞线粒体数量、形态变化。
1.4 统计学分析
使用SPSS 20.0 软件进行统计分析,所有数据均以平均数±标准差表示,组间比较采用独立样本t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 荷瘤小鼠心功能损伤和心肌细胞线粒体异常
皮下移植瘤Day12 后荷瘤状态小鼠及对照组小鼠体质量出现差异,荷瘤组体质量高于对照组,说明肿瘤组织生长明显,小鼠总体质量增加(12 d:t=2.236,P=0.049;14 d:t=7.050,P=0.000 035;图1 A);对荷瘤状态小鼠及对照组小鼠进行心脏功能检测,结果显示荷瘤Day14 小鼠LVDs 与LVVs 较对照组增 大(LVDs:t=2.985,P=0.041;LVVs:t=3.391;P=0.028;图1 C、E),EF 与FS 较对照组降低(EF:t=4.934,P=0.007 9;FS:t=5.677;P=0.004 8;图1 G、H),而LVAW 及LVPW 改变无明显差异(图1 I、J),表明荷瘤状态引起心脏射血功能下降、心脏收缩功能损伤,而心室壁结构的改变并不明显;采集心脏组织进行病理学观察,镜下HE 染色及Masson染色显示荷瘤Day 14小鼠较对照组小鼠心脏组织形态无明显改变(图1 K),透射电镜结果显示荷瘤Day 14小鼠心肌细胞线粒体出现空泡化,空泡化线粒体数量增多(t=3.240;P=0.032),线粒体大小差异较大,可见新生的长条状线粒体(图1 L)。以上数据提示在荷瘤状态下,心肌细胞线粒体发生损伤,并激活机体代偿性生成线粒体。
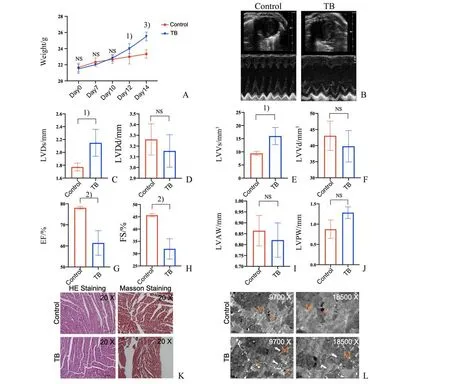
图1 荷瘤小鼠心功能损伤并伴随心肌线粒体改变Fig.1 Impaired function and mitochondrial alterations of cardiomyocyte in tumor-bearing mice
2.2 荷瘤诱发心肌细胞线粒体损伤
JC-1 用于检测线粒体膜电位(mitochondrial membrane potential,△Ψm)的荧光探针。在线粒体膜电位较高时,JC-1 聚集在线粒体的基质中,形成可发生红色荧光的聚合物(polymer);在线粒体膜电位较低时,JC-1 不能聚集在线粒体基质,此时JC-1 为可发生绿色荧光的单体(monomer),通过荧光颜色的转变来检测线粒体膜电位的变化。羰基氰化物间氯苯腙(carbonyl cyanide 3-chlorophenylhydrazone,CCCP)是一种氧化磷酸化抑制剂,可使电子传递链的质子浓度梯度解偶联,消除线粒体膜电位,损伤线粒体。原代心肌细胞JC-1 染色结果显示,荷瘤共培养心肌细胞线粒体膜电位下降(t=5.028;P=0.007 3;图2 A-B),膜电位稳态失衡,线粒体出现损伤;心肌细胞细胞质游离钙离子[c(Ca2+)]浓度(图2 C-D)与心肌细胞线粒体钙离子浓度[m(Ca2+)]浓度(图2 E-F)较对照组升高[c(Ca2+):t=8.705;P<0.000 1;m(Ca2+):t=8.269;P<0.000 1)],荷瘤共培养心肌细胞出现了钙超载与线粒体钙超载现象,提示线粒体出现不可逆损伤;荷瘤状态心肌细胞DHE 平均荧光密度较对照组升高(t=6.329;P=0.0032;图2 G-H),荷瘤状态下细胞内ROS 含量升高,可能心肌细胞线粒体损伤有关。
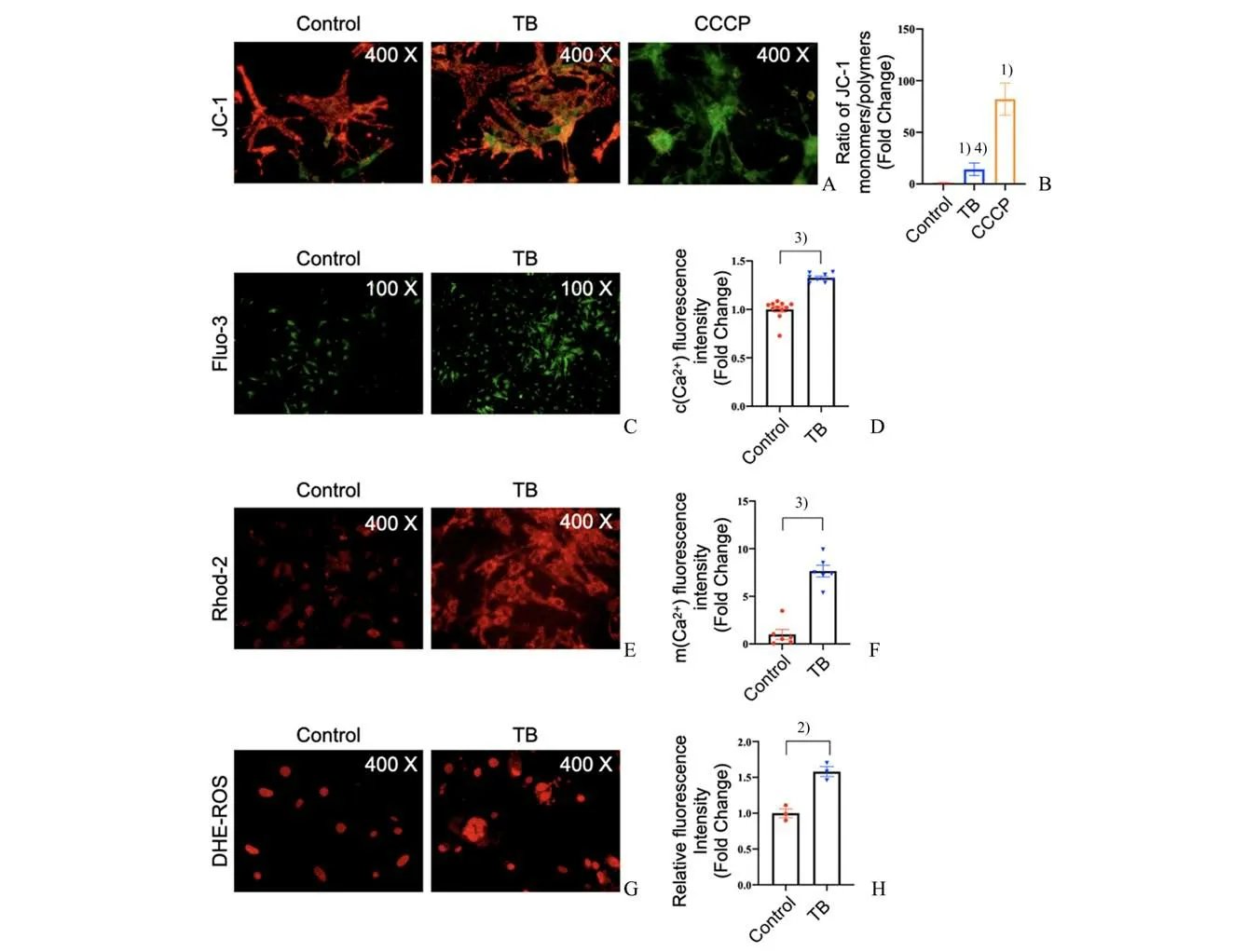
图2 荷瘤状态心肌细胞线粒体损伤Fig.2 Mitochondrial damage in cardiomyocytes with tumor-bearing
2.3 荷瘤状态下心肌细胞线粒体相关因子表达改变
检测荷瘤Day14 小鼠及对照组心脏组织线粒体生成相关因子tfam 和nrf1、线粒体融合相关因子opa1 和mfn2、线粒体分裂相关因子fis1、线粒体自噬相关因子park2 等。数据显示,荷瘤小鼠心脏组织中nrf1、opa1、mfn2 及tfam 表达水平较对照组上调(nrf1:t=3.210;P=0.032 6;opa1:t=9.860;P=0.000 6;mfn2:t=5.447;P=0.005 5;tfam:t=29.48;P<0.000 1;图3 A-C,F),提示荷瘤可刺激线粒体融合过程,并增加了线粒体合成;此外,荷瘤状态下park2 表达水平上调(t=6.868;P=0.002 4;图3 E),心肌细胞线粒体自噬增强。结合上述结果,提示荷瘤可引起心肌损伤激活机体线粒体自噬进程,促进线粒体的生成以及受损线粒体的清除。

图3 荷瘤状态心肌细胞线粒体相关因子改变Fig.3 Alterations of mitochondria-related factors in cardiomyocytes with tumor bearing
2.4 荷瘤诱导心肌细胞线粒体自噬增强
进一步分析细胞线粒体自噬相关分子Parkin及LC3-Ⅱ、LC3-Ⅰ表达水平。数据显示,与对照组相比,荷瘤Day 14小鼠心脏组织Parkin 蛋白表达水平明显上调。同时,在自噬形成时,胞浆型LC3 水解形成LC3-Ⅰ,LC3-Ⅰ跟磷脂酰乙醇胺结合转变膜型LC3-Ⅱ,LC3-Ⅱ/Ⅰ比值的大小可估计自噬水平的高低。利用Western Blot 检测荷瘤小鼠心脏组织LC3-Ⅰ和LC3-Ⅱ的表达,并分析LC3-Ⅱ/Ⅰ比值。数据显示,与对照组相比,荷瘤小鼠心脏中Parkin 表达水平升高(t=6.223;P=0.000 8;图4 AB),同时LC3-Ⅱ/LC3-Ⅰ比值明显升高(t=6.063;P=0.000 9;图4 A,C),提示荷瘤状态可激活机体线粒体自噬途径,促进受损线粒体清除,维持细胞内部线粒体稳定性。Parkin 介导的线粒体自噬与荷瘤状态心肌损伤之间存在相关性。
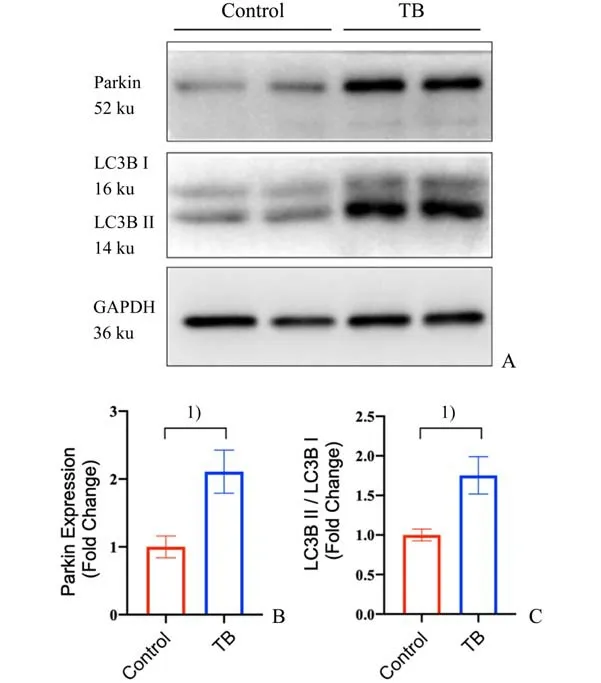
图4 荷瘤状态心肌细胞线粒体自噬增强Fig.4 Enhanced mitophagy in cardiomyocytes with tumor bearing
2.5 Park2-/-小鼠荷瘤后心功能下降显著
为了研究Parkin 与荷瘤心肌损伤之间的关系,我们建立了park2-/-小鼠荷瘤模型。采用PCR 鉴定和筛选park2-/-小鼠,PCR 产物鉴定方法参照JAX LAB 中B6.129S4-Prkntm1Shn/J(Strain #006582)小鼠的鉴定方法条目,具体如下:纯合子为500 bp 条带,杂合子同时有500 bp 和250 bp 的条带,野生型小鼠只有250 bp 条带(图5 A)。Western Blot 检测数据显示,park2-/-小鼠心脏组织Parkin 蛋白水平明显低于野生型小鼠(t=5.056;P=0.007 2;图5 B)。免疫荧光共定位结果显示park2-/-小鼠心肌细胞中Parkin蛋白表达水平低于野生型小鼠(图5 C-D)。
Park2-/-小鼠荷瘤后(park2-/-+TB)死亡率增加(图5 E)。对存活小鼠进行小动物心脏超声功能检测,结果显示正常生理情况下park2-/-小鼠心脏射血功能无明显差异(图5 L-M);park2-/-+TB 组小鼠LVD 及LVV 均上升(LVDs:t=10.43,P=0.000 5vs.park2-/-mice,t=6.572,P=0.002 8vs.TB mice;LVDd:t=4.857,P=0.004 6vs.park2-/-mice,t=3.945,P=0.010 9vs.TB mice;LVVs:t=5.705,P=0.002 3vs.park2-/-mice,t=6.784,P=0.000 3vs.TB mice;LVVd:t=4.265,P=0.008 0vs.park2-/-mice,t=3.536,P=0.016 6vs.TB mice;图5 H-K),EF 与FS显著降低(EF:t=8.650,P=0.000 3vs.park2-/-mice,t=3.063,P=0.028 0vs.TB mice;FS:t=8.032,P=0.000 5vs.park2-/-mice,t=2.805,P=0.037 8vs.TB mice;图5 L-M),提示park2-/-小鼠在荷瘤状态下心脏功能受损更明显。Parkin 通过介导线粒体自噬参与对细胞内受损线粒体的清除,敲除Parkin 加剧了荷瘤状态心肌损伤。
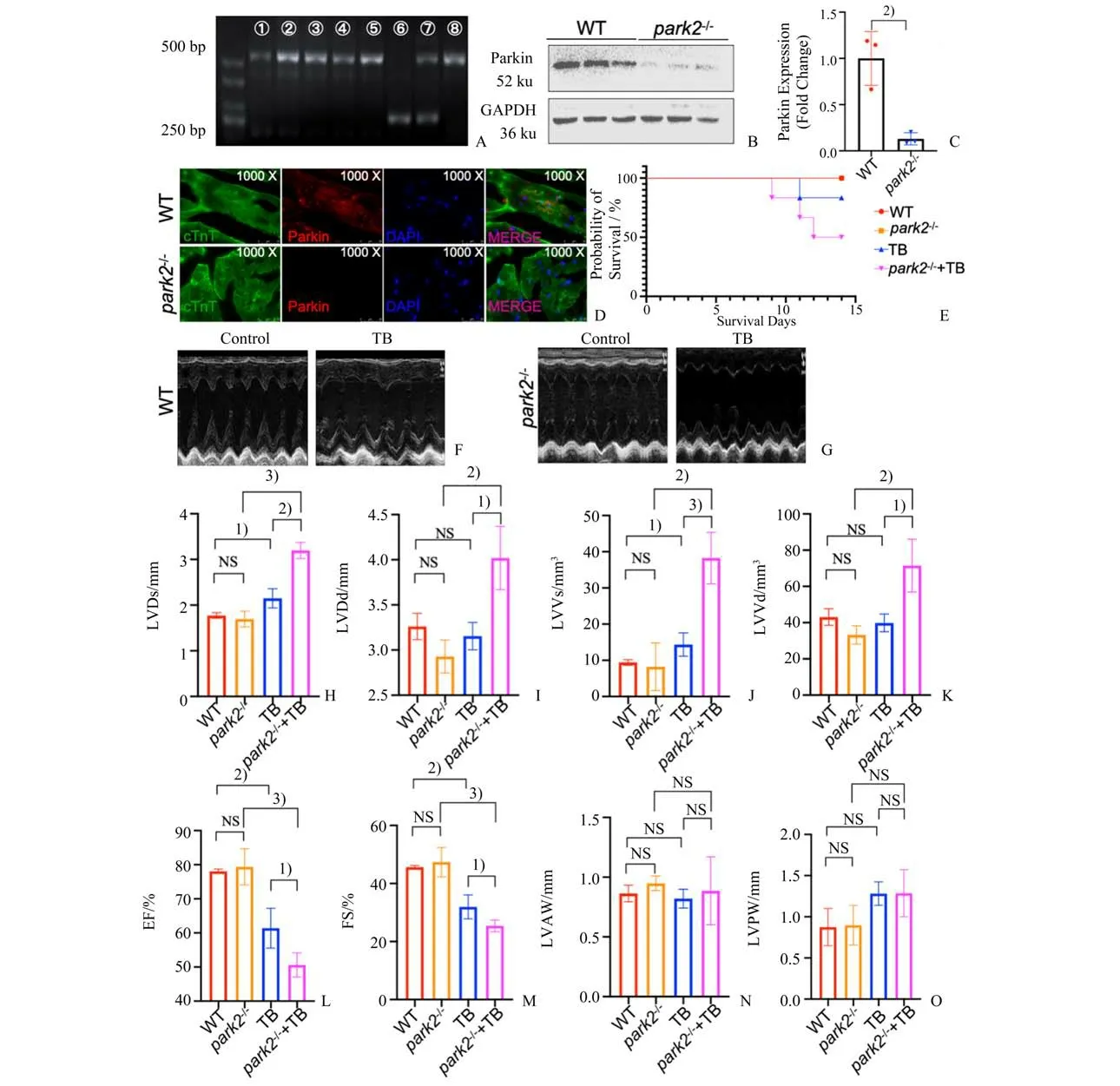
图5 Park2-/-小鼠荷瘤后心功能损伤加重Fig.5 Aggravation of cardiac functional impairment in park2-/-mice with tumor bearing
2.6 Park2-/-小鼠荷瘤后线粒体损伤加剧
对WT,park2-/-,TB 以及park2-/-+TB 四组使用JC-1 探针进行电位检测及电镜观察。JC-1 探针荧光计算方法见2.2 项。原代心肌细胞JC-1 探针染色结果显示park2-/-组生理情况下线粒体膜电位出现下降(t=12.24;P=0.000 3vs.WT-Control mice),park2-/-+TB 组小鼠膜电位下降更加显著(t=5.080,P=0.007 1vs.park2-/-mice,t=6.479,P=0.002 9vs.TB mice;图6 A-B);组织电镜结果显示park2-/-小鼠生理情况下线粒体出现明显空泡化,嵴断裂等损伤特征,荷瘤后park2-/-小鼠线粒体损伤程度更明显,可见线粒体空泡化加剧(图6 C)。
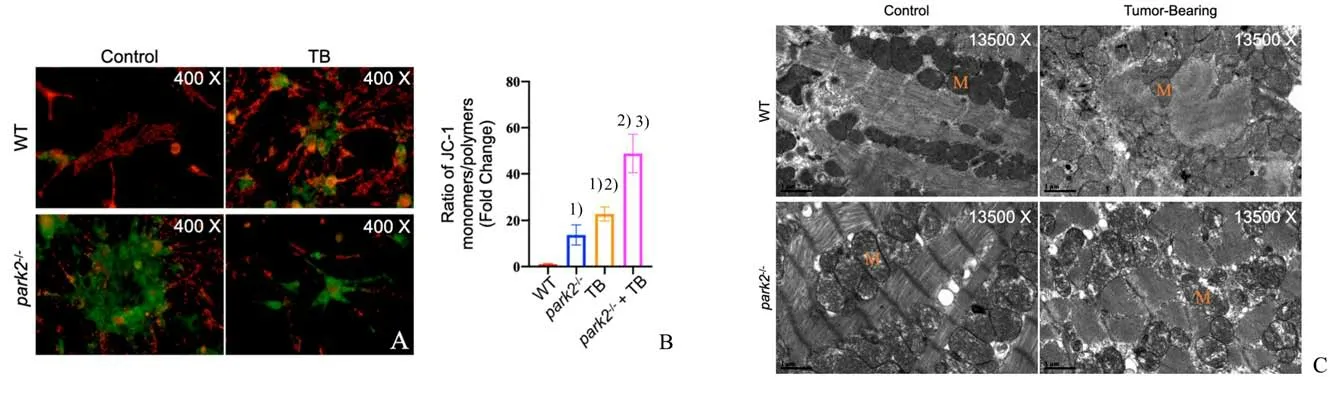
图6 Park2-/-小鼠荷瘤后线粒体损伤加剧Fig.6 Exacerbated mitochondrial damage in park2-/-mice with tumor bearing
2.7 Park2-/-小鼠线粒体自噬受到抑制
Western Blot 分析数据显示,与Tumor Bearing相比,park2-/-+TB 小鼠心脏组织中Parkin 蛋白缺失(t=10.07;P<0.000 1;图7 A-B)。进一步分析LC3B Ⅱ和LC3B I 表达水平,数据显示,与TB 组相比,park2-/-+TB 小鼠心脏LC3 Ⅱ/LC3 I 比值明显下降(t=5.082;P=0.002 3;图7 A,C),敲除Parkin,线粒体自噬途径受抑制,进一步提示线粒体自噬参与了荷瘤心肌损伤的病理生理过程。

图7 park2-/-小鼠线粒体自噬受到抑制Fig.7 Reduced mitophagy in park2-/-mice
3 讨论
E3 泛素-蛋白连接酶Parkin 通过其介导线粒体自噬的途径参与多种病理过程[12,13]。由于心脏是个高耗能器官,富含线粒体,因此当线粒体损伤或功能异常,会影响心功能发生改变,这种改变与心血管损伤的发生发展密切相关。线粒体自噬是一种特异性清除损伤线粒体的自噬现象,在正常情况下,心肌细胞通过线粒体自噬途径清除受损线粒体,是机体控制线粒体质量的重要途径。目前已有许多研究阐述Parkin 蛋白对机体发育、特别是心脏发育过程中的作用,并有研究指出Parkin 通过其PINK1-Mfn2-Parkin 途径介导的线粒体自噬完成心肌细胞线粒体的转换,使其能量利用由葡萄糖转变为脂肪酸[11]。但对于Parkin 蛋白对心脏功能的影响目前尚未完全确定,部分研究指出Parkin 缺失在正常成年小鼠中不引起疾病表型,但是在MI 模型中park2-/-小鼠对损伤的敏感性更强,心功能受损程度更重[14];另一方面,有研究发现park2-/-小鼠在围产期心脏发育具有调控意义,park2-/-或导致致死性的心肌病发生[11],由此可见,Parkin 蛋白在心脏损伤过程中具有一定的作用。本研究以荷瘤状态下出现的心功能下降为切入点[3],验证前述报道中荷瘤状态能够引起心功能下降,移植瘤模型小鼠LVDs 与LVVs 上升,心功能EF 与FS 下降,出现了心功能减退表型,进一步病理观察显示心肌细胞线粒体发生损伤,同时通过关键分子分析,发现以Parkin 介导的线粒体自噬为主的线粒体质量控制系统与荷瘤状态心肌损伤过程之间具有明显相关性,因此使用park2-/-小鼠进一步研究Parkin 与荷瘤状态心肌损伤的相互作用。研究发现当Parkin 蛋白缺失时,荷瘤小鼠死亡率升高,心功能受损更严重,镜下线粒体损伤加重。出现这种现象的原因可能是在荷瘤状态下,由于包括ROS增加在内的多种原因,心肌细胞线粒体受损,心功能下降,激活以线粒体自噬为主的线粒体质量控制系统,对受损线粒体进行清除与新生线粒体补充来抑制损伤进一步加重;在Parkin 蛋白缺失时,park2-/-小鼠心肌细胞内线粒体自噬受到抑制,无法及时清除受损线粒体,引起受损线粒体逐渐增多,外加异常的活性氧(ROS)[2,10,15]产生等多种原因引起心肌细胞损伤加重,从而引起心功能受损加剧。
此外,尽管部分研究提出Parkin 蛋白的缺失在成年小鼠中不引起疾病表型,但PINK1-Mfn2-Parkin途径在介导线粒体自噬的过程中起着非常重要的作用[16],并且在park2-/-成年小鼠中,线粒体表现得更为小而排列混乱,并且随着时间推移会出现异常的密集电子包裹体[11,14]。结合先前对Parkin 的研究,Parkin 蛋白在维持正常的线粒体形态以及防止异常的活性氧(ROS)产生中具有重要作用[2]。并且在成熟个体内,即使Parkin 蛋白的表达缺失,也能通过其他的补偿机制进行更复杂的线粒体质量控制。而在发育期内,Parkin 作为线粒体转换的关键分子,对于心脏发育具有重要调控意义[11]。胚胎期心脏对生物能的要求较低,因此与成年期心脏以脂肪酸和氨基酸为能量底物不同,胚胎期心脏通过保留这些脂肪酸和氨基酸成分,用以提供发育所需的细胞膜和蛋白质成分。因此,在胎儿心脏中,ATP 主要是通过代谢葡萄糖产生的。出生后的心肌细胞代谢模式转变对游离脂肪酸的倾向性[17],在此时期,心脏基因表达的特征性变化促成了使用葡萄糖的胎儿线粒体被“重新编程”为可代谢脂肪酸的成熟线粒体[11,18,19]。结合肿瘤本身特殊的代谢模式(Warburg 效应),我们不能否认肿瘤特殊的代谢模式会对心肌细胞产生影响,引起心肌细胞代谢改变。因此,特殊的代谢模式可能引起心肌细胞内功能受损的结构肿胀的线粒体大量堆积无法清除,无法负担大量用于心脏搏动的能量消耗,引起心功能损害。但荷瘤状态心肌损伤、Parkin 介导的线粒体自噬与心肌细胞代谢改变三者之间的关系仍有待进一步研究。
