MMS21通过维持MCM2-7复合物稳定性促进肝细胞癌增殖活性
2022-04-18李文佳朱元昕胡开顺
李文佳,朱元昕,胡开顺
(中山大学孙逸仙纪念医院基础与转化医学研究中心//广东省恶性肿瘤表观遗传与基因调控重点实验室,广东广州 510080)
肝癌是世界第六大常见的恶性肿瘤。在中国,肝癌更是位列肿瘤相关死亡原因第二位;其中,85%~90%属于肝细胞癌(hepatocellular carcinoma,HCC)。早期诊断率低、有效治疗药物的缺乏、术后易复发等,是导致肝癌患者预后差的主要原因[1]。因此,深入研究肝癌形成及进展的分子机制,寻找新的诊断及治疗靶点,仍然是目前肝癌研究的重要内容。SUMO E3连接酶MMS21(NSMCE2),结构上包含两种染色体结构维持蛋白(Smc5/6)和一个Siz/PIAS(激活信号转导蛋白抑制剂和转录激活因子)RING 结构域,具有E3 连接酶活性并参与Small Ubiquitin-like Modifier(SUMO)进程。当E3 连接酶MMS21 的SUMO 活性被破坏时,会导致不同的表型,如DNA 损伤、核仁完整性和端粒聚集缺陷等[2]。MMS21 作为SMC5/6 复合体的亚基,同时也是停滞叉蛋白质组的关键组成部分,能拮抗基因组不稳定[3]。Zhao[2]和Branzei 等[4]发现在芽殖酵母中,MMS21 的缺失是致命的,虽然缺失其部分SUMO活性不完全致死,但造成复制相关DNA 修复缺陷。Richard 等[5]证明MMS21 通过维持DNA 修复、平衡转录和基因组稳定性等在植物发育过程起到至关重要的作用。Kelvin 等[6]发现MMS21 是复制应激修复反应的基因产物,是细胞有效拯救折叠的复制叉以完成DNA 合成所必需的。然而MMS21在肝癌中的功能与作用机制尚未报道,我们将对此问题进行全面探讨,以期为肝癌的诊断和治疗提供新的靶点和理论依据。
1 材料与方法
1.1 材料与试剂
表达载体pLVX-DsRed-Monomer-N1(Clontech,632152),胎牛血清(LONSERA,S712-012),总RNA 提取试剂盒(ESscience,RN001),逆转录试剂盒(TaKaRa,RR047A-1),SYBR Green qPCRMix(TaKaRa,RR820),ECL 化学发光底物(Vazyme,E412-01-AA),高保真酶(TaKa-Ra,R040),限制性内切酶BamH1(Thermo Scientific,ER0051),Xho1(Thermo Scientific,ER0691),GeneJET PCR 纯化试剂盒(Thermo Scientific,K0702),T4 连接酶(Thermo Scientific,EL0014),粘附载玻片(CITOTEST,80312-3161),显微镜盖玻片(CITOTEST,80340-3610),快速银染试剂盒(Beyotime,P0017S),RNase(AG,A3A0336),PI(Beyotime,ST511),Lipofectamine®RNAiMAX(Thermo Scientific,13778150),anti-BrdU(ABclonal,A1482),DAPI(Beyotime,C1002),Goat anti-Mouse IgG(H+L)Cross-Adsorbed Secondary Antibody,Alexa Fluor 488(Thermo Scientific,A11001),anti-IdU(Origene,TA190129),anti-BrdU(Abcam,ab6326),Goat anti-Rat IgG(H+L)Cross-Adsorbed Secondary Antibody,Alexa Fluor 555(Thermo Scientific,A-21434),anti-MYC(Servicebio,GB12076),anti-Tubulin(TransGen Biotech,HC101-01),anti-Cyclin A2(CST,4656T),anti-Cyclin B1(CST,4138T),anti-Cyclin D1(PTG,60186-1-Ig),anti-Cyclin D3(CST,2936T),anti-Cyclin E1(PTG,11554-1-AP),anti-MCM2(BD,610700),anti-MCM3(PTG,15597-1-AP),anti-MCM4(PTG,13043-1-AP),anti-MCM5(PTG,11703-1-AP),anti-MCM6(BD,611622),anti-MCM7(PTG,11225-1-AP),anti-NSE2/MMS21(Santa,sc-51747)。
1.2 细胞培养
SK-hep1、Huh7、HepG2、SNU-182 和LO2 细胞均来自中科院上海细胞库,细胞在37 ℃和5% CO2的培养箱中使用含有10%的FBS 高糖DMEM 培养基培养。
1.3 PCR扩增MMS21
以SK-hep1 全基因组cDNA 为模板,高保真酶扩增目的基因。反应条件为:98 ℃5 min;98 ℃10 s;55 ℃5 s;72 ℃1 min,进行35 个循环。将PCR 产物进行电泳检测,取正确大小的胶带进行回收纯化。纯化后的产物用BamH1 和XhoI 内切酶37 ℃反应1 h 后,纯化片段,并用T4 连接酶将其连接到同样酶切过后的Plvx表达载体中,通过大肠杆菌转化涂板,挑选出单克隆菌落,测序鉴定。MMS21 PCR扩增引物:F(含MYC标签):CCCTCGAGATGGAGCAGAAACTCATCTCTGAAGAGGATCTGAT -GCCAGGACGTTCCAGTTC;R:CGGGATCCTCCTA CTCGGAATGACGATGTC。
1.4 免疫沉淀与质谱
采用10 cm 大皿扩增Plvx-MYC-MMS21 和Plvx-MYC-Vector 细胞,待细胞长到85%,去除上清,用1 mL 含有蛋白酶抑制剂和磷酸酶抑制剂的NETN buffer(20 mmol/L Tris-HCl[pH 8.0],100 mmol/L NaCl,1 mmol/L EDTA and 0.5% Nonidet P-40)裂解液将细胞在冰上裂解30 min 并收集[7]。再用4 ℃15 000×g高速离心机去除细胞碎片沉淀,收集上清。在上清中加入用NETN buffer 清洗过三次的MYC标签的琼脂糖珠,置于4 ℃冰箱摇床孵育过夜。将琼脂糖珠-抗体-蛋白的混合物清洗三次,取90%样品进行银染及质谱分析,10%样品在98 ℃高温变性10 min,置于8%SDS-PAEG电泳胶。
1.5 DNA Fiber
在细胞密度70%~85%时,CIdU(50 μmol/L)处理20 min 后,用PBS 洗两次,用IdU(500 μmol/L)处理20 min,用胰酶消化细胞并收集于1.5 mL EP 管中离心,用预冷的PBS 重悬细胞沉淀,置于冰上30 min,将1 μL 细胞滴在载玻片静置片刻,待液滴边缘干燥时,加入裂解液7 μL并静置2 min,再将载玻片倾斜(20°~40°角)使液滴缓慢流下,待玻片风干后,固定并变性90 min,用PBS 洗3 min,用免疫荧光封闭液封闭30 min,加入一抗BrdU(Rat)/IdU(M)于4 ℃孵育过夜。第二天用PBST 清洗3 次,每次3 min,荧光二抗Goat anti-Rat IgG(H+L)Cross-Adsorbed Secondary Antibody,Alexa Fluor 555 和Goat anti-Mouse IgG(H+L)Cross-Adsorbed Secondary Antibody,Alexa Fluor 488 混合液常温孵育1 h,用PBST 洗3 次后,载玻片依次用75%、95%和无水乙醇脱水。载玻片用盖玻片封片后,在具有63倍物镜的激光共聚焦显微镜下成像。
1.6 流式细胞术
细胞用siRNA 处理48 h后,用胰酶将细胞消化收集在1.5 mL EP 管中,常温120×g低速离心机离心,细胞沉淀用预冷的PBS 清洗1 次后,用1 mL 预冷的PBS 和75%酒精混合物(1:9)重悬细胞沉淀。单细胞悬浮液在4 ℃固定过夜后,离心去上清,避光加入1 mL RNase 和PI 混合液(RNase 工作浓度2 μg/mL,PI 工作浓度50 μg/mL)并避光孵育30 min。处理后的单细胞悬浮液置流式管中,使用流式细胞仪测定,数据采用ModFit LT 5.0软件进行分析。
1.7 定量PCR
总RNA 提取、反转录、qPCR:均使用购自Takara的提取,反转录、qPCR 试剂盒,参照说明书操作。β-actin 的qPCR 引物F:5’-TCATGAAGTGTGACGTGGACAT-3’,R:5’-CTCAGGAGGAGCAATGATCTTG-3’;MMS21 的qPCR 引 物F:5-ATGCCAGGACGTTCCAGTTC-3’,R:5’-CCATACCAGA GTTGATACA GGCT-3’。
1.8 细胞siRNA转染
在细胞密度40%~50% 时,进行细胞siRNA(small interference RNA)干扰。具体实验步骤如下:分别将5 μL Lipofectamine®RNAiMAX 试剂用150 μL Opti-MEM 培养基稀释成混合液(1),30 pmol siRNA 用150 μL Opti-MEM 培养基稀释成混合液(2)。再将混合液(2)加入混合液(1)中,室温孵育5 min 后,加入细胞培养皿中。细胞在37 ℃和5% CO2的培养箱中继续培养48 h。MMS21 siRNA序列如下:siMMS21#1:5’-UUCAACCAUUGCCUUGUCCTT-3’,siMMS21#2:5’-GACUGAAGUGAG UAGUGAAdTdT-3’。
1.9 统计学方法
采用SPSS 25.0 软件进行数据统计分析,GraphPad Prism 8.0 软件作图。组间数据平均值比较采用Student′st-test检验。
2 结果
2.1 MMS21 在肝细胞癌中高表达且与预后不良相关
为了阐述MMS21 在肝癌发生发展中的作用,我们首先分析了MMS21在HCC 中的mRNA 表达水平。Gene Expression Profiling Interactive Analysis(GEPIA)(http://gepia.cancer-pku.cn/)的数据显示,与160 例癌旁组织(N)相比,369 例肝细胞癌组织(T)中的MMS21 表达显著上调(图1A)。同时在数据库clinical proteomic tumor analysis consortium(CPTAC)(https://proteomics.cancer.gov/programs/cptac)中,对比HCC的癌旁组织,MMS21(NSMCE2)在肝癌组织中的蛋白水平也呈现高表达(图1B)。值得注意的是,MMS21 的高表达与肝癌患者的不良预后相关(图1C)。接下来,我们收集了正常肝细胞系LO2 和4 个肝癌细胞系(Huh7、SK-hep1、HepG2 和SUN-182)以做进一步的证明。通过qPCR 和Western blot 分别检测mRNA 和蛋白表达水平,结果显示肝癌细胞系中MMS21 的mRNA 和蛋白表达明显高于正常肝细胞系(图1D)。综上所述,MMS21与肝癌的恶性进展密切相关。
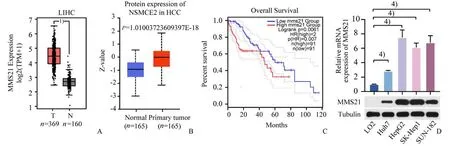
图1 MMS21在肝细胞癌中高表达且与患者预后不良相关Fig.1 MMS21 was upregulated in HCC tissues and associated with poor prognosis
2.2 沉默MMS21阻碍肝癌细胞G1-S期的转换
接下来,为证明MMS21 在肝癌增殖中的重要作用,我们分别敲低肝癌细胞SK-hep1 和HepG2中的内源性MMS21 蛋白表达来进行功能缺失实验(图2A)。细胞周期分析显示,在MMS21 敲低的SK-hep1 细胞中G1 期比例增加,S 期比例减少,G2/M 期的比例减少;同样在HepG2 细胞中,敲低内源性MMS21 后,G1 期细胞比例增加,S 期细胞比例减少,G2/M 期细胞的比例减少(图2B、2C)。
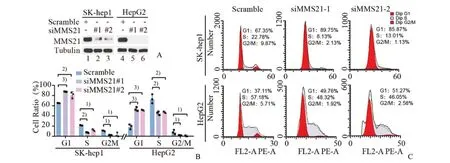
图2 沉默MMS21阻碍肝癌细胞G1-S期的转换Fig.2 MMS21 silence blocks the G1-S phase transition in HCC cells
2.3 沉默MMS21抑制肝癌细胞的增殖
为进一步探讨肝细胞癌中MMS21 的促增殖作用,我们利用BrdU和克隆形成试验来评估MMS21对肝癌细胞SK-hep1和HepG2细胞增殖能力的影响。如 图3A、3 所 示,在MMS21 敲低的SK-hep1 和HepG2 细胞中,SK-hep1 细胞增殖能力和克隆形成能力显著降低。在HepG2 细胞中也得到了一致结论,敲低内源性MMS21后细胞的增殖能力显著下降。
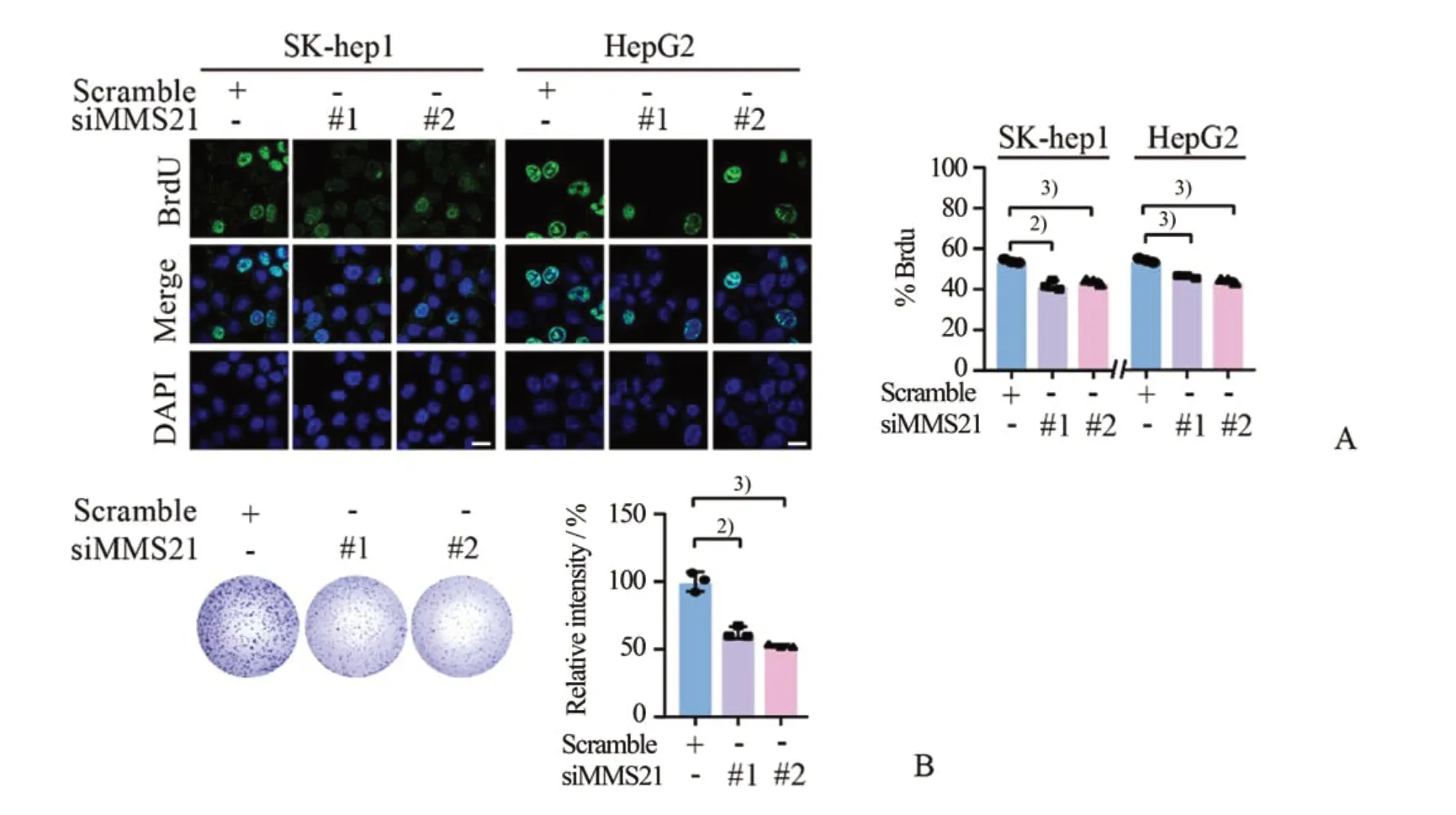
图3 沉默MMS21抑制肝癌细胞的增殖Fig.3 Depletion of MMS21 inhibits HCC cells proliferation
2.4 沉默MMS21减慢DNA复制叉的速度
我们进行了DNA Fiber 实验以研究敲低MMS21 后对细胞复制叉动力学的影响,以进一步明确MMS21 调控肝细胞癌增殖的分子机制。与对照细胞(~1.154 kb/min)相比,敲低MMS21 的细胞中表现出平均复制速度(~0.844 kb/min 和~0.9125 kb/min)显著降低。这些结果表明MMS21在肝癌细胞的DNA复制过程中发挥十分重要作用(图4)。
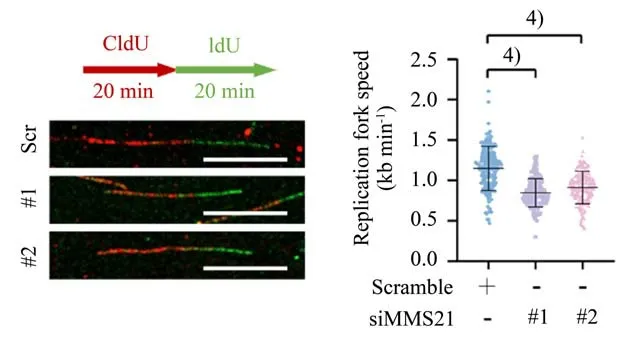
图4 沉默MMS21减慢DNA复制叉的速度Fig.4 MMS21 knockdown reduces the DNA replication-fork speed
2.5 MMS21互作蛋白组聚类分析
我们以上数据表明,MMS21 在肝癌细胞的增殖中发挥着重要作用。为了更深入地了解MMS21在HCC 形成中的潜在机制,我们采用质谱蛋白质组学来鉴定MMS21的下游靶蛋白。在稳定过表达MMS21 的SK-hep1 细胞中,Co-IP 后的银染结果提示,与对照组相比,有较多差异蛋白存在(图5A、5B)。进一步,我们通过质谱鉴定了MMS21的互作蛋白质组。对比对照组和实验组质谱数据,鉴定出与MMS21 特异结合的641 个蛋白(图5C)。通过对641 个互作蛋白进行GO(Gene Ontology)分析,显示MMS21 及其互作蛋白参与蛋白翻译、定位、折叠,线粒体翻译以及免疫反应等细胞过程,同时利用3.6.3 Cytoscape 分析软件,进一步对与MMS21 相互作用的蛋白构建蛋白相互作用关系网。值得注意的是,MMS21 的互作蛋白与细胞周期调控密切相关,如Cyclin A2,MCM3/5/6等(图5D-5F)。
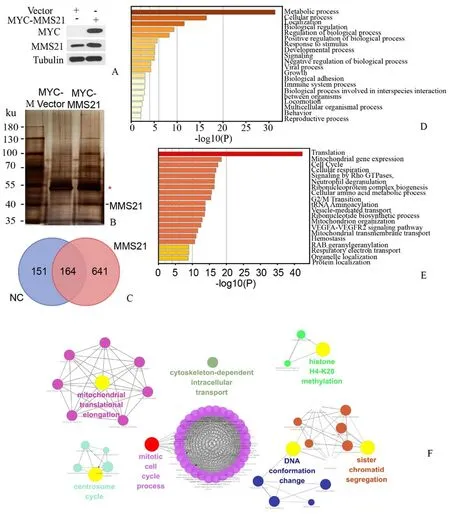
图5 MMS21互作蛋白组聚类分析Fig.5 Bioinformatic clustering analyses of MMS21 interactome
2.6 MMS21参与调控肝癌细胞的周期蛋白
细胞周期受到细胞周期蛋白、细胞周期蛋白依赖性激酶等的共同调节。如图6A 所示,在经典细胞周期模型中,G1期细胞受生长因子刺激会导致D型细胞周期蛋白(Cyclin D1、D2 和D3)上调,进而激活细胞周期蛋白依赖性激酶CDK4/6,形成的Cyclin D-CDK4/6 复合物与E 型细胞周期蛋白(Cyclin E1 和E2)及其相关激酶(主要是CDK2,但也有CDK1/3)磷酸化并使视网膜母细胞瘤蛋白Rb 失活。在协同作用驱动下细胞进入S 期,此时细胞周期蛋白A2(Cyclin A2)上调并与CDK1/2 结合促进S期进展。在第二个间隙阶段(G2)之后,细胞周期蛋白B(Cyclin B)易位到细胞核,激活CDK1,并推动遗传物质分离到子细胞。通过质谱结果,提示我们MMS21 可能参与调控细胞周期蛋白。为了验证这一假说,我们进行了蛋白质印迹分析,结果显示MMS21 敲低后,可以显著降低S 期和G2/M 期的周期蛋白表达量,而对G1 期的前期周期蛋白没有显著变化,G1 期的后期周期蛋白E1 水平增加(图6B)。微小染色体维持蛋白家族(minichromosome maintenance proteins,MCMs)是DNA 复制所必需的蛋白,MCM2-7形成的六聚体具有DNA解旋酶活性是DNA复制解旋酶的催化核心,在单个细胞的S期中确保基因组DNA 完全准确的复制。为了进一步证实MMS21 参与细胞周期的调控,我们敲低MMS21 蛋白后检测MCM2-7 复合物的蛋白水平,发现整个复合物蛋白水平都降低,其中MCM3/6 降低尤其明显。综上所述,MMS21 能够影响细胞周期蛋白表达水平进而调控肝癌细胞的增殖(图6C)。

图6 MMS21参与调控肝癌细胞的周期相关蛋白稳定性Fig.6 MMS21 maintained the protein stability of several cell cycle regulators in HCC
3 讨论
近年来,随着手术方案的改进以及新的化疗方案等的出现,虽然肝癌患者的生存率较前有所提高,但是肝癌患者的预后仍然较差[8]。因此,深入阐明肝癌发生发展的分子机制,对于寻找新的诊断及治疗靶点、改善肝癌患者的预后具有十分重要的作用。
在本课题研究中,我们通过GEPIA 和CPTAC数据库分析发现,在肝癌组织中MMS21 的mRNA和蛋白水平均呈高表达,并且其高表达与肝癌患者不良预后相关。进一步,通过qPCR 和Western blot检测LO2(人正常肝细胞)、Huh7、HepG2、SK-Hep1和SUN-182 等细胞系,发现在肝癌细胞系中MMS21 的mRNA 和蛋白水均显著上调。提示,MMS21 在肝癌中可能发挥促癌的功能。同时在GEPIA 数据库中,我们也发现MMS21 在胆管癌(CHOL)、弥漫大B 细胞淋巴瘤(DLBC)、胶质母细胞瘤(GBM)、胰腺癌(PAAD)和胸腺癌(THYM)中均呈高表达,提示MMS21 在多种肿瘤中扮演促癌基因的角色。对于MMS21 在多种肿瘤中高表达的原因,我们推测可能有以下三个方面的因素:1、在DNA 水平,通过UALCAN(http://ualcan.path.uab.edu/)中的TCGA 数据库发现,相比于癌旁组织,在肝癌组织中MMS21 的启动子甲基化水平更低,提示MMS21 启动子的去甲基化与肝癌的发生发展密切相关;2、在转录水平,利用miRDB 数据库(http://www.mirdb.org/)预测MMS21 可能相互作用的microRNA,发现其可作为miR-3143,miR-498-5p,miR-302c-5p,miR-6798-3p,and miR-31-3p 等microRNA 的靶基因。Jing 等[9]发现在宫颈癌细胞中miR-31-3p显著下调,体外过表达miR-31-3p能够抑制宫颈癌细胞的恶性行为和EMT,提示我们microRNA 可能参与调控MMS21 的mRNA 表达水平;不过我们也不排除还有其他潜在的转录因子,在转录水平介导MMS21 的表达,我们后续将进一步实验研究证明;3、在蛋白水平,通过分析Co-IP联合质谱鉴定MMS21 的互作蛋白,我们发现MMS21 与去泛素化酶(DUB)家族中的USP5/33/37/53 有相互作用,这提示我们去泛素化酶也参与MMS21 的蛋白稳定性调节,对此我们将在接下来研究中深入探讨。Jacome 等[10]在转基因鼠的研究发现,MMS21 的单拷贝缺失可以增加淋巴瘤等肿瘤的发生率,而且这种作用并不依赖于其SUMO 化酶活性。Potts 等[11]报道,在骨肉瘤细胞中,MMS21参与形成的SMC5/6复合体能够调节端粒结合蛋白的SUMO 化修饰,介导端粒的同源修复和延长抑制肿瘤细胞的衰老。然而,Ni 等[12]发现,在乳腺癌MCF-7 细胞中,MMS21 参与细胞DNA 损伤修复和细胞有丝分裂进程导致细胞增殖受阻。因此,MMS21 在不同的研究模型或肿瘤中,可能通过不同的机制发挥着截然不同的作用。然而MMS21 在肝癌中的功能及作用机制目前尚未见报道。在本研究中,我们通过流式细胞术、BrdU、DNA Fiber 等多种方法检测了MMS21 对肝癌细胞增殖等影响。结果表明,当MMS21 缺陷时能够明显抑制肝癌的细胞周期进程,阻碍细胞由G1 向S 期的转换,从而使其阻滞在G1 期。MMS21 已被证明有助于DSB修复、暂停复制叉重启和HR 的端粒伸长[13]。当复制叉遇到阻力会导致复制叉停顿,DNA Fiber 技术已成为直接监测DNA 复制叉动力学的金标准[14]。DNA Fiber 分析结果表明,敲低MMS21 能阻碍复制叉的前进,抑制DNA合成速度,这提示MMS21与肝癌细胞复制叉进程有关。MMS21作为SMC5/6复合体的一员,在调节DNA 损伤修复过程中具有重要作用,而DNA 损伤与细胞周期的有序进行密切相关[15]。为了更直接的阐明MMS21 调节细胞周期的作用,我们通过Co-IP 联合质谱鉴定的方法检测了MMS21 的互作蛋白组。结果发现,MMS21 的互作蛋白主要与细胞周期相关通路有关。这提示我们,除了通过调节DNA 损伤修复间接促进细胞周期的正常进行,MMS21 还可以通过结合细胞周期相关蛋白直接调节细胞周期。为了证实这一猜想,我们检测了MMS21对细胞周期相关蛋白的调节作用,发现MMS21能够调控细胞周期相关蛋白的表达,敲低MMS21 能下调S 和G2 期周期蛋白Cyclin A2 和Cyclin B1的蛋白水平同时上调G1后期蛋白Cyclin E1水平,提示MMS21的缺陷导致细胞阻滞在G1期,抑制G1/S的转变。MCMs蛋白家族在所有真核生物中具有高度保守性[16]。既往研究将MCM 确定为DNA复制起始的核心参与者[17]。最近的研究表明,MCM 蛋白也在复制延长中起作用,可能作为DNA解旋酶[16]。MCMs 在整个细胞周期中组成性地定位于细胞核中,它们与染色质结合,受细胞周期蛋白调控[18-19],同时MCM 与扩展复制叉相关联,其动力学与DNA 合成因子相似,随着复制叉的扩展而移开[20-21]。我们在质谱蛋白互作数据中发现,MMS21 与MCM2/3/5/6 相互作用,同时敲低MMS21能下调MCM2-7 复合物内的几乎所有蛋白的稳定性。然而,MMS21 对其结合的细胞周期相关蛋白的调节是否依赖于其SUMO 化酶活性以及具体的调节靶蛋白是什么,以及MMS21 对于MCM2-7 复合物的稳定性调节具体机制,目前尚不清楚。我们将通过后续研究对此问题进行深入阐明。
综上所述,本研究证实MMS21 在肝癌中高表达,并促进肝癌细胞的生长,其机制为调控细胞周期蛋白和细胞周期蛋白依赖性激酶表达,同时影响MCM2-7 复合物的蛋白水平。这些数据表明MMS21 可能是肝癌诊治的潜在新靶标,为肝癌的诊断和治疗提供新思路。
