育肾助孕方对卵巢储备功能降低大鼠卵巢颗粒细胞ERK1/2、JNK1/2蛋白活化的影响
2022-04-12金毓莉杭远远唐苾芯
陈 琼,金毓莉,杭远远,徐 梅,唐苾芯
(1.上海交通大学附属第一人民医院,上海 200080;2.上海中医药大学附属岳阳中西医结合医院,上海 200437;3.上海市黄浦区中西医结合医院,上海 200010;4.上海市浦东新区公利医院,上海 200135)
卵巢储备功能是指卵泡在卵巢皮质中生长并形成可受精卵泡的能力,包括女性剩余卵母细胞的数量和质量[1]。育龄期女性随着年龄的增长,卵巢中募集的卵泡逐渐减少,卵子的质量也在下降,这一过程称为卵巢储备功能降低(Decreased ovarian reserve,DOR),预示着生育能力下降,在1~6年内有发展成为卵巢早衰(Premature ovarian failure,POF)的风险[2]。2004—2011年,美国DOR患病率从19%升高至26%[3]。DOR的主要症状包括40岁以前女性出现月经紊乱、闭经和不孕,并伴有围绝经期症状,如潮热、盗汗,与反复流产、不明原因的不孕、辅助生殖反复种植失败、先兆流产等生育问题密切相关。因此,有效治疗DOR对不孕夫妇和提高女性生活质量具有重要意义。
中医药基于“治未病”的思想上治疗DOR具有独特优势。蔡氏妇科育肾助孕方的临床疗效显著,前期研究证实,育肾助孕方可上调卵巢抗凋亡因子Bcl-2的表达,下调促凋亡因子Bax、Caspase-3的表达,从而抑制卵巢颗粒细胞凋亡[4],促进卵泡生长、分泌,起到改善卵巢储备功能的作用[5]。细胞凋亡指为维持细胞内环境平衡的一种程序性死亡。MAPK信号通路(包含ERK通路和JNK通路)与细胞分化、增殖和凋亡密切相关。有研究证实ERK和JNK信号通路在卵巢细胞凋亡中起关键作用,是Bcl-2、Bax、Caspase-3的上游激酶[6]。故本研究结合前期研究结果,以DOR大鼠模型为研究对象,观察育肾助孕方对卵巢组织中ERK1/2及JNK1/2蛋白活化的影响,探讨其作用机制,现将研究结果报告如下。
1 材料与方法
1.1 实验动物 选用健康清洁级雌性SD大鼠,12周龄,48只,体重250~280 g,上海斯莱克实验动物责任有限公司提供,许可证号:SYXK(沪)2009-0086,检疫合格备用。大鼠饲养在上海市第一人民医院清洁级实验动物中心,室内保持恒定温度、湿度,相对湿度为40%~60%。
1.2 实验药物及制备 雷公藤多苷片:10 mg/片,江苏美通制药有限公司(批号:131029),以纯净水溶化,配制浓度为5 mg/ml。戊酸雌二醇片(补佳乐):1 mg/片,用纯净水溶化,配制浓度为0.05 mg/ml。育肾助孕方免煎颗粒剂(由广州一方中药厂提供):白茯苓12 g,熟地、山萸肉、淫羊藿、巴戟天、肉苁蓉、鹿角霜、醋龟板各10 g,上述药物等量免煎颗粒剂剂量为:熟地2.5 g,白茯苓0.6 g,山萸肉、巴戟天各3 g,淫羊藿、鹿角霜各0.5 g,肉苁蓉2.5 g,醋龟板0.7 g,纯净水配制成低、中、高3个浓度混悬液,4 ℃冰箱中储存备用,灌胃前摇匀。
1.3 主要试剂与仪器 p-ERK抗体,美国CST公司(批号:4370S);ERK抗体,美国CST公司(批号:4376S);p-JNK抗体,美国CST公司(批号:4668);JNK抗体,美国CST公司(批号:9252);GAPDH抗体,美国CST公司(批号:5174);羊抗兔HRP标记二抗,上海碧云天生物技术有限公司(批号:A0208);羊抗鼠HRP标记二抗,上海碧云天生物技术有限公司(批号:A0216);RIPA组织细胞快速裂解液,上海基尔顿生物有限公司(批号:BYL40825);BCA蛋白定量试剂盒,美国Thermo Scientific公司(批号:PICPI23223);NC膜,美国millipore公司(批号:HATF00010);蛋白预染Marker,加拿大Fermentas公司(批号:SM1811);发光液,美国Millipore公司(批号:WBKLS0100);mini protean 3 cell电泳仪(美国Bio-Rad公司);PS-9型电转仪(大连竞迈科技有限公司);MK3型酶标仪(芬兰雷勃公司);CX41型正置显微镜(OLYMPUS公司)。
1.4 分组及给药 将48只SD大鼠适应性喂养1周后,按照随机数字表法分为六组:对照组,模型组,补佳乐组,育肾助孕方低、中、高剂量组,每组8只。每组连续2周上午及下午各灌胃1次。对照组:每日2次灌胃3 ml 0.9%氯化钠水溶液;模型组:雷公藤多苷造模剂量按照50.00 mg/kg体积灌胃,雷公藤多苷溶液及0.9%氯化钠水溶液各1次;补佳乐组:补佳乐按照0.21 mg/kg体积灌胃,雷公藤多苷溶液及补佳乐溶液各1次;育肾助孕方低、中、高剂量组按照临床等效剂量的0.5倍(0.69 g/kg)、1倍(1.38 g/kg)和2倍(2.76 g/kg)给药,每次灌胃前摇匀,每组雷公藤多苷溶液及各浓度育肾助孕方中药溶液各1次。以上给药剂量均根据“人和动物体表面积折算的等效剂量比率表”计算出药液体积稀释为3 ml。
1.5 观察指标与检测方法
1.5.1 取材:大鼠处死后在无菌条件下取出卵巢,称重,部分卵巢福尔马林固定,部分卵巢置于-80 ℃冰箱待用。
1.5.2 卵巢组织形态观察:卵巢置于福尔马林中固定48 h,梯度酒精脱水,石蜡包埋切片,片厚4 μm,常规HE染色,置于显微镜下观察卵泡、黄体及颗粒细胞等变化。
1.5.3 Western blot法检测卵巢组织ERK1/2、p-ERK1/2、JNK1/2及p-JNK1/2蛋白表达:将卵巢组织剪成细小的碎片,按每20 mg组织加入150~250 μl裂解液(裂解液中加入蛋白酶和磷酸酶抑制剂),匀浆器匀浆直至完全裂解,离心15 min,取上清,进行蛋白质定量后贮存于-80 ℃冰箱。用BCA试剂盒检测蛋白含量。按实验常规上样、电泳、转膜后,加入5%脱脂奶粉室温封闭1 h,然后加入一抗(ERK1/2 1∶1000稀释,p-ERK1/2 1∶1000稀释,p-JNK1/2 1∶800稀释,JNK1/2 1∶1000稀释,GAPDH 1∶1500稀释),4 ℃过夜孵育;之后加入二抗,与膜37 ℃孵育1 h。ECL化学发光法显影。胶片扫描后获得图像,计算目的蛋白条带与内参GAPDH蛋白条带的灰度比值。
1.6 统计学方法 采用SPSS 18.0统计学软件进行数据分析,计量资料以均数±标准差表示,所有统计图采用Graph Pad Prism软件绘制。组间比较用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 卵巢组织病理观察结果 对照组卵巢结构清晰,可见生长卵泡数量、形态正常,颗粒细胞多层排列整齐,卵泡液含量多,可见发育好、体积大的黄体;模型组见部分卵巢萎缩,生长卵泡数量减少、闭锁卵泡数量增多,颗粒细胞排卵紊乱且层数减少,黄体数减少、体积减小;补佳乐组卵巢组织形态与对照组相近,可见生长卵泡,但闭锁卵泡较对照组多;育肾助孕方低剂量组较模型组卵巢组织形态有所改善,卵泡数量比对照组少,黄体数目也比对照组少;育肾助孕方中、高剂量组卵巢形态与对照组相似,卵泡结构清晰,颗粒细胞多层次,卵泡数目及黄体数目较模型组增多(图1)。

图1 各组大鼠卵巢组织形态比较(HE染色,×400)
2.2 各组大鼠卵巢组织ERK1/2蛋白总相对表达量及磷酸化水平比较 与对照组比较,模型组、补佳乐组和育肾助孕方低、中、高剂量组大鼠卵巢组织ERK1/2蛋白总相对表达量比较均无统计学差异(P>0.05);与对照组比较,模型组和育肾助孕方低、中剂量组大鼠卵巢组织ERK1/2蛋白磷酸化水平明显增加(P<0.05),补佳乐组和育肾助孕方高剂量组大鼠卵巢组织ERK1/2蛋白磷酸化水平比较均无统计学差异(P>0.05);与模型组比较,补佳乐组和育肾助孕方低、中、高剂量组大鼠卵巢组织ERK1/2蛋白磷酸化水平明显降低(P<0.05);与补佳乐组比较,育肾助孕方低、中、高剂量组大鼠卵巢组织ERK1/2蛋白磷酸化水平比较无统计学差异(P>0.05)。见表1(图2、3)。

注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与补佳乐组比较,△P<0.05图2 各组大鼠卵巢组织ERK1/2蛋白总相对表达量及磷酸化水平比较
2.3 各组大鼠卵巢组织JNK1/2蛋白总相对表达量及磷酸化水平比较 与对照组比较,模型组、补佳乐组和育肾助孕方低、中、高剂量组大鼠卵巢组织JNK蛋白总相对表达量比较差异均无统计学意义(P>0.05);与对照组比较,模型组和育肾助孕方低剂量组大鼠卵巢组织JNK1/2蛋白磷酸化水平明显增加(P<0.05),补佳乐组和育肾助孕方中、高剂量组大鼠卵巢组织JNK1/2蛋白磷酸化水平比较差异均无统计学意义(P>0.05);与模型组比较,补佳乐组和育肾助孕方低、中、高剂量组大鼠卵巢组织JNK1/2蛋白磷酸化水平明显降低(P<0.05);与补佳乐组比较,育肾助孕方中、高剂量组大鼠卵巢组织JNK1/2蛋白磷酸化水平差异均无统计学意义(P>0.05),低剂量育肾助孕方组大鼠卵巢组织JNK1/2蛋白磷酸化水平明显高于补佳乐组(P<0.05)。见表1(图3、4)。

表1 各组大鼠卵巢组织ERK1/2和JNK1/2蛋白总相对表达量及磷酸化水平比较

A:对照组;B:模型组;C:补佳乐组;D:育肾助孕方低剂量组;E:育肾助孕方中剂量组;F:育肾助孕方高剂量组图3 各组大鼠卵巢组织p-ERK1/2、ERK1/2、p-JNK1/2、JNK1/2蛋白表达情况
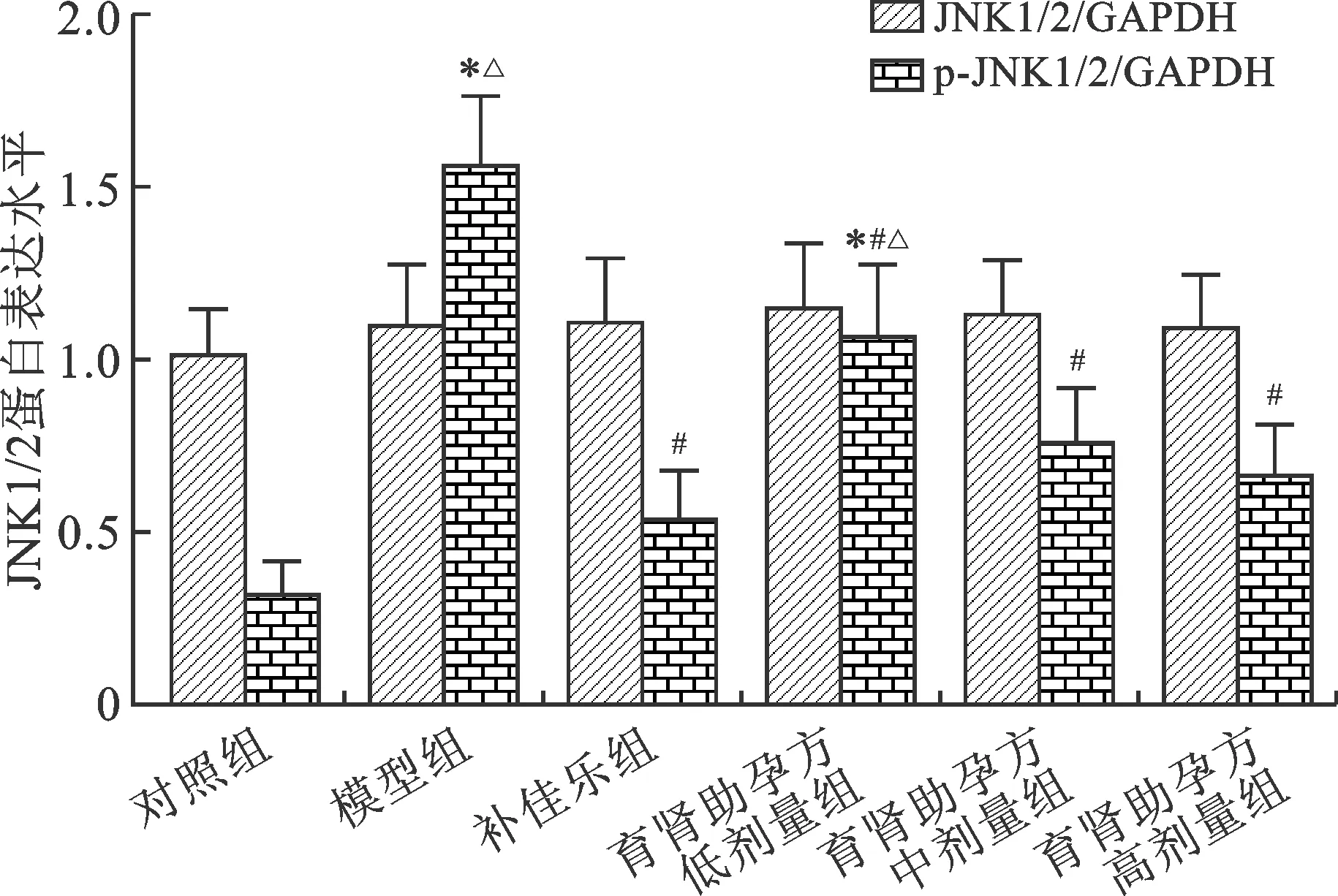
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与补佳乐组比较,△P<0.05图4 各组大鼠卵巢组织JNK1/2蛋白总相对表达量及磷酸化水平比较
3 讨 论
DOR是常见的女性生殖内分泌疾病。现代研究发现DOR发病常与年龄增长、遗传因素、自身免疫因素、盆腔因素、环境污染、不良生活方式、精神压力等有关[7]。
中医学中无DOR,根据其临床症状可归于“闭经”“月经后期”“断经前后诸证”“不孕”等疾病中。生育能力是指在1个月经周期内受孕的概率,其在30岁初即开始显著下降,几年后(约37岁)下降得更快[8]。随着国家二胎政策进一步开放和初产妇平均年龄逐渐升高,年龄越大,生育力越低,越来越多的高龄女性不得不面对不孕症。据统计,35岁以下的不孕患者中DOR发病率约6.3%[9]。DOR是POF的早期阶段,临床表现无特异性,需要结合检查如:抗苗勒管激素(AMH)下降、促卵泡刺激素(FSH)升高、雌二醇(E2)下降、FSH/LH升高、超声下见卵巢体积缩小等。因此,若40岁之前的女性出现了经量减少、月经稀发、崩漏甚至闭经、围绝经期表现时,应及时明确诊断,做到未病先防,已病防变,早发现早干预DOR。
雷公藤属于细胞毒性药物,具有生殖毒性。本研究中,模型组见部分卵巢萎缩,生长卵泡数目减少,颗粒细胞减少和黄体减少,各级卵泡数目减少,提示雷公藤多苷灌胃可致大鼠的卵巢功能降低,进而卵巢萎缩,该结果与杜清等[10]的结果一致。说明雷公藤多苷能够明显降低大鼠的卵巢储备功能、减少卵泡数量。有研究发现,氟化钠可通过促进p-ERK及p-JNK活化,降低Bcl-2表达,增加Bax表达,触发Caspase级联反应诱导卵巢细胞凋亡[6]。雷公藤多甙片[11]可能通过ERK、JNK信号通路诱导卵巢组织中线粒体和死亡受体凋亡途径发生过度激活,造成细胞凋亡,抑制卵泡生长,引发卵巢功能损伤。雷公藤甲素可通过引起ERK/c-fos异常表达导致卵巢细胞凋亡[12]。JNK促进促凋亡蛋白Bax在激活时移位到线粒体,从而激活细胞凋亡[13]。本研究结果显示模型组大鼠的p-ERK1/2及p-JNK1/2蛋白表达较对照组明显升高,结合前期研究结果[4]提示雷公藤多苷可能通过促进p-ERK1/2及p-JNK1/2活化,调节细胞凋亡相关因子Bcl-2、Bax、Caspase-3的表达,从而诱导DOR的发生。
蔡小荪教授治疗不孕基于《傅青主女科》云:“经水出诸肾”“经水早断,似乎肾水衰涸”以补肾为基本法则创制育肾助孕方,临床亦以补益肝肾,培元育孕为治疗DOR的主要思路,育肾助孕方从六味地黄丸化裁,仅用其半,熟地、茯苓、山萸肉补脾肾和中,养血滋阴;淫羊藿、巴戟天、肉苁蓉温肾兴阳;鹿角霜补肾强督,调理冲任,性较温和;醋龟板滋阴潜阳,补肾益精,制约诸温阳药之温燥,以使阴阳平衡而相得益彰。《医学正传》曰:“月经全借肾水施化,肾水既乏,则经血日以干涸”,故临床医家多认为DOR的主要病机在肾虚,补肾填精为治疗大法[14-16]。育肾助孕方中用以大量补肾药,在补肾的同时注意顾护脾气,后天源源不断生化精微,涵育先天,重振根基,从而为孕育夯实基础。近年来多项研究表明:补肾中药能抑制卵巢颗粒细胞凋亡[17];干预氧化应激过程,延缓端粒衰老速度,保护卵母细胞,延缓卵巢组织衰老[18];补肾中药能作用于性激素、内分泌、免疫、细胞增殖等多个通路,其中补肾阳中药在卵细胞成熟相关通路存在作用靶点[19-20],达到从多途径、多阶段、多靶点改善DOR患者的临床症状、内分泌指标以及妊娠结局的治疗目的。该研究结果显示,补佳乐和育肾助孕方各组卵巢组织形态、卵泡生长和颗粒细胞排列等较模型组改善,提示药物治疗后可能对卵巢功能有所改善,中药浓度升高可能与改善程度正相关。补佳乐组、育肾助孕方高剂量组p-ERK1/2及p-JNK1/2表达均与对照组比较无统计学差异。育肾助孕方各组p-ERK1/2及育肾助孕方中、高剂量组p-JNK1/2蛋白表达与补佳乐组比较无统计学差异,且均明显低于模型组。提示育肾助孕方可能通过降低p-ERK1/2、p-JNK1/2蛋白活化,减少卵巢颗粒细胞凋亡,抑制卵巢组织萎缩,改善DOR大鼠卵巢功能,减缓衰退进程,且育肾助孕方对卵巢功能的改善效果与其药物浓度有关。
