基于基因分析的产胞外多糖乳酸菌的筛选及其体外抗氧化研究
2022-04-11吕青遥雷霜江包善思陈文文陈怡均焦士蓉
吕青遥,雷霜江,包善思,陈文文,陈怡均,焦士蓉
(西华大学 食品与生物工程学院,成都 610039)
0 引言
乳酸菌(LAB,lactic acid bacteria)是一类通过发酵糖类物质产生乳酸的无芽孢革兰氏阳性菌的总称,至少含有23个菌属,共200余种[1]。乳酸菌作为一种重要的益生菌,可以净化肠内环境,调节人体胃肠道健康及微生态环境平衡[2]。乳杆菌属、双歧杆菌属的某些菌株被证实具有提高免疫力、降血压、抗氧化、改善肠道菌群等生理功能[3-4]。乳酸菌胞外多糖(Exopolysaccharide,EPS)是指乳酸菌在培养基中发酵产生的一类结构复杂的糖类化合物[5]。LAB EPS一般包括释放到培养基中的黏液多糖(slime polysaccharide,SPS)和附着在细胞壁的荚膜多糖(capsular polysaccharides,CPS)[6]。LAB产生的EPS按组成可分为由同一种单糖组成的同多糖 和由两种或两种以上单糖组成的杂多糖[7]。在生理功能上,胞外多糖具有良好的抗肿瘤[8-9]、增强免疫抵抗力[10-11]和抗氧化[12]等活性。在物化特性上,EPS能改善发酵乳制品的质地、组织状态、风味和感官[13],对豆制品的流变性、乳化性、黏着性都有显著影响,极大地提高了其质构、凝胶和流变性能[14]。
本研究以实验室保藏的15株乳酸菌为筛选源,测定他们的产胞外多糖能力,并对其所产胞外多糖的体外抗氧化活性进行研究,综合两方面选出优势菌进行全基因组序列分析,为进一步高通量筛选高产EPS菌株和构建基因工程菌提供前期的实验基础。
1 材料与方法
1.1 实验材料
本实验所用菌株是从以四川传统泡菜、鱼肠道、微生物药剂为筛选源,选出降胆固醇能力>30%且具有耐酸耐胆盐能力的15株乳酸菌。
核酸染料,生工生物工程(上海)股份有限公司;细菌DNA提取试剂盒,成都福际生物技术有限公司;琼脂糖,生工生物工程(上海)股份有限公司;其余试剂均为分析纯。
1.2 实验仪器
SPX-150B-Z生化培养箱,上海博迅实业有限公司医疗设备厂;WFJ7200分光光度计,尤尼柯(上海)仪器有限公司;Easycycle Gradient 96梯度PCR仪、BDA Box 2凝胶成像系统,Analytikjena;DYY-8C双定时电泳仪,北京市六一仪器厂。
1.3 培养基
MRS培养基(1 000 mL):蛋白胨10 g,牛肉膏10 g,酵母粉5 g,柠檬酸氢二铵2 g,葡萄糖20 g,吐温(-80)1 mL,乙酸钠5 g,磷酸氢二钾2 g,硫酸镁0.58 g,硫酸锰0.25 g,琼脂15~20 g,灭菌后使用。
1.4 实验方法
1.4.1 乳酸菌胞外多糖的提取
参考李仪琳等的实验方法并做适量改动[15]。将供试乳酸菌活化后接种到胞外多糖MRS液体筛选培养基中,37℃静置培养48 h,取10 mL培养液于试管中,加入1/3体积的Sevag试剂(氯仿∶正丁醇=4∶1),震荡30 min后,4 000 r/min离心15 min,收集上层水相溶液,重复以上操作至两相之间无蛋白质层为止。随后加入3倍体积的冰冻无水乙醇,放置在4℃冰箱中冷藏。第2天取出,最终可以观测到多糖呈乳白色絮状沉淀析出,再于4℃、6 000 g下离心30 min,用10 mL蒸馏水溶解沉淀,可得胞外多糖提取液,胞外多糖粗提液冷冻干燥的胞外粗多糖。
1.4.2 胞外多糖含量的测定
采用苯酚-硫酸法进行测定,参照陶静的做法[16]。EPS质量浓度由标准曲线的回归方程和稀释倍数换算出。
1.4.3 EPS对DPPH自由基的清除作用
参考丁武荣等的实验方法并做适量改动,用去离子水和DPPH溶液作为对照[17]。用样品和无水乙醇作为空白。测定517 nm处的吸光度,每组至少3个重复。以Trolox为标准品绘制标准曲线,得到标准曲线回归方程为Y=0.5673X+9.0774,R2=0.9946。根据标准曲线计算出样品提取液的EPS含量,以每g提取物中Trolox当量计(mg/g)。
DPPH清除率(%)=[1-(A样品-A空白)/A对照]×100
式中:A样品为样品溶液与DPPH反应的吸光度;A空白为无水乙醇代替DPPH的吸光度;A对照为无水乙醇代替样品溶液及蒸馏水的吸光度。
1.4.4 EPS对ABTS自由基的清除作用
参考刘城移等的实验方法[18]。以Trolox为标准品绘制标准曲线,得到标准曲线回归方程为Y=0.6058X-0.8838,R2=0.9966。根据标准曲线计算出样品提取液的EPS含量,以每g提取物中Trolox当量计(mg/g)。
ABTS自由基清除率(%)=[1-(A样品-A对照)/A空白]×100
式中,A样品为不同浓度的样品与ABTS+工作液反应的吸光度;A对照为去离子水代替ABTS+工作液反应的吸光度;A空白为去离子水代替样品组的吸光度。
1.4.5 EPS的ORAC实验
参考Mu G等的实验方法并做适量改动[19],向96孔板各孔加入20μL不同浓度Trolox标准品溶液(或样品),以缓冲液代替样品或标品为阳性对照(+APPH),以及随后每孔加入4.0 nmol/L 20μL FL荧光试剂,37℃孵育20 min。测定时加入140μL 12.8 mmol/LAAPH溶液启动反应,用缓冲液替代APPH为阴性对照(-APPH)将96孔板置于预热至37℃酶标仪中5 min。
以激发波长(485±20)nm,发射波长(530±20)nm进行连续测定荧光强度,测定时间设定在荧光衰减呈基线后为止,约60次循环(2 h)。
试验所得的各微孔不同时间点的绝对荧光强度数据与其初始时间的荧光强度相比,折算成相对荧光强度f,以相对荧光强度采用近似积分法计算荧光衰退曲线下面积(AUC)。
AUC=0.5×[2×(f0+f1+…+fn-1+fn)-f0-fn]×△t,其中fn标示第n个测定点的相对荧光强度,△t标示相邻两个时间点之间的时间间隔(即2 min),则上述公式可简化为:AUC=2×(f0+f1+…+fn-1+fn)-f0-fn。
ORAC值=[(AUC样品-AUC空白)/(AUCTrolox-AUC空白)]×(Trolox浓度(μmol/L)/样品浓度(g/L))
式中:AUC样品为样品作用下的各微孔荧光衰退曲线下面积;AUCTrolox为水溶性维生素E作用下的荧光衰退曲线下面积;AUC空白为仅有AAPH作用下的荧光衰退曲线下面积;Trolox浓度为标准品水溶性维生素E的浓度,μmol/L。
每组实验至少3个重复,以Trolox为标准品绘制标准曲线,得到标准曲线回归方程为Y=0.6741X+13.284,R2=0.9971。根据标准曲线计算出样品提取液的EPS含量,以每g提取物中Trolox当量计(mg/g)。
1.4.6 EPS的FRAP实验
参考梅邢等的实验方法并做适量改动[20],将300 mmol/L,pH=3.6的醋酸缓冲液、10 mmol/L TPTZ溶液、20 mmol/L三氯化铁溶液以10∶1∶1配置成FRAP工作液,在96孔板中加入50μL 1g/L的胞外粗多糖水溶液和150μL FRAP工作液为样品组,以蒸馏水代替样品为对照组,室温下放置20 min,在593 nm处测吸光度,每组至少3个重复。以Trolox为标准品绘制标准曲线,得到标准曲线回归方程为Y=0.0054X+0.127,R2=0.9984。根据标准曲线计算出样品提取液的EPS含量,以每g提取物中Trolox当量计(mg/g)。
1.4.7 生理生化试验
对乳酸菌进行过氧化氢酶试验、葡萄糖发酵试验、淀粉水解试验、葡萄糖产气试验、pH=4.0、pH=9.0、15℃、45℃生长试验、耐盐性试验、甲基红试验、v-p乙酰甲基甲醇试验、酪素水解试验。参考蒲博等的实验方法并做适量改动[21]。
1.4.8 16S rRNA基因鉴定及系统发育树的构建
参考Zhang等人方法[22],综合胞外多糖产率及其抗氧化活性,选出产EPS能力较高,EPS抗氧化活性强的11株乳酸菌进行鉴定。鉴定过程主要包括细菌基因组DNA的提取,PCR的扩增,PCR产物的回收,序列的测定与回收。得到序列结果后在NCBI数据库中进行比对,并用MEGA5软件构建系统发育树。
1.4.9 R5全基因组测序分析
将活化后的R5菌体送至上海美吉生物医药科技有限公司进行全基因组测序。
1.5 数据分析
采用Excel 2010分析处理数据,所有数据均重复3次试验所得,并计算平均值和标准误差,并绘制图表;采用SPSS 18.0软件对数据进行差异显著性分析。
2 实验结果
2.1 乳酸菌EPS产量
乳酸菌产胞外多糖的结果,如表1所示。
表1 乳酸菌胞外粗多糖产量(±s,n=3)

表1 乳酸菌胞外粗多糖产量(±s,n=3)
?
15株乳酸菌均有一定的产胞外多糖能力,胞外多糖产量在374.19~710.73 mg/L之间,产量低于400 mg/L的有1株,400~500 mg/L的有3株,500~600 mg/L的有6株,大于600 mg/L的有5株,分别为R4、R5、R27、R28、R40,其中R38产量最低为374.19±9.30 mg/L,R40产量产量最高达710.73±23.25 mg/L。
2.2 乳酸菌EPS抗氧化实验结果
乳酸菌EPS的抗氧化结果如表2所示,实验结果表明,不同菌株胞外多糖对DPPH自由基清除能力差异显著(P<0.05),其中R4清除DPPH自由基的清除能力最强,达到19.89±0.54 mg/g Trolox当量。不同菌株胞外多糖对ABTS自由基清除能力差异显著(P<0.05),其中R47清除ABTS自由基的清除能力最强,达到190.77±9.53 mg/g Trolox当量。不同菌株胞外多糖ORAC氧化自由基吸收能力差异显著(P<0.05),其中R39氧化自由基吸收能力最强,达到101.40±4.20 mg/g Trolox当量。不同菌株胞外多糖FRAP铁还原能力差异显著(P<0.05),其中R5铁还原能力最强,达到7.65±0.64 mg/g Trolox当量。从4种不同抗氧化实验中可以看出,同一种菌株胞外多糖在不同的抗氧化实验中,差异显著(P<0.05),乳酸菌胞外多糖的抗氧化在几组实验中ABTS体系>ORAC体系>DPPH体系>FRAP体系,表明乳酸菌胞外多糖对于ABTS自由基的清除率最高,而铁原子还原能力较低。

表2 乳酸菌抗氧化活性实验结果(x-±s,n=3)
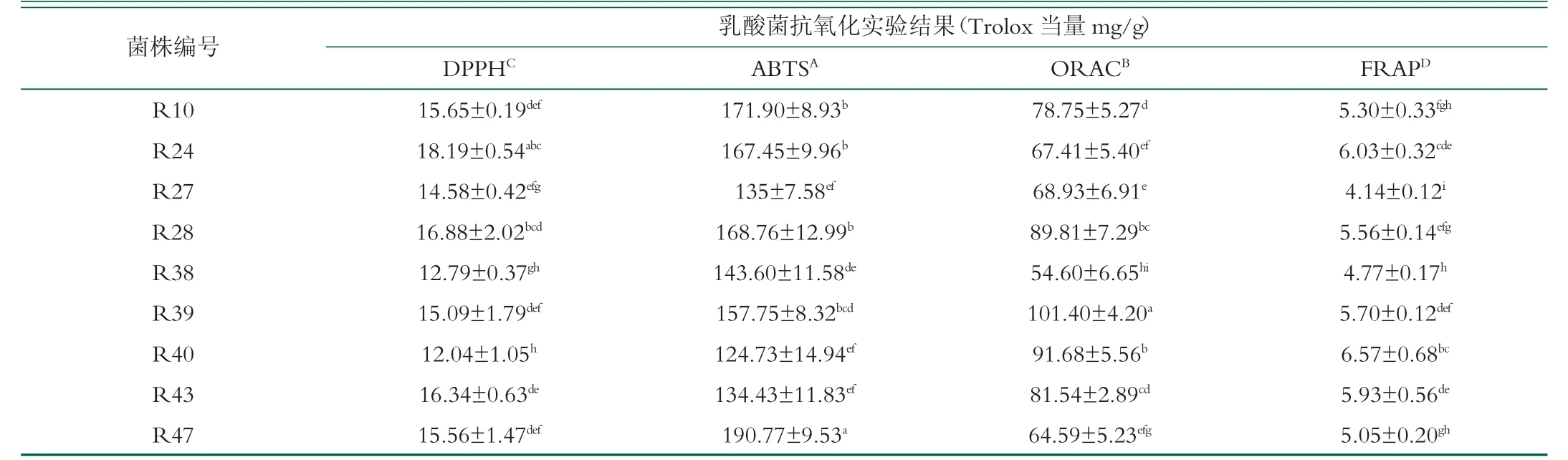
(续表2)
2.3 生理生化实验结果
综合生理生化试验结果,根据《常见细菌系统鉴定手册》及《伯杰氏细菌鉴定手册》,我们可对15株乳酸菌的大致分类做如下判断,其中C28、C60、J3、R5、R8、R10、R24、R27、R28、R38、R39、R43、R47属于乳杆菌属,R4、R40属于肠球菌属。

表3 生理生化实验结果
2.4 16S rRNA序列法分析鉴定
综合胞外多糖产率及其抗氧化活性,选出产EPS能力较高,EPS抗氧化活性强的11株乳酸菌进行16S rRNA序列法分析测定,凝胶成像结果如图1所示。
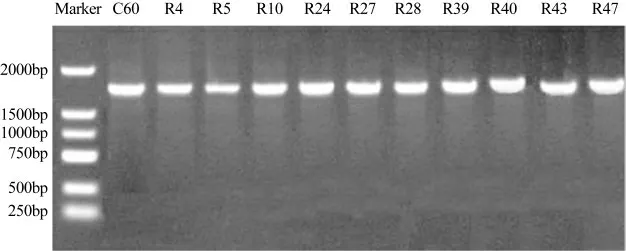
图1 琼脂糖凝胶电泳图
由图1可知,11株菌的16S rRNA PCR产物长度为1.5Kbp,将测序结果进行BLAST在线分析,结果表明,9株菌为鼠李糖乳杆菌(Lactobacillus rhamnosu 2717),R4、R40两株菌为屎肠球菌(Enterococcus faecium 6583),基因测序结果与生理生化试验结果吻合,11株菌的系统发育树如图2所示。
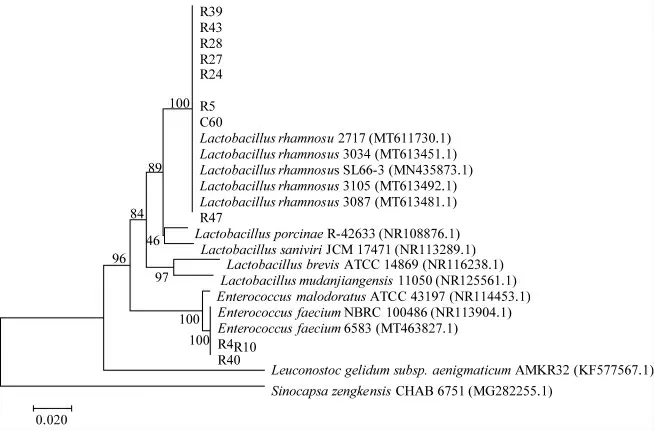
图2 系统发育树图
2.5 鼠李糖乳杆菌R5基因组中产EPS基因簇分析
全面综合比较后,因R5产多糖量和抗氧化活性均较高,所以选R5进行后续深入研究。通过将鼠李糖乳杆菌R5基因序列与NCBI上与产EPS有关的相关基因序列进行比对,发现R5基因序列中与EPS产生有关的基因都在Scaffold2上,比对结果如表4所示。从表4中看出,Identity>98%,表明R5基因序列与相关基因序列一致性高。R5与相关基因Evalue值为0,可信。因此可以说明鼠李糖乳杆菌R5基因中有19个与EPS产生相关的基因,产EPS相关基因在R5基因序列中的查询情况见表5。在这些产EPS相关基因中,gene0524、0531、0533、0534、0536是编码糖基转移酶的基因,糖基转移酶基因的存在与EPS重复单元结构之间存在高度相关,可用于今后筛选新的鼠李糖菌株[22-23]通过对比发现,R5所产的多糖为荚膜类多糖。
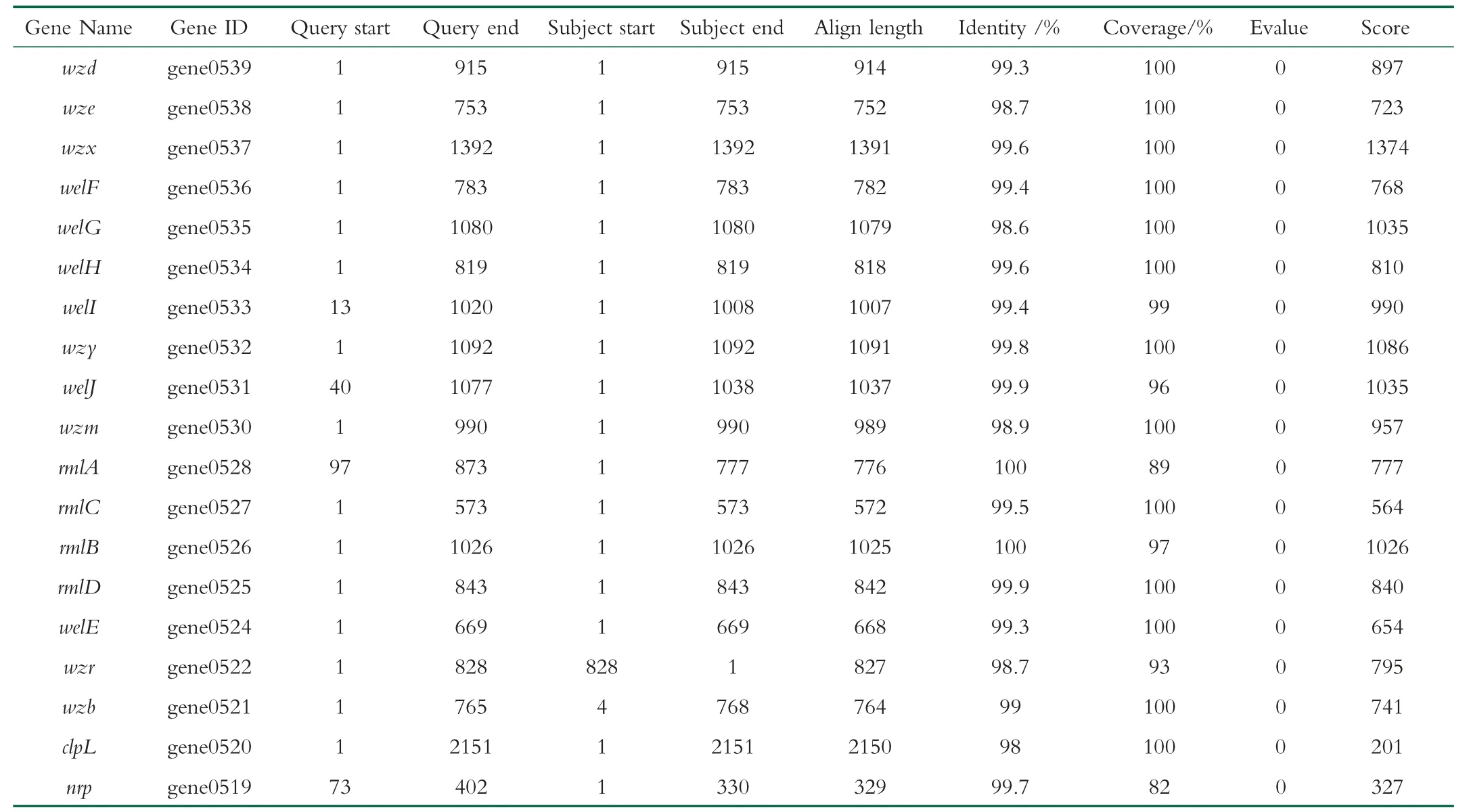
表4 R5基因序列比对结果

表5 产EPS相关基因在R5基因组中的查询结果

(续表5)

图3 R5基因序列中产EPS相关基因组图谱
3 结论
15株乳酸菌均有一定的产胞外多糖能力,胞外多糖产量在374.19~710.73 mg/L之间。综合产EPS能力和所产EPS的抗氧化能力结果,R5 EPS产量较高678.01±17.44 mg/L,且R5的EPS在几种抗氧化体系中能力都较强,其中在DPPH体系中为18.58±0.65 mg/g Trolox当量,在ABTS体系中为163.78±7.64 mg/g Trolox当量,在ORAC体系中为68.38±7.19 mg/g Trolox当量,在FRAP体系中为7.65±0.64 mg/g Trolox当量。因此选择R5进行后序实验。
对鼠李糖乳杆菌R5进行全基因组测序,得到原始数据的总碱基数为1164790444(bp),对原始数据进行过滤,得到质控后的总碱基数为1143095840(bp)。通过将鼠李糖乳杆菌R5基因序列与NCBI上与产EPS有关的相关基因序列进行比对得知,其所产多糖为荚膜类多糖。在鼠李糖乳杆菌R5基因序列中,找到了19个产EPS相关基因。为进一步高通量筛选高产EPS菌株和构建基因工程菌提供前期的实验基础。
