3株具有抑菌活性的Lactobacillus plantarum在玉米青贮中的应用研究
2022-04-11霍瑞周亭亭赵景娜王昊乾陈永福
霍瑞,周亭亭,赵景娜,王昊乾,陈永福
(内蒙古农业大学乳品生物技术与工程教育部重点实验室农业农村部奶制品加工重点实验室呼和浩特010018)
0 引言
为了提高青贮的发酵品质,减少有害菌生长,通常会在其发酵过程添加青贮发酵剂[1]。乳酸菌种属、数量和活性都对饲料的品质起到至关重要的作用[2]。同型发酵乳酸菌可产大量的乳酸,降低pH,抑制细菌增殖;而异型发酵乳酸菌能产生乙酸等有机酸来抑制真菌的生长[3]。L.plantarum是同型乳酸菌,具有生长迅速和产酸能力强的特性,然而关于玉米青贮中添加L.plantarum的报道鲜少:Contreras-Govea等[4]研究发现,L.plantarum能提高全株玉米青贮蛋白质含量;L.plantarum与L.buchneri混合添加提高牧草有氧暴露稳定性[5];对玉米[6]和高粱[7]青贮也有积极作用。
本实验室以L.plantarum IMAU80162、IMAU10585和IMAU20013为研究对象,评价单菌和复合发酵对全株玉米青贮发酵期、有氧暴露期的活菌数和发酵品质的影响,为菌株在青贮应用提供重要研究基础。
1 材料与方法
1.1 菌种和青贮来源
供试乳酸菌包括L.plantarum IMAU80162、IMAU10585和IMAU20013均由内蒙古农业大学乳品生物技术与工程教育部重点实验室保藏和提供。
全株玉米于秋季在呼和浩特市郊区收割,其水分含量为65%~75%,并剪成1.5×1.5×1.5 cm的小块备用。
1.2 试剂与仪器
MRS固体培养基、孟加拉红培养基(酵母菌和霉菌),广东环凯微生物科技有限公司;结晶紫中性红胆盐琼脂培养基,上海致化化学科技有限公司;活性炭,国药集团化学试剂科技有限公司;葡萄糖,天津风船;硫酸铜,天津市永大化学试剂有限公司;硫酸钾,天津市北方天医化学试剂厂;色谱柱BEHC18(2.1×100 mm,1.7μm),waters Waters公司;可变波长检测器(VWD);UV-1700分光光度计;自动化凯氏定氮仪,上海晟声自动化分析仪器有限公司。
1.3 玉米青贮的调制
试验设置5组分别为:①空白对照组;②添加IMAU80162组;③添加IMAU10585组;④添加IMAU20013组;⑤IMAU80162、IMAU10585和IMAU20013等比例添加组。将L.plantarum以1×105cfu/g的接种总量喷洒至全株玉米小块,混合均匀后以每袋200 g分装在锡箔纸袋并进行真空塑封,25℃发酵贮藏。贮藏0、3、42天时随机取3袋样品测定相应指标,第42d将剩余样品进行有氧暴露,并置于25℃培养箱,检测青贮温度变化,升高2℃时取样测定相应指标。
1.4 微生物指标的测定
将20 g玉米青贮加到含有80 g无菌生理盐水的三角瓶中,摇床150 rmp/min摇动30 min,取0.5 mL上清液,稀释到适合的梯度对乳酸菌、酵母菌,霉菌和大肠杆菌活菌计数,对应的培养基分别为MRS固体培养基、孟加拉红培养基(酵母菌和霉菌)和结晶紫中性红胆盐琼脂培养基。之后将样品放置到搅拌机中,高速搅拌30 s,然后4层纱布过滤得匀浆,留样备用。
1.5 发酵品质的测定方法
1.5.1 干物质
本实验采用的是微波炉法[9]。称取10 g玉米青贮放置于微波炉的塑料盘中,在高功率(600 W)条件下加热1.5 min,称重,重复上述操作直至前后两次称重相差小于0.01 g。
1.5.2 pH值及有机酸
取1.3中青贮匀浆10 mL,测定其pH值。之后将匀浆12 000 g离心15 min取上清液,过0.22μ滤膜,上机测试。
标准溶液的配制:准确称取乳酸、乙酸对照品各3.0000 g,先在烧杯中溶解后,转移到100 mL棕色容量瓶中,加超纯水定量至刻度,分别得到30 mg/mL的储备液。根据需要稀释成系列标准溶液。
HPLC分析条件[10]:色谱柱:BEH C18(2.1×100 mm,1.7μm.;检测器:可变波长检测器(VWD);流速:0.4 mL/min;柱温:45℃;进样量:4μL;流动相A:水(millipore)+0.1%甲酸,流动相B:乙腈(fisher,optimicalLCMS级别,Fisher公司)+0.1%甲酸;梯度洗脱(B%):0 min(20%)-2 min(50%)-2.1 min(95%)-3 min(95%)-3.1 min(20%)-5 min(20%)。
1.5.3 可溶性碳水化合物
本实验采用的是蒽酮硫酸法[11]。取含有4 mL的蒽酮溶液的试管(15×2.5 cm),冰上预冷10 min,将经活性炭脱色后的提取液1 mL快速加到上述试管中,振荡10 s,再放置到冰上;所有反应液加完后,将反应试管置于沸水浴10 min,随后在冰上静置5 min;分光光度计(UV-1700)测定分光光度值,配制浓度分别为0.1、0.075、0.05、0.025和0 mg/mL的葡萄糖溶液重复上述操作,做标准曲线。
1.5.4 粗蛋白含量及氨态氮
准确称取玉米青贮1±0.0002 g,送至蒸馏瓶底部,加入0.2 g硫酸铜,3.5 g硫酸钾,10 mL浓硫酸和2颗玻璃珠,放入消化炉,240℃加热60 min之后,升温到400℃继续加热至液体呈透明蓝绿色,最后用自动化凯氏定氮仪进行蒸馏、滴定[12]。
1.6 统计分析
采用SPSS18.0和Excel软件对试验数据进行统计分析。
2 结果与分析
2.1 全株玉米原料微生物及品质检测
青贮前检测原料中的乳酸菌、酵母菌、霉菌、大肠杆菌、干物质、粗蛋白、氨态氮、可溶性碳水化合物、pH值和有机酸。结果见表1,玉米原料微生物菌群丰富,可溶性碳水化合物和粗蛋白的含量适中,pH值为4.85,适合各种有益、有害菌的生长。
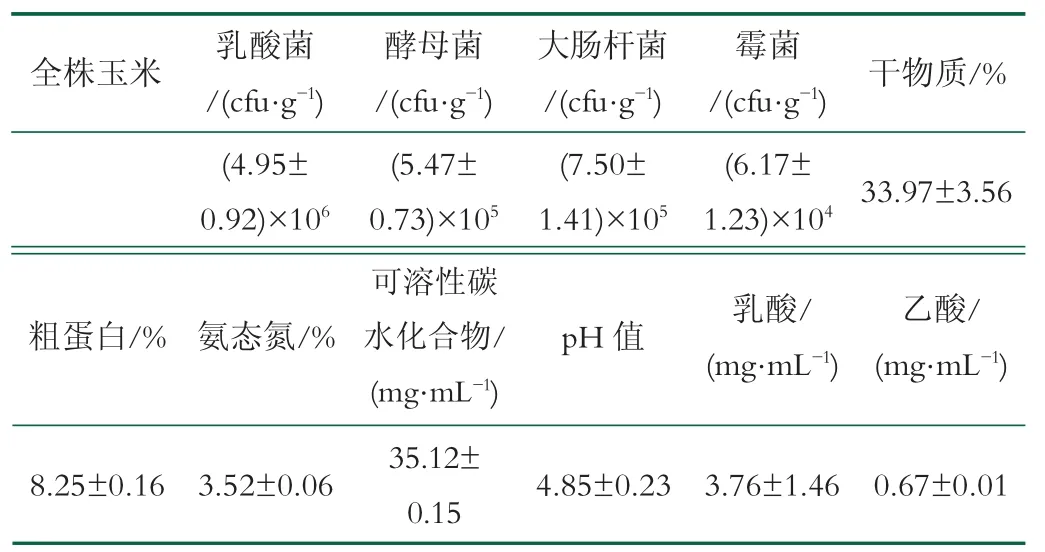
表1 青贮前全株玉米的化学成分
2.2 添加乳酸菌对青贮发酵期的影响
由表2可以看出,青贮第3天,乳酸菌的数量急剧增长。其中,IMAU10585和混菌处理组的乳酸菌活菌数达到(4.05±0.31)×108cfu/g和(3.98±0.86)×108cfu/g,明显高于对照组(P<0.05)。此后,乳酸菌数量逐渐减少。酵母菌、大肠杆菌的数量在此时未检出,而所有处理组的霉菌数明显低于对照组(P<0.05)。
乳酸菌生长繁殖,代谢旺盛,产生了大量的乳酸,所有处理组乳酸含量均显著大于对照组(P<0.05)。随着青贮的发酵,乳酸含量逐渐积累增多。IMAU80162与对照组乙酸含量差异不显著(P>0.05),显著高于其他实验组(P<0.05)。青贮饲料pH值的变化主要与有机酸的变化相关。青贮第3天时所有组的pH值均降到4.0以下,除IMAU80162外,其他组的pH值均显著低于对照组(P<0.05)。3 d之后pH值一直保持相对稳定,IMAU10585组pH值下降最快、最低。
第42天,对照组、IMAU80162组、混菌处理组的乳酸菌活菌数比IMAU10585和IMAU20013组高,达到105数量级,如表2所示。IMAU10585、IMAU20013和混菌组的酵母菌活菌数显著高于(P<0.05)对照组,这可能是由于耐酸酵母菌在低pH和高酸度的情况下生长繁殖造成的。发酵后期仍未检出大肠杆菌和霉菌,证明乳酸菌的生长代谢形成的高酸环境及其产物能长时间抑制有害菌的生长。

表2 添加乳酸菌对玉米青贮发酵参数及微生物组成的影响
整个青贮期间,干物质的变化都不大,可能是由于整个发酵过程在密封的铝箔袋中进行,水分不散失或散失较少。类似地,粗蛋白的变化在各组间不存在显著性差异(P>0.05),整体含量略有增长,但反应蛋白质质量水平的氨态氮指标数值出现了差异性(P<0.05),说明L.plantarum的添加对蛋白质起到了一定的保护作用。可溶性碳水化合物作为乳酸菌产乳酸的原料,其含量到青贮第3天已经迅速下降,之后缓慢较少,其消耗的程度与乳酸菌活菌数的变化是一致的。
2.3 添加乳酸菌对青贮有氧暴露期的影响
如表3所示,有氧暴露期间,乳酸菌数减少,混菌处理组,IMAU800162组的活菌数明显高于对照组(P<0.05)。接触空气后,各实验组酵母菌急剧增长,对照组、IMAU800162组、混菌处理组差异不显著(P>0.05),未检测出大肠杆菌和霉菌。

表3 添加乳酸菌对有氧暴露期的玉米青贮发酵参数及微生物组成的影响
各组pH值均有所升高,但各组间无显著性差异(P>0.05)。乳酸含量相较于发酵前期出现了一定程度的下降,但对照组的乳酸含量、乙酸含量显著高于其他实验组(P<0.05)。干物质、可溶性碳水化合物、粗蛋白的含量呈不同水平地降低,但IMAU20013组干物质和可溶性碳水化合物含量明显高于其它组(P<0.05),分别达到32.95%和4.23 mg/mL。各组氨态氮比例增加,其中,除IMAU10585组外,其他处理组氨态氮比例明显低于对照组(P<0.05)。
3 讨论
在作物表面附生着大量的微生物,一部分是对青贮有利的,比如乳酸菌;另外一部分是有害的,比如腐败菌、酵母菌和霉菌等[13]。实验中的全株玉米干物质、粗蛋白含量、可溶性碳水化合物适中,pH值适合各类微生物生长繁殖,这些可能与玉米的收割季节以及种类有关[14]。
全株玉米是包括玉米果实的完整株玉米,是青贮的主要原材料,含糖量较高,有利于发酵的进行。在青贮初期,添加乳酸菌的各处理组乳酸菌总数显著高于对照组,而酵母菌、霉菌和大肠杆菌的数量均显著地降低了,各处理组的乳酸含量均显著高于对照组,pH值也迅速降低至4.00以下,说明添加的各乳酸菌均能很好的定植和繁殖,并抑制有害菌的增殖。
在青贮后期,对照组和实验组的所有样品仍保持着低pH值环境,未检出大肠杆菌和霉菌。但在乳酸菌、酵母菌总数方面,对照组与某些处理组差异不显著。Hu[15]和Pedroso[16]的实验中同样出现了类似情况。这可能因为添加乳酸菌的总数为105cfu/g,仅为青贮前全株玉米乳酸菌数的1/50,随着青贮原有乳酸菌的生长繁殖,添加的乳酸菌在后期并不占优势。有学者指出,添加乳酸菌达到原料乳酸菌的2~10倍才能使添加的菌群在青贮中占据优势地位[17-18]。
青贮研究中,乳酸与乙酸含量的比值间接反映了青贮中同型和异型发酵乳酸菌的比重[1]。如图1所示,5组青贮饲料中,对照组和IMAU80162的比值相对较小,也就是能产生乙酸的乙酸菌、异型发酵乳酸菌相对较多。乙酸能对酵母菌产生一定抑制作用[19],这与本实验酵母数变化是一致的。虽然酵母菌活动强烈不利于青贮饲料的发酵,但有研究[20]表明酵母菌能够提高奶牛干物质采食量、产奶量以及消化粗蛋白和酸性洗涤纤维的能力,同时生成乙醇等,使青贮饲料具有酒香味。

图1 乳酸与乙酸在青贮期间的含量比值变化
青贮过程中青贮饲料营养成分的变化情况,是指包括干物质、可溶性碳水化合物和粗蛋白等的变化。干物质代表着饲料的潜在可利用潜能,研究指出要获得较好的青贮品质需要干物质浓度大于200 g/kg,干物质含量高(300~350 g/kg)的青贮玉米可以在一定程度上控制发酵造成的损失,另外牛对干物质含量低于300 g/kg的青贮玉米的消化吸收率会大量减少[21]。本实验的各组间干物质含量变化并不显著,且随青贮时间的变化规律也不明显。
可溶性碳水化合物和粗蛋白含量也是衡量谷物类青贮品质的两大重要指标[22]。可溶性碳水化合物是乳酸菌形成乳酸的原料,只有足够数量的可溶性碳水化合物,才有可能使乳酸菌生成足够的乳酸,造成低pH环境,抑制或杀死有害微生物,达到形成和保存青贮饲料的目的[13]。本实验中,虽然IMAU100585和IMAU20013组相较于其他组可溶性碳水化合物含量明显高,但可能与这两组乳酸菌总数偏少有关如图2所示,而混菌处理组在保证乳酸菌数量的基础上,可溶性碳水化合物含量仍然高于对照组和IMAU80162处理组,说明乳酸菌的添加一定程度上可以提高青贮饲料的品质。

图2 青贮期间饲料中葡萄糖含量变化
另外,评价玉米饲料的营养品质还需看其蛋白质含量和蛋白质品质。在青贮过程中蛋白质会降解成非蛋白氮,造成氨态氮的比例增加[23]。该实验中的蛋白质含量和氨态氮比例在青贮期并没有显著变化,在有氧暴露期,由图3可见,IMAU80162组、混菌组的氨态氮明显低于其他组,说明乳酸菌的添加可以在一定程度上保护蛋白质不被消耗。

图3 玉米青贮中氨态氮的变化情况
4 结论
本研究中L.plantarum的添加有助于增加饲料厌氧发酵和有氧暴露后乳酸菌的数量,降低pH,减少大肠杆菌、酵母菌和霉菌等有害菌的数量,提高青贮饲料品质和有氧稳定性。其中单株IMAU80162抑制霉菌和酵母菌的效果最为显著,它与IMAU100585,IMAU20013混合使用能有效维持青贮饲料的营养品质。但是,不同的L.plantarum及配比能否改善青贮饲料的微生物菌群及营养成分,还需要进一步的探究。
