非小细胞肺癌的免疫微环境与免疫治疗
2022-04-08郭光然张兰军
郭光然, 张兰军
2020年全球新发肺癌220万例,在恶性肿瘤中发病率位居全球第二,而在我国其发病率和死亡率仍居所有恶性肿瘤的第一位,其中约85%的患者为非小细胞肺癌,严重威胁着人们的生命健康[1]。尽管手术治疗、放射治疗和化疗等各种治疗手段日益进步,但非小细胞肺癌患者的5年生存率仍然不佳,早期(ⅠB期)患者仅为68%,Ⅳ期患者甚至低于10%[2]。近年来,免疫治疗的兴起为非小细胞肺癌的治疗带来了福音。一项涉及713例Ⅲ期非小细胞肺癌患者的临床研究证实免疫治疗能延长患者的总体生存率,免疫治疗也被推荐用于部分晚期肺癌患者的一线治疗[3]。然而仍有大部分的非小细胞肺癌患者未能从免疫治疗中获益。机体免疫系统负责监控和杀伤肿瘤细胞,为了躲避免疫攻击,肿瘤细胞常常增强一些关键的免疫抑制蛋白的表达,以程序性死亡分子1(programmed cell death protein 1,PD1)及其配体(programmed cell death protein 1 ligand,PD-L1)最为常见,这些分子能抑制免疫细胞的激活,进而减弱免疫应答。免疫治疗则是通过上述免疫抑制蛋白的抑制剂来激活免疫效应细胞,以达到杀伤肿瘤细胞的目的[4]。而肿瘤浸润的淋巴细胞则是免疫治疗中被激活的主要效应细胞[5]。可见,深入了解肺癌的免疫微环境特征是理解非小细胞肺癌肿瘤免疫调控机制及寻找新的干预靶点的关键。
1 肿瘤免疫微环境
非小细胞肺癌的免疫微环境主要由各类细胞和细胞外基质组成。见图1。细胞包括肿瘤细胞、血管内皮细胞、肿瘤相关的成纤维细胞以及浸润的免疫细胞,而细胞外基质则以胶原蛋白、蛋白聚糖和糖胺聚糖为主要成分[6]。本文重点讨论肿瘤微环境中的免疫细胞。免疫细胞主要分为髓系细胞和淋巴细胞两大类。髓系细胞主要由肿瘤相关的巨噬细胞和中性粒细胞构成。巨噬细胞包括经典活化以促进免疫应答抗瘤为主的M1型巨噬细胞和旁路激活促血管生成造成免疫抑制的M2型巨噬细胞[7]。肿瘤中性粒细胞作用较为复杂,既可增加血管生成以促进肿瘤的生长转移,也可通过分泌抗瘤因子及细胞毒性分子抑制肿瘤进展,但其在非小细胞肺癌中的作用仍有待研究[8]。此外,还可以按功能划分出一类髓系来源的免疫抑制细胞,该类细胞能抑制T细胞的增殖及细胞因子的分泌,抑制免疫反应[9]。目前,髓系来源的免疫抑制细胞主要分为两种:多核免疫抑制细胞和单核免疫抑制细胞。就相似性而言,多核免疫抑制细胞的形态和表型特征与中性粒细胞接近,而单核免疫抑制细胞则更接近未成熟的单核细胞。淋巴细胞主要以T细胞为主,这也是免疫治疗的主要效应细胞。Treg细胞高表达Foxp3,是最主要的免疫抑制T细胞。在小鼠模型中清除Treg细胞能抑制瘤体的生长[10]。细胞毒性的CD8+T细胞在配体激活其表面的细胞受体后能分泌干扰素-γ(interferon-gamma,INF-γ)、肿瘤坏死因子(tumor necrosis factor,TNF)和颗粒酶B(granzyme B)来杀伤和破坏肿瘤细胞[11]。但Treg细胞和肿瘤细胞则会抑制细胞毒性CD8+T细胞的功能,使其变为耗竭T细胞。耗竭T细胞高表达PD1、T细胞膜蛋白3及细胞毒性T淋巴细胞相关抗原4(cytotoxic T-lymphocyte associated protein 4,CTLA4),这些蛋白都是免疫治疗重点干预的靶点[12]。淋巴细胞中还有一部分为B细胞。肿瘤中的B细胞能传递肿瘤抗原,与预后呈正相关,是增强非小细胞肺癌免疫治疗效果的一个潜在靶点[13]。
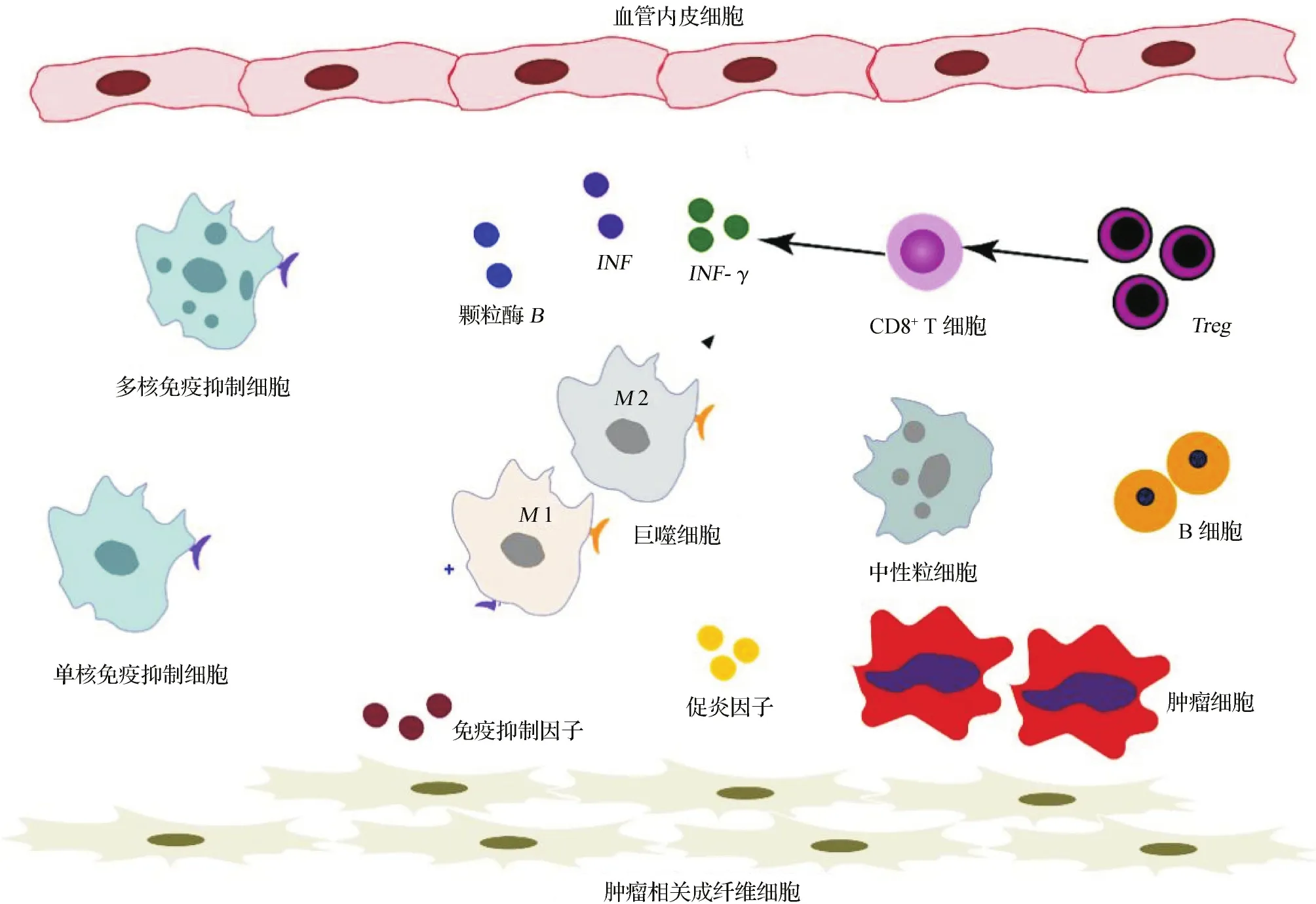
图1 肿瘤免疫微环境细胞示意图
2 非小细胞肺癌的免疫治疗
非小细胞肺癌的免疫微环境与免疫治疗息息相关。2015年CheckMate017研究提示在晚期肺癌患者中,PD-1抑制剂纳武单抗(nivolumab)被证明与二线用药多西他赛相比能使患者获得更长的生存时间,自此拉开了非小细胞肺癌免疫治疗的序幕[14]。随后,PD-L1抑制剂阿特珠单抗(atezolizumab)也被证实能延长进展期肺癌患者的总体生存率[15]。然而,尽管免疫治疗进展迅速,但仅有少部分患者对单药免疫抑制剂表现出很好的反应,联合化疗药物有利于进一步扩大免疫治疗的适用人群。在作用机制方面,化疗联合免疫治疗能增强T细胞对肿瘤抗原的识别并消除肿瘤免疫微环境的免疫抑制因子[16]。单用化疗仅能使29%的肺癌患者获得临床缓解,加用免疫治疗后,客观缓解率能提升至55%。但即使联合化疗药物,免疫治疗的有效应答患者比例也仅能达到63%[17]。免疫抑制剂抵抗是目前免疫治疗发展的最大瓶颈。根据抵抗的机制和非小细胞肺癌免疫微环境的特征,可以按肿瘤浸润淋巴细胞的数目和PD-L1的表达水平,将患者划分为四种类型[18]。类型2的患者,有着一定水平的肿瘤浸润T细胞和PD-L1的表达,最有可能从免疫治疗中获益。类型1和类型4的患者肿瘤浸润的淋巴细胞有限,主要与肿瘤抗原呈递受限和免疫细胞互作及迁移受到抑制相关。类型3的患者虽然有一定数量的肿瘤浸润淋巴细胞,但其激活存在缺陷,缺乏肿瘤特异的淋巴细胞[19]。深入了解非小细胞肺癌的免疫微环境,将其他类型患者的肿瘤免疫微环境向类型2的微环境转换是目前提升免疫治疗效果的一大方向。
3 基于免疫微环境的预测模型
鉴于肿瘤免疫微环境会影响非小细胞肺癌的进展及治疗效果,有很多研究通过分析免疫微环境基因来预测患者的临床预后。近期有研究者选取了30个免疫相关的基因构建了一个预测基因集,发现其与非小细胞肺癌的临床分期和肿瘤的复发密切相关[20]。也有学者针对非小细胞肺癌的免疫微环境特征,计算了一项免疫评分来预测患者的生存时间[21]。笔者也对非小细胞肺癌患者的免疫微环境进行了分析,选取了肿瘤组织和癌旁组织差异表达的免疫基因,然后通过单因素Cox回归分析筛选出预后相关的基因,再通过多因素Cox回归分析构建预后风险模型,并据此计算患者的风险评分。风险评分对患者生存时间的预测效率与前面两项研究相似。在此基础上,我们还进一步评估了免疫细胞浸润模式,以寻找与预后相关的免疫细胞亚型。我们利用非小细胞肺癌患者微环境中浸润的免疫细胞类型进行聚类分析,结果显示免疫细胞浸润类型主要分为两类:A类患者的肿瘤组织中有更多的记忆B细胞、肥大细胞和活化的树突状细胞,而在B类患者的肿瘤组织中发现更多的Treg细胞、自然杀伤细胞和M0巨噬细胞(具有分化能力的中间巨噬细胞)。A类患者总体生存时间要优于B类患者,且A类患者的PD-1表达水平更低(见图2)[22]。相信更多基于免疫微环境的研究能为非小细胞肺癌的治疗提供新的干预靶点。

ⓐ各细胞类型与评分相关性;ⓑ以免疫细胞浸润类型分为A、B两组,B组患者生存期短(ⓒ)且PD-1表达水平高(ⓓ)
4 结语
免疫治疗的出现为非小细胞肺癌的治疗开辟了新的领域。目前临床上主要以PD-L1的表达和肿瘤突变负荷(tumor mutation burden,TMB)高低为依据来评估是否进行免疫治疗,但这两个指标都有其局限性。超过半数高表达PD-L1的肺癌患者未能从免疫治疗中获益[23],而免疫治疗后的总体生存率在TMB高和TMB低的两组患者间也未见到显著差异[24]。目前在非小细胞肺癌治疗中急需一种能预测免疫治疗效果的标志物[25]。此外,本文提到的免疫抑制剂耐药现象也是目前免疫治疗进展中亟待解决的问题,而这些问题的解决都离不开对肿瘤免疫微环境的理解。随着免疫微环境中各类细胞亚型功能被揭示及调控网络认识的加深,将来肯定会有更多的非小细胞肺癌患者能从免疫治疗中获益。
