茄子低温响应基因SmICE1的克隆及其功能分析
2022-04-06周露刘杨崔群香陈火英
周露,刘杨,崔群香,陈火英*
(1.金陵科技学院园艺园林学院,江苏 南京 210038;2.上海交通大学农业与生物学院,上海 200240)
植物生长发育和各类代谢物的合成均受到各种逆境的影响,包括低温、强光、干旱和高盐等。植物常通过调节逆境响应基因的表达来适应这些逆境,其中低温响应(cold responsive,COR)基因的启动子上含有1个或多个CRT(C-repeat element)顺式作用元件。在低温环境下,AP2/ERF类转录因子CBF(CRT binding factor)通过与CRT元件结合来激活COR基因的表达从而响应低温[1]。过表达CBF基因可以在室温环境下激活下游COR基因的表达并增加植株的抗寒性[1]。研究发现MYC型bHLH转录因子ICE1(inducer of CBF expression)可以调控CBF基因的表达[2]。常温下,组成型表达的ICE1呈现钝化状态,而当植株处于低温时,ICE1则作为低温驯化中主要的正调控因子激活CBF基因的表达[2-3]。在拟南芥中,AtICE1在低温驯化过程中直接结合到AtCBF3启动子的MYC识别位点(CANNTG)上,过表达AtICE1基因可以增加植株的抗寒性,而ice1突变体中CBF3和COR基因表达降低,且植株抗寒性和低温驯化能力下降[4]。
花青素作为重要的类黄酮次生代谢产物,赋予植物丰富多彩的颜色。低温、UVB辐射和水分胁迫等多种环境逆境可诱导花青素合成[5]。植物中的花青素由苯丙氨酸经过一系列关键酶的催化反应合成。多种转录因子参与调控关键酶基因的表达,其中研究最多的为MYB、bHLH和WD40类转录因子。除此以外,AP2/ERF、YABBY和WRKY等转录因子家族也参与花青素的生物合成[6]。前期研究表明,茄子AP2/ERF类低温响应因子SmCBF可以通过与花青素合成正调控因子SmMYB113互作来调控花青素的生物合成[7]。茄子SmYABBY则可以结合到SmTT8启动子上,且参与非光敏茄子的花青素的积累[6]。在拟南芥中异源表达毛子草IaYABBY2基因可以增加逆境环境下植株的花青素含量[8]。过表达苹果MdWRKY11可以增加苹果愈伤组织中类黄酮和花青素的积累[9]。
茄子(Solanummelongena)为一种富含花青素的喜温蔬菜,低温是影响其产量和品质的主要环境因子,探究抗冷相关基因的功能不仅有助于阐明茄子抗冷机制,而且有利于解析果实色泽形成机制。在前期研究中,我们已经从茄子中克隆了1个MYC型ICE1-like转录因子SmICE1a,并明确了其通过调控SmCBF的表达来影响植物的抗冷性[10]。本研究中,我们克隆获得另一个ICE1-like转录因子SmICE1,并对其进行生物信息学、表达水平、亚细胞定位和转录激活分析,同时利用转基因株系进行功能验证,通过酵母双杂交和双分子荧光互补试验验证其互作蛋白,旨在探究SmICE1在茄子低温响应和花青素生物合成中的功能。
1 材料与方法
1.1 试验材料
供试材料为光敏型茄子品种‘蓝山禾线’。将生长至4叶期的茄子植株放置于4 ℃光照培养箱中低温处理24 h,于不同时间点选取植株叶片迅速放入液氮速冻,-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1SmICE1的克隆与生物信息学分析按照植物RNA提取试剂盒(MiniBEST Plant RNA Extraction Kit,TaKaRa公司)说明书提取茄子RNA。使用PrimeScriptTMRT reagent Kit(TaKaRa公司)试剂盒进行反转录获得cDNA。利用茄子基因组数据库(http://eggplant.kazusa.or.jp/)的BLASTp程序比对拟南芥AtICE1蛋白序列,找到同源性较高的茄子蛋白序列,进一步通过ORF Finder与其他ICE1蛋白进行比对来确认其编码区的正确性。设计引物SmICE1-F/R(表1),以上述cDNA为模板使用高保真DNA聚合酶(TaKaRa公司)进行PCR扩增。使用10 g·L-1琼脂糖凝胶电泳检测PCR产物并回收目的条带,将其连接到pEasy-Blunt Simple(北京全式金生物技术有限公司)克隆载体上并测序。

表1 本研究所用引物
通过Prot Param tool(http://www.expasy.ch/tools/protparam.html)在线软件分析SmICE1蛋白的相对分子质量和理论等电点。采用Clustal W 1.7和GeneDoc 2.7.0软件进行蛋白序列比对。采用Clustal W 1.7和MEGA 6.0软件中的邻接法(Neighbor-joining)进行系统发育进化分析。
1.2.2SmICE1的表达水平分析对生长至4叶期的茄子幼苗进行4 ℃低温处理,分别在0、1、3、6、12和24 h时取样,提取RNA并反转录为cDNA,以此为模板进行RT-qPCR分析。根据CDS序列,使用Premier Primer 5软件设计定量引物SmICE1-Q-F/R(表1),并以茄子SmAPRT(JX448345)[11]为内参基因。反应体系:cDNA模板100 ng,前、后引物(10 μmol·L-1)各0.8 μL,TB Green酶(2×)10 μL,ddH2O补齐至20 μL。反应程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。通过2-ΔΔCT法计算相对于内参的表达水平。将未处理条件下(即0 h)的表达值设为1,获得相对于0 h的基因表达情况并绘图。通过SPSS 17软件中ANOVA方法的Duncan’s New Multiple Range test(Puncan)统计各个时间点的显著性差异。
1.2.3 SmICE1蛋白的亚细胞定位分析使用限制性内切酶BamHⅠ和SpeⅠ对含有YFP序列的PHB植物表达载体(PHB-YFP)进行线性化双酶切。设计PHB-SmICE1-F/R引物(表1)扩增SmICE1。利用同源重组酶In-Fusion HD Cloning Plus(TaKaRa公司)将获得的目的基因回收产物连接到线性化的载体上,构建重组载体PHB-SmICE1-YFP。测序正确的重组质粒转入农杆菌GV3101菌株中,通过菌液PCR检测获得阳性克隆。将上述阳性农杆菌接种在含50 mg·L-1Kan和25 mg·L-1Rif的LB液体培养基中,28 ℃摇床过夜培养至D600值为0.6~0.8后,离心后去上清液,使用含30 g·L-1蔗糖的MS液体培养基(含200 μmol·L-1乙酰丁香酮和10 mmol·L-1MES)重悬使D600值达到0.8,室温条件下静置3 h后,使用1 mL无菌注射器吸取菌液将其从叶片背面注入烟草中。将注射后的烟草置于人工气候室3 d后,收集叶片,利用激光扫描共焦显微镜(Leica TCS SP5-Ⅱ,Germany)检测YFP蛋白的荧光信号。
1.2.4 转录激活活性检测利用同源重组酶将茄子SmICE1和拟南芥AtCBF1(阳性对照)全长片段连接到pGBKT7酵母表达载体上,构建重组质粒SmICE1-pGBKT7和AtCBF1-pGBKT7。将测序正确的重组质粒与空载体质粒pGBKT7分别转化至酵母菌株AH109中,涂布于SD/-Trp缺陷型培养基中。30 ℃培养3 d后,用无菌水重悬挑选的酵母菌株,接种并培养于含有或不含X-α-Gal的SD/-Trp-His-Ade固体培养基中,30 ℃倒置培养3 d后拍照记录。
1.2.5 双荧光素酶报告检测试验以上述获得的PHB-SmICE1-YFP农杆菌菌株为效应子,PHB-YFP农杆菌为阴性对照。根据前期研究获得的3个茄子SmCBF的启动子序列[12],设计引物pGreen-SmCBF1pro-F/R、pGreen-SmCBF2pro-F/R、pGreen-SmCBF3pro-F/R(表1),利用同源重组酶分别将其构建到线性化的pGreenII 0800-LUC载体上获得3个报告载体(SmCBF1pro-LUC、SmCBF2pro-LUC和SmCBF3pro-LUC),随后转化GV3101(pSoup)农杆菌菌株。根据上述烟草瞬时转化法将效应子与报告载体农杆菌组合注射入烟草叶片中。注射2 d后将部分烟草置于4 ℃环境下3 h[13],分别收集常温和4 ℃处理的烟草叶片样品,根据双荧光素酶检测试剂盒的说明进行双荧光素酶的测定。每个组合至少3次生物学重复,使用t-test分析0.01水平的显著性差异(**P<0.01)。
1.2.6 在拟南芥中异源表达SmICE1基因将上述获得的PHB-SmICE1-YFP农杆菌按1∶100(体积比)接种至100 mL LB液体培养基(含50 mg·L-1Kan和25 mg·L-1Rif),28 ℃摇床过夜培养至D600值为0.6~0.8后,8 000 r·min-1离心5 min,弃上清液,使用转化液重悬菌体并调D600值为0.8。将拟南芥花蕾浸入重悬液1 min,重复3次。侵染后置于人工气候箱中黑暗过夜培养,随后进行正常光照培养直至其完全成熟后收种。将收获的种子消毒后用无菌水冲洗4~5次,随后将种子均匀平铺于含有50 g·L-1蔗糖和50 mg·L-1潮霉素的MS固体培养基上,4 ℃春化3 d。随后置于正常光照培养箱中培养10 d后,挑选生长良好的转基因植株移栽至土壤中。2周后提取DNA进行PCR鉴定,筛选阳性单株进行独立编号并收种。筛选获得 2个表达量高的T3家系进行后续研究,命名为L1和L2。
1.2.7 转基因植株耐寒性和生理指标测定将上述筛选出的转基因家系种子播种于MS固体培养基上,培养1周后移栽至土壤中。移栽2周后取转基因植株和野生型拟南芥各50株进行低温处理(-6 ℃处理 8 h),随后将其移入正常环境下生长1周,统计其存活率并拍照记录[14]。3次生物学重复。
选取生长3周的转基因和野生型植株置于0 ℃环境下2 d,分别于0、3、12、24和48 h取样并测定电解质渗透率(electrolyte leakage,EL)和丙二醛(malondialdehyde,MDA)、脯氨酸(proline,Pro)含量。其中MDA和Pro含量的测定使用南京建成生物工程研究所的试剂盒。选取0.2 g拟南芥植株置于离心管中,用ddH2O清洗4~5次后室温下振荡24 h,使用电导仪测定初始EL值(E1),121 ℃高温高压15 min后,测定最终EL值(E2),以ddH2O的EL值(E0)作为对照。离子渗透率=(E1-E0)/(E2-E0)×100%。
1.2.8 转基因植株中AtCBF基因表达分析将生长3周的转基因和野生型拟南芥在0 ℃环境下处理48 h。使用RNA提取试剂盒抽提叶片RNA,测定转基因和野生型拟南芥中AtCBF1、AtCBF2和AtCBF3的表达情况,以拟南芥Actin作为内参基因。通过2-ΔΔCT方法计算相对于内参的表达水平。将未处理条件下(即0 h)的表达值设为1,获得相对于0 h的基因表达情况并绘图。3次生物学重复。
1.2.9 酵母双杂交试验同源克隆茄子SmYABBY(Sme2.5_03738.1_g00001.1)[6],利用同源重组酶将SmICE1和SmYABBY分别构建到酵母双杂交pGADT7和pGBKT7载体上作为猎物载体和诱饵载体。将pGADT7与pGBKT7组合转化至酵母感受态AH109中,再涂布在SD/-Trp-Leu培养基上。30 ℃培养3 d后,用无菌水重悬挑选的酵母菌株并点接种于SD/-Trp-Leu-His及SD/-Trp-Leu-His-Ade固体培养基上,30 ℃倒置培养3 d后拍照记录。
1.2.10 双分子荧光互补试验将SmYABBY编码区全长构建到含有N端YFP的pXY106载体上,构建SmYABBY-nYFP。将SmICE1终止密码子去除后连接到含有C端YFP的pXY104载体上,构建SmICE1-cYFP。随后将上述质粒转入农杆菌GV3101中。SmYABBY-nYFP与SmICE1-cYFP、SmYABBY-nYFP与空cYFP、空nYFP与SmICE1-cYFP农杆菌菌液按照1∶1(体积比)的比例混合后注射烟草叶片,48 h后通过激光共聚焦显微镜观察荧光情况。
2 结果与分析
2.1 茄子SmICE1的克隆及结构分析
使用AtICE1蛋白序列在茄子基因组数据库中进行BLAST比对,筛选获得ICE1同源基因SmICE1(登录号:MH992119),对SmICE1编码区进行克隆,发现其全长为1 524 bp,编码507个氨基酸。使用Prot Param tool在线软件预测SmICE1蛋白相对分子质量为54.75×103,理论等电点为5.6。同源多序列比对分析其结构保守性,发现SmICE1含有保守的bHLH结构域、ZIP(zipper)结构域、 N端保守的S-rich基序、C端保守的ACT-like结构域和预测的类泛素化(SUMO)修饰位点(图1)。进化树分析显示,SmICE1与番茄低温调控因子SlICE1(XP_004235842.1)[15]同源性最高(图2),而前期报道的SmICE1a(MH992120)则与番茄SlICE1a(AGG38826)亲缘关系较近[10]。

图1 SmICE1与其他植物物种同源蛋白间的多序列比对

图2 SmICE1与其他植物物种ICE蛋白间的进化树分析
2.2 低温处理下SmICE1的表达分析
由图3可见:SmICE1在低温处理1 h后表达量显著增加,为0 h的2.2倍,随后表达量降低,12 h时再次升高,说明SmICE1表达受低温调控。
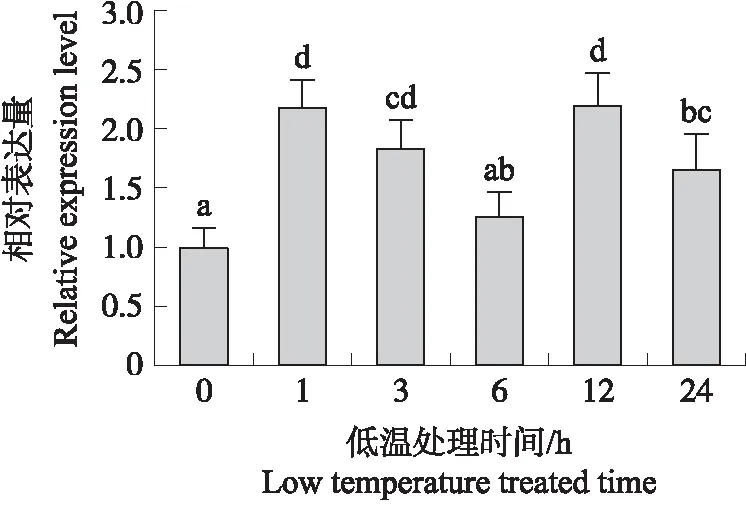
图3 低温处理后SmICE1基因的表达模式
2.3 SmICE1蛋白的亚细胞定位分析
为了验证SmICE1蛋白的亚细胞定位,构建PHB-SmICE1-YFP植物表达载体,通过农杆菌侵染使其在烟草叶片中瞬时表达。由图4可见:对照PHB-YFP的荧光信号遍布整个细胞,而PHB-SmICE1-YFP蛋白的荧光信号仅定位于细胞核中。表明SmICE1为一个核蛋白。
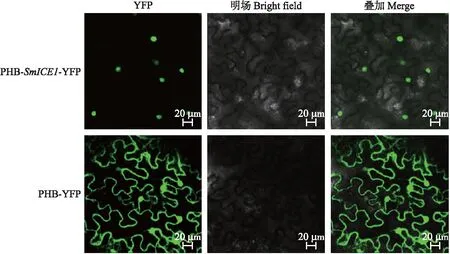
图4 SmICE1在烟草表皮细胞中的亚细胞定位
2.4 SmICE1蛋白的转录激活活性分析
如图5所示:含有SmICE1-pGBKT7和AtCBF1-pGBKT7载体的酵母菌株在筛选培养基(SD/-Trp-His-Ade)上生长良好,并且具有α-半乳糖苷酶活性,而空载体pGBKT7(阴性对照)则不能在筛选培养基上生长。表明SmICE1蛋白具有转录激活活性。

图5 酵母中SmICE1的转录激活活性分析
2.5 SmICE1转录因子对SmCBF表达的调控作用分析
如图6所示:低温环境下,PHB空载可以增强SmCBF启动子的活性。常温(room temperature,RT)环境下,加入PHB-SmICE1-YFP后,SmCBF启动子活性被明显激活,且低温(low temperature,LT)处理后,SmICE1对SmCBF启动子的激活作用更加显著。表明低温和SmICE1可以促进SmCBF的表达。
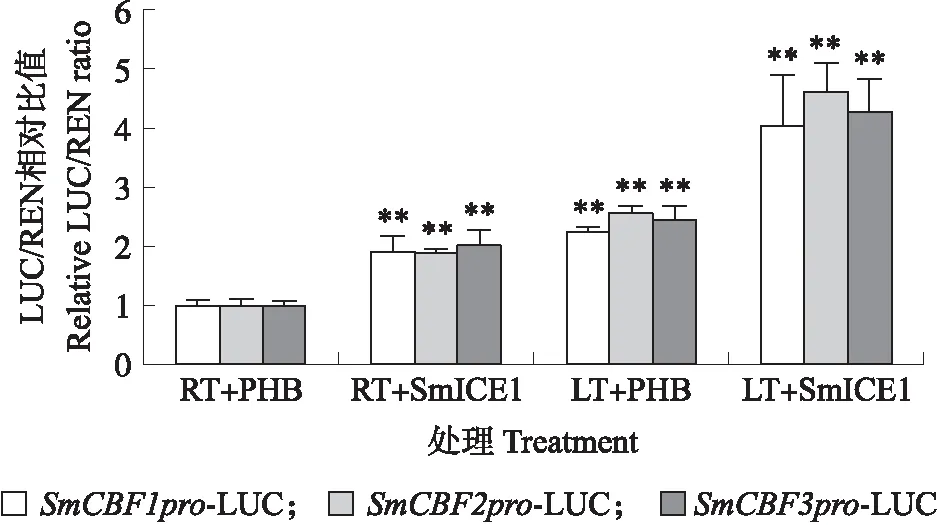
图6 SmICE1在SmCBF基因表达中的作用
2.6 转基因拟南芥的鉴定分析
为了验证SmICE1在植物低温响应中的作用,构建了35S组成型启动子驱动的SmICE1过表达载体,再通过农杆菌转化法分别转入野生型拟南芥(wild type,WT)。通过潮霉素筛选转基因植株至纯合T3代,并通过PCR鉴定转基因植株后选择2个家系(L1和L2)进行后续研究(图7-A)。进一步研究发现在正常生长环境下,WT与转基因植株间无显著差异(图7-B)。将转基因植株和WT置于-6 ℃处理8 h,随后在正常生长环境下恢复1周后对植株存活率进行统计分析,发现野生型植株存活率仅有20%左右,而SmICE1过表达植株存活率达50%~56%(图7-C)。这表明SmICE1可显著增强拟南芥的抗寒性。

图7 SmICE1转基因拟南芥的抗寒性分析
由图8可见:在低温处理前(0 h),野生型植株中电解质渗透率和丙二醛(MDA)含量及脯氨酸(Pro)含量与转基因植物无显著差异。在低温处理后,所有植株中EL和MDA、Pro含量均随着处理时间的延长呈增加的趋势,但野生型中电解质渗透率高于转基因植株,Pro含量低于转基因植株,而转基因植株与野生型的MDA含量差异相对较小。表明过表达SmICE1能够增强拟南芥对于低温的耐受性。
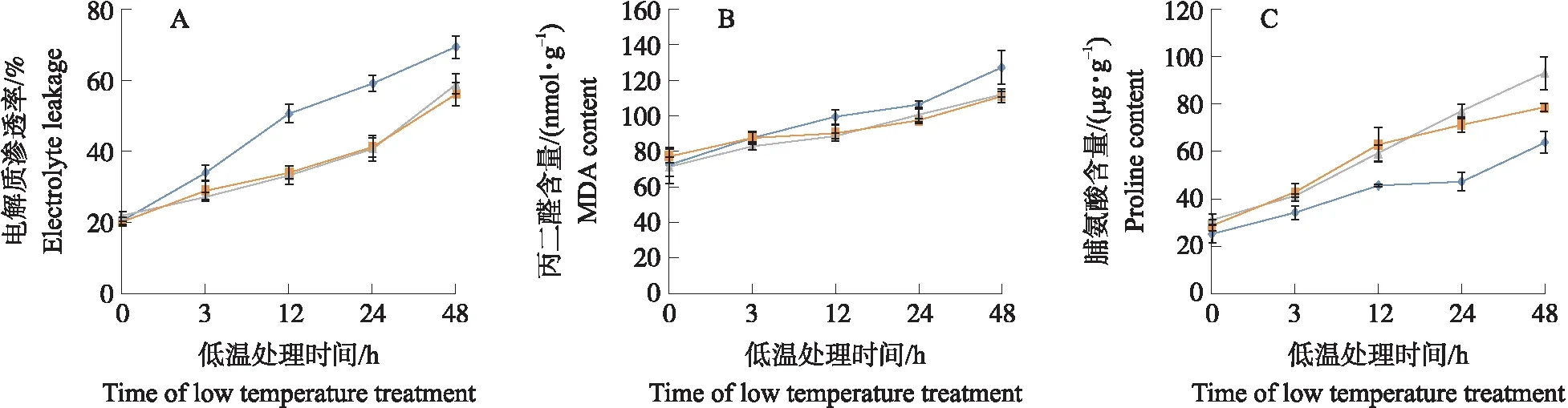
图8 转基因和野生型植株的电解质渗透率(A)、丙二醛含量(B)和脯氨酸含量(C)分析
由图9可见:低温处理后,SmICE1转基因植株中AtCBF1、AtCBF2和AtCBF3基因表达量均高于野生型,尤其是AtCBF2。表明SmICE1正调控植株低温抗性。

图9 低温处理下转基因植株中AtCBF基因表达量
2.7 SmICE1与SmYABBY蛋白间的互作分析
由图10可见:SmYABBY-pGBKT7与SmICE1-pGADT7共转酵母可以在缺陷型培养基上正常生长,而SmYABBY-pGBKT7与空载体pGADT7或SmICE1-pGADT7与空载体pGBKT7共转均无法在SD/-Trp-Leu-His和SD/-Trp-Leu-His-Ade培养基上生长,表明SmICE1与SmYABBY蛋白在酵母中存在相互作用关系。
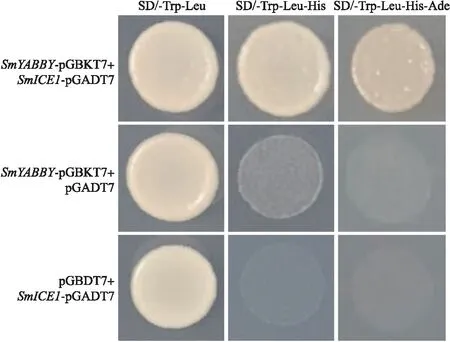
图10 SmICE1与SmYABBY在酵母中的互作分析
如图11所示:当SmICE1-cYFP与SmYABBY-nYFP共转烟草时,可以在细胞核中检测到明显的荧光信号。而SmICE1-cYFP与空载体nYFP共转或SmYABBY-nYFP与空载体cYFP共转则检测不到荧光信号,表明SmICE1与SmYABBY蛋白在植物体内仍旧能够发生相互作用。

图11 SmICE1与SmYABBY在烟草叶片表皮细胞中的互作分析
3 讨论
低温影响植物的生长发育,也是造成果实品质和产量下降的主要非生物胁迫之一。植物响应低温具有多种分子机制,其中ICE1-CBF-COR冷驯化转录调控通路存在于多种植物中。前期研究表明茄子SmICE1a作为转录因子可以调节植物低温响应[10]。本研究中,从茄子中分离了另一个ICE1-like转录因子SmICE1,该蛋白与番茄SlICE1具有很高的同源性。与其他植物ICE1蛋白一样,SmICE1蛋白含有保守的S-rich基序、ZIP、bHLH、ACT-like结构域以及预测的类泛素化(SUMO)修饰位点。与番茄SlICE1a相似[14],低温环境下SmICE1基因表达有轻微的上调,这可能是由于低温可诱导ICE1蛋白进行翻译后修饰,包括磷酸化、泛素化和类泛素化修饰等,这些修饰作用对调控CBF基因表达具有更为重要的作用[16]。在低温环境下,拟南芥AtICE1可以结合到AtCBF3启动子的MYC识别位点上,从而增强AtCBF3基因的表达[4]。本研究中Dual-LUC试验表明SmICE1转录因子可以促进SmCBF基因的表达,而酵母单杂交试验显示SmICE1并不能直接结合到SmCBF启动子全长和CANNTG基序上(结果未列出),这可能是SmICE1对SmCBF启动子的结合需要低温诱导SmICE1蛋白进行翻译后修饰等,后期需要进一步通过其他技术手段验证SmICE1与SmCBF启动子间的相互作用。在拟南芥中异源过表达茄子SmICE1,低温处理后转基因植株的存活率显著高于野生型,说明过表达SmICE1可以提高植株的抗寒性。电解质渗透率、游离脯氨酸和丙二醛含量是衡量植物受冻害程度的重要生理指标。本试验表明,低温条件下转基因植株具有更低的电解质渗透率以及更高的脯氨酸含量,这与在拟南芥中异源表达不结球白菜BcICE1的结果相似[17]。同时,相对于野生型,低温处理后转基因植株中3个AtCBF基因的表达量也均有不同程度的增加。茄子SmICE1a转基因植株也具有抗寒性增强、低温下AtCBF基因表达增加和电解质渗透率等生理指标改变的表型[10],因此茄子中2个ICE1-like转录因子在低温响应上可能存在功能冗余。
ICE1在常温下组成型表达,在低温逆境下,ICE1蛋白诱导下游低温响应基因表达,从而增强植株抗冷性[2-3]。除了参与低温响应,ICE1还参与气孔发育[18]和花青素积累[19]等进程的调节。研究表明,ICE1作为气孔发育过程中重要的正调控因子,可以与气孔发育过程中最关键的3个转录因子SPCH(SPEECHLESS)、MUTE和FAMA发生相互作用[18]。目前关于低温促进花青素合成的研究也有较多报道。在苹果中,低温可以诱导苹果愈伤组织中冷响应基因MdICE1及花青素合成调节基因MdMYB10和MdbHLH3表达,且MdICE1与MdMYB10存在相互作用,该互作可能会促进下游花青素结构基因的表达,从而促进苹果花青素的积累[19]。ZF-HD家族成员YABBY作为植物特有的转录因子,广泛参与植物的生长发育,包括调节番茄果实大小[20],调控玉米小花发育和花分生组织发育[21]等。对紫叶桑葚进行低温处理发现,低温可以调控YABBY基因的表达[22]。在拟南芥中,YABBY1可以调节MYB75基因表达从而参与花青素生物合成[23]。我们前期研究表明,对光敏和非光敏茄子进行套袋遮光处理,开袋后进行转录组测序,发现果皮中SmYABBY和SmICE1与花青素合成相关结构基因具有相似的表达趋势,且SmYABBY可以结合到SmTT8启动子上,可能参与茄子花青素合成[6]。ICE1和YABBY均可在常温下表达并行使部分功能。本研究通过酵母双杂交和双分子荧光互补试验验证了SmICE1与SmYABBY蛋白间的相互作用,但它们是否协同参与茄子花青素的生物合成,以及是调节常温还是低温环境下花青素的积累还需要后续试验进行系统验证。
