不同尿素添加水平对育肥湖羊瘤胃发酵及微生物菌群结构的影响
2022-04-06孙美杰姜君徐诣轩李志鹏申军士朱伟云
孙美杰,姜君,徐诣轩,李志鹏,申军士,朱伟云
(南京农业大学国家动物消化道营养国际联合研究中心/江苏省消化道营养与动物健康重点实验室/动物科技学院消化道微生物研究室,江苏 南京 210095)
近年来,随着我国牛、羊等反刍动物养殖业的快速发展,对蛋白质等饲料原料的需求日益增大。但我国大豆等蛋白质资源紧缺,进口量大且依赖度高,已成为制约我国畜牧业发展主要瓶颈之一。瘤胃作为反刍动物特有的消化器官,其不仅可以消化粗纤维,还可以利用非蛋白氮(NPN)合成微生物蛋白,借助这一特性,在反刍动物日粮中补充NPN,可以有效缓解我国蛋白质饲料紧缺的问题。尿素作为一种性价比高的NPN,在反刍动物生产中已被广泛使用。前人研究发现,日粮中添加尿素可提高水牛[1]、肉牛[2]和骆驼[3]等动物的采食量、养分消化率和生长性能。但Wang等[4]在绵羊上研究发现,当日粮中尿素添加量达25 g·kg-1时,动物干物质采食量(DMI)和平均日增重(ADG)均降低。本实验室前期研究发现,在低蛋白日粮基础上,育肥湖羊DMI和ADG随尿素添加量的增加(10、20、30 g·kg-1)呈二次曲线变化,其中以10 g·kg-1日粮组最高,但30 g·kg-1日粮组的DMI和ADG并未显著降低[5]。造成上述结果不一致的原因可能与试验所选的动物种类和尿素添加水平有关。日粮的改变会直接影响瘤胃内环境和微生物的结构和组成[6]。目前,关于不同尿素添加水平对反刍动物瘤胃微生物菌群结构影响已有研究,前人在肉牛(n=4~6)[7]、牦牛(n=3)[8]和绵羊(n=6)[9]等反刍动物上的研究发现,日粮中添加不同水平尿素会在一定程度上影响瘤胃微生物的菌群结构。反刍动物个体间瘤胃微生物结构存在的差异较大,3~6个重复数可能很难反映出不同日粮处理的有效差异。因此,针对上述问题,本研究拟在前期湖羊饲养试验基础上,通过口腔胃管大规模采集饲养试验动物的瘤胃内容物,以探究不同尿素添加水平对育肥湖羊瘤胃发酵及微生物菌群结构的影响,为实际生产中合理使用尿素提供更多的理论指导。
1 材料与方法
1.1 试验设计及动物管理
将70只体重相近(23.6~26.0 kg)、健康的3~4月龄公湖羊,按照随机区组、同栏大小相近的原则,根据体重分为2个区组(低体重区组,40只;高体重区组,30只),共计35栏,每栏饲养2只羊。然后随机分为5个处理,每个处理7栏(低体重区组4栏、高体重区组3栏),分别饲喂以下5种日粮:正常豆粕(SBM)组(170 g·kg-1SBM,阳性对照),低豆粕(40 g·kg-1)日粮基础上分别添加0 g·kg-1尿素(U0组,阴性对照)、10 g·kg-1尿素(U10组)、20 g·kg-1尿素(U20组)和30 g·kg-1尿素(U30组)。各组日粮能量水平相近,但粗蛋白(CP)水平不同,其中SBM组(CP=17.6%)和U20组(CP=17.3%)粗蛋白水平相近,满足育肥肉羊蛋白需求《中华人民共和国农业部肉羊饲养标准:NY/T 816—2004》,而U0组(CP=11.6%)和U10组(CP=14.5%)低于育肥肉羊蛋白需求,U30组(CP=20.1%)高于育肥肉羊蛋白需求。具体日粮组成和营养水平与前期饲养试验一致[5]。预饲期SBM组、U10组、U20组和U30组在U0组日粮的基础上,分4个阶段逐步过渡为试验日粮,每阶段2 d。正试期每天饲喂全混合日粮(精粗质量比为55∶45),自由采食和饮水。试验预饲期1周,正试期8周。
1.2 样品的采集
试验第8周最后一天,对每组的14头湖羊在晨饲后3~5 h用瘤胃导管经口腔抽取瘤胃液。为减少唾液污染,舍弃前80 mL瘤胃液。将采集的瘤胃液一部分分装用于微生物DNA提取,其余部分经4层纱布过滤后,立即用pH计(Ecoscan pH 5,新加坡)测定pH值,然后进行分装,保存于-20 ℃冰箱,用于后续发酵指标的测定。
1.3 瘤胃液发酵参数的测定
瘤胃液样品经流水解冻后,参照Chaney等[10]的方法,以氯化铵为标准品,用比色法测定NH3-N的浓度。参照秦为琳[11]的方法进行挥发性脂肪酸(VFA)测定,样品经12 000 r·min-1离心5 min,上清液经0.22 μm针式滤器过滤后,使用气相色谱仪(Agilent 7980A,美国)测定。具体测定条件:柱箱温度 110 ℃,进样口温度220 ℃,检测器温度220 ℃,分流比30∶1,载气为氮气。
1.4 瘤胃微生物菌群定量及细菌多样性分析
1.4.1 DNA的提取瘤胃液样品经流水解冻,参照Zoetendal等[12]的方法加入1 mL 十六烷基三甲基溴化铵(CTAB)混匀并转移至锆珠管中,经Bead-beating和DNA提取液处理后,提取瘤胃液微生物DNA。使用Nano-Drop 2000c分光光度计(Thermo Fisher Scientific,美国)检测所提样品DNA的浓度,确保D260/D280值在1.8~2.0,于-20 ℃保存备用。
1.4.2 Real-time PCR菌群定量参照申军士等[13]的方法构建20 μL的反应体系(2 μL DNA模板、10 μL SYBR GREEN、0.4 μL ROX、0.4 μL引物R、0.4 μL引物F、6.8 μL双蒸水),使用ABI7500 Real-time PCR仪对瘤胃液样品中的总菌[14]、真菌[14]、原虫[15]和甲烷菌[16]进行荧光定量PCR分析。分别以总菌的16S rRNA、真菌和原虫的18S rRNA及甲烷菌的甲基辅酶M还原酶(mcrA)基因构建质粒并以此作为模板制作各目标菌定量的标准曲线。
1.4.3 瘤胃细菌MiSeq高通量测序与分析选取细菌16S rDNA的V3—V4可变区域为目的片段,对瘤胃液微生物DNA进行PCR扩增。在扩增过程中引入不同样本的接头(8 bp碱基序列)和测序引物对(5′-ACTCCTRCGGGAGGCAGCAG-3′/5′-GGACTACCVGGGTATCTAAT-3′)。PCR扩增采用20 μL反应体系,包括:4 μL 5×FastPfu Buffer,2 μL dNTPs(2.5 mmol·L-1),0.4 μL FastPfu聚合酶(北京全式金生物技术有限公司),上游和下游引物(5 μmol·L-1)各0.8 μL,总DNA模板10 ng,补ddH2O至 20 μL。PCR扩增反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,重复27个循环;72 ℃ 20 min。扩增完成后,采用 20 g·L-1琼脂糖凝胶电泳检测PCR产物,切胶并采用AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences,美国)进行回收,使用QuantiFluorTM-ST蓝色荧光定量系统进行定量检测,按照测序要求进行Illumian-MiSeq高通量测序。
对测序完成的所有数据进行如下处理:运用QIIME 1.9.10软件对原始数据进行片段拼接和质量过滤;使用Usearch软件基于UCHIME算法得到有效序列,再以97%的序列相似性将有效序列聚类成不同操作分类单元(OTU),再将每个OTU的代表序列与Silva 16S rRNA 128数据库进行比对、分类和注释;使用Mothur软件对样品进行α多样性分析(包括OTU数、覆盖率、丰富度指数和多样性指数)和基于Bary-Curtis距离算法进行主坐标分析(PCoA);使用Canoco 5.0软件对瘤胃优势菌属与瘤胃环境因子之间的关系作冗余分析(redundancy analysis,RDA)。
1.5 数据分析
对瘤胃功能菌群的实时定量PCR数据进行对数转换以提高其正态性。利用SAS 9.4软件一般线性模型(GLM)对瘤胃发酵参数和微生物定量数据进行统计分析。以羊为观察单位,分析模型以处理为固定效应,以区组、圈×区组×处理、羊(圈×区组×处理)为随机效应。利用SPSS 20.0软件对瘤胃细菌多样性指数和细菌门、属水平相对丰度进行非参数检验分析。采用Duncan’s法进行多重比较。
2 结果与分析
2.1 尿素对育肥湖羊瘤胃发酵参数的影响
由表1可知:与U10组相比,U20和U30组瘤胃液pH值显著升高(P<0.05),而U0和SBM(正常豆粕)组无显著变化(P>0.05)。与SBM组相比,U20和U30组瘤胃NH3-N质量浓度显著升高(P<0.05)。随尿素添加水平的提高,NH3-N质量浓度显著升高(P<0.05)。各处理组育肥湖羊瘤胃内TVFA、乙酸、丙酸和戊酸浓度差异不显著(P>0.05),但SBM和U10组TVFA浓度高于其他处理组。此外,SBM组丁酸、异丁酸浓度显著高于U0和U10组(P<0.05),与U20和U30组差异不显著。在相对浓度上,SBM组异丁酸比例较U10组显著提高(P<0.05)。各处理组育肥湖羊瘤胃内乙酸、丙酸、丁酸、戊酸和异戊酸比例无显著差异(P>0.05),但SBM组丁酸比例有高于其他处理组的趋势。

表1 尿素对育肥湖羊瘤胃发酵特性的影响
2.2 尿素对育肥湖羊瘤胃功能菌群数量的影响
由图1可知:与SBM、U10和U20组相比,U0和U30组瘤胃总菌、甲烷菌和原虫数量显著降低(P<0.05),U30组真菌数量显著降低(P<0.05),U0组真菌数量稍有降低,但差异不显著(P>0.05)。

图1 尿素对育肥湖羊瘤胃功能菌群数量的影响
2.3 尿素对育肥湖羊瘤胃细菌菌群α多样性的影响
采用16S rRNA测序,在70个瘤胃液样本中共得到3 395 648条优化序列,优化序列的平均长度为418.67 bp。所有样本共获得5 121个OTU,覆盖率均在98%以上。图2展示了不同尿素添加量对育肥湖羊瘤胃菌群α多样性的影响。如图2所示,不同处理组间的OTU值、Chao 1指数、ACE指数及Simpson指数无显著差异(P>0.05),但U30组Shannon指数显著高于U0和U10组(P<0.05),而其他各组间无显著差异(P>0.05)。

图2 尿素对育肥湖羊瘤胃细菌菌群α多样性的影响
2.4 尿素对育肥湖羊瘤胃细菌菌群β多样性的影响
图3展示了基于Bary-Curtis距离算法的主坐标分析图(principal coordinate analysis,PCoA),表2展示了基于相似性分析(analysis of similarities,ANOSIM)的不同处理间的相似性得分。PCoA结果显示各组间明显区分。ANOSIM显示,SBM组与其他各组瘤胃微生物群落组成之间差异显著(P<0.05);U0组与U20、U30组存在差异显著(P<0.05),但与U10组差异不显著(P>0.05);U10组与U20、U30组之间差异显著(P<0.05),而U20与U30组无显著差异(P>0.05)。
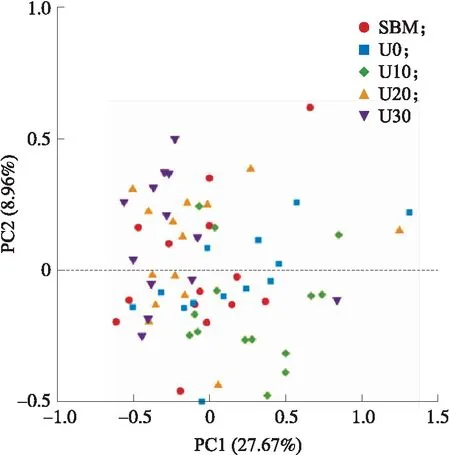
图3 育肥湖羊瘤胃食糜中细菌菌群的PCoA分析

表2 不同处理组微生物群落间(R)相似性分析(ANOSIM)
2.5 尿素对育肥湖羊瘤胃细菌门水平相对丰度的影响
由图4可知:瘤胃细菌的主要菌门有拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、螺旋菌门(Spirochaetes)、放线菌门(Actinobacteria)和纤维杆菌门(Fibrobacteres)等,不同处理间细菌组成存在差异。但各处理组的优势菌门均为Bacteroidetes(52.4%~64.7%)和Firmicutes(21.8%~37.2%),两者相对丰度达86.5%以上。从图5可知:存在显著差异的菌门中,U10组Bacteroidetes的相对丰度显著高于其他处理组(P<0.05),Firmicutes的相对丰度与U0组差异不显著(P>0.05),却显著低于SBM、U20和U30组(P<0.05)。与U0组相比,U20和U30组Actinobacteria的相对丰度显著降低(P<0.05)。

图4 瘤胃细菌在门水平上的组成(>1%)

图5 在门水平上受尿素添加影响显著的细菌
2.6 尿素对育肥湖羊瘤胃细菌属水平相对丰度的影响
由表3可知:各处理组的主要优势菌属为Prevotella1(27.96%~42.93%)、Muribaculaceae norank(3.36%~5.13%)、Treponema2(3.63%~4.10%)、Rikenellaceae RC9 gut group(3.41%~6.18%)和Christensenellaceae R-7 group(2.52%~5.46%)。U10组Prevotella1的相对丰度显著高于U20和U30组(P<0.05);U30组Rikenellaceae RC9 gut group、Christensenellaceae R-7 group和Ruminococcaceae NK4A214 group的相对丰度显著高于U0和U10组(P<0.05);SBM组Lachnospiraceae NK3A20 group的相对丰度显著高于U10组(P<0.05),但与其他组无显著差异(P>0.05)。

表3 尿素对育肥湖羊瘤胃细菌属水平相对丰度(>1%)的影响
2.7 瘤胃内环境对细菌菌群组成的影响
冗余分析(redundancy analysis,RDA)展示瘤胃内优势菌属(相对丰度>1%)与瘤胃环境因子(pH、NH3、TVFA)间的相关关系。由图6可知:pH值、NH3和TVFA均影响瘤胃微生物菌群组成,贡献度分别为67.0%、18.3%和14.7%。其中pH值的影响程度最为显著(P<0.01),并且Rikenellaceae RC9 gut group、Christensenellaceae R-7 group和Ruminococcaceae NK4A214 group等属水平细菌与pH值呈正相关关系。
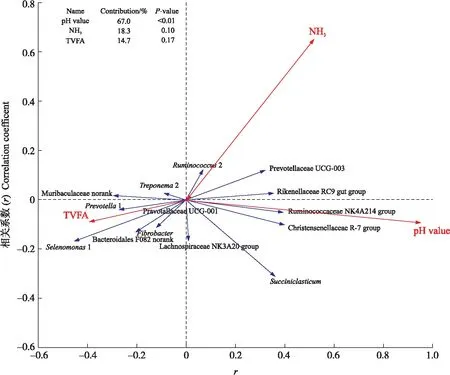
图6 瘤胃内优势菌属(相对丰度大于1%)与瘤胃环境因子之间的冗余分析
3 讨论
3.1 尿素对育肥湖羊瘤胃发酵参数的影响
氨氮是瘤胃微生物合成菌体蛋白的主要氮源,其浓度高低可以直接反映瘤胃氨的产生与瘤胃微生物对氨利用的动态情况。本研究发现U20和U30组瘤胃NH3-N浓度显著高于SBM组。并且随着尿素添加量的增加,各尿素处理组瘤胃NH3-N浓度也相应显著增加,这与Jin等[17]报道的结果相同。说明随着尿素添加量的升高,在瘤胃内水解成氨的速率逐渐大于瘤胃微生物对氨的利用速率,造成氨的盈余。瘤胃pH值是反映瘤胃发酵水平的另一重要指标,其对微生物的生长代谢和结构组成起主导作用。本试验RDA分析结果也表明pH值显著影响了瘤胃菌群的组成。一般来说,瘤胃pH值的正常生理范围为6.1~6.8[18],本试验各组瘤胃液pH值均在正常范围内,表明不同剂量尿素均未对瘤胃发酵产生不良影响。但U20和U30组pH值显著高于U0和U10组,分析可能是由尿素水解呈弱碱性所致。瘤胃内VFA主要由微生物发酵碳水化合物而来,是反刍动物重要的能量来源。本研究发现,各组间TVFA、乙酸、丙酸和戊酸浓度无显著差异,这与Currier等[19]的研究结果相一致,说明添加尿素并没有对育肥湖羊的能量供应产生影响。此外,我们还发现SBM组丁酸和异丁酸的浓度和比例高于尿素处理组,这可能与豆粕中支链氨基酸的脱氨基作用有关。以上结果表明,瘤胃内氨氮浓度会随尿素添加量的增加发生相应改变并最终引起瘤胃pH值的变化,但尿素添加并未影响瘤胃内碳水化合物的代谢。
3.2 尿素对育肥湖羊瘤胃功能菌群数量的影响
日粮的营养组成对瘤胃微生物具有非常重要的影响。有研究表明,日粮蛋白含量和碳水化合物水平与反刍动物瘤胃微生物的生长密切相关[20]。它们提供微生物生长所需的氮源和能量,当氮源和能量的供应达到同步时,会促进瘤胃微生物快速生长。在本试验中,U30组的NH3-N浓度显著高于U10和SBM组,但功能菌群的数量却显著降低。分析原因可能是在各处理组能量水平基本一致的情况下,氨态氮浓度的高低可能成为影响各功能菌群的主要因素。在满足瘤胃微生物能量供应的前提下,U10和SBM组相较其他各组的氨氮水平更为适宜,所以瘤胃内微生物可以最大程度利用氨氮来促进自身的生长繁殖,而U30组氨氮含量超过了瘤胃微生物的可利用能力,过量未被利用的氨反而对瘤胃微生物产生抑制作用。从本实验室前期在生产性能等方面的结果[5]也发现,U10组育肥湖羊的DMI和ADG在所有处理组中表现最好,而尿素高剂量U30组这2个指标反而降低,此结果进一步印证上面观点。因此,瘤胃氨浓度过低不能满足瘤胃微生物的生长需求,过高又会造成氨的浪费,不利于微生物正常功能的运行,只有在合适的氨浓度范围内,瘤胃微生物才可以高效利用氨合成微生物蛋白。
3.3 尿素对育肥湖羊瘤胃细菌菌群结构的影响
本试验所获得的16S rRNA基因覆盖瘤胃98%以上的细菌群落,说明测序结果基本可以代表样本中微生物的真实情况。本研究发现,添加不同水平尿素均没有对瘤胃菌群丰富度产生显著影响,但是多样性存在差异,U30组Shannon指数要显著高于U0组和U10组。此外,ANOSIM分析结果显示,各组瘤胃微生物群落组成之间存在差异。以上结果说明,在育肥湖羊日粮中添加尿素会影响瘤胃细菌的多样性,但并未改变其丰富度。
本试验结果显示,在门水平上,各处理组瘤胃内的优势菌门均为Bacteroidetes和Firmicutes,这与已有的研究结果基本一致[7,17,21]。Bacteroidetes是一类革兰氏阴性菌,主要功能是参与含氮类物质(如蛋白质、氨基酸和尿素等)和非纤维类碳水化合物(如淀粉)的降解。Firmicutes的优势菌属主要是一些纤维分解菌,如溶纤维丁酸弧菌属(Butyrivibriofibrisolvens)、假丁酸弧菌属(Pseudobutyrivibrio)和Ruminococcaceae等,它们共同参与降解饲料中的纤维物质。本试验发现,U10组Bacteroidetes相较于其他各组相对丰度显著升高,而Firmicutes有所降低,这可能与Bacteroidetes的生长条件有关,表明添加10 g·kg-1尿素可以促进瘤胃微生物对含氮类物质和非纤维类物质的降解。非纤维物质最终会降解为短链脂肪酸,本研究中U10组TVFA、乙酸和丙酸浓度高于其他处理组也证实了这一观点。这与Zhou等[7]的结果不完全一致,推测可能是因为试验动物品种和日粮配方不同从而导致瘤胃菌群组成存在差异。
在属水平上,各处理组优势菌属均为Prevotella1,这与Henderson等[22]、Wirth等[23]、赵佳琦等[24]报道的结果一致。Prevotella属于Bacteroidetes,是反刍动物瘤胃内数量最多的菌属。有研究报道,Prevotella在介导瘤胃中氨基酸脱氨以及蛋白质降解等方面发挥重要作用,该属中的栖瘤胃普雷沃氏菌(Prevotellaruminicola)和布氏普雷沃氏菌(Prevotellabryantii)是最为常见的参与氮代谢的细菌[25]。Prevotella也是瘤胃内主要的淀粉降解菌,参与降解淀粉、果糖和木聚糖等多糖[26]。在本试验结果中,U10组Prevotella1的相对丰度显著高于U20和U30组。Zhou等[7]在育肥牛饲粮中添加尿素也得到了与本试验相似的结果。推测可能是在此尿素剂量条件下比较适宜Prevotella的生长,尿素水解的氨能够更大程度地被Prevotella降解用于合成微生物蛋白,进一步提高对饲料底物的降解并产生短链脂肪酸,U10组瘤胃TVFA浓度高于其他尿素添加组的结果也可以印证。Christensenellaceae R-7 group属于Firmicutes,有研究发现,它参与调节瘤胃VFA和NH3-N的代谢,维持肠道功能稳定[27]。Ruminococcaceae主要参与氮代谢,能够促进氮的吸收利用,有研究表明其在盲肠中的丰度与氮利用率呈正相关关系[28-29]。Rikenellaceae参与降解可溶性多糖。本研究发现U30组Rikenellaceae RC9 gut group、Christensenellaceae R-7 group和Ruminococcaceae NK4A214 group的相对丰度显著升高,且RDA结果显示这3个菌属与瘤胃pH值呈正相关关系,表明这 3个菌属可以适应高剂量尿素引起瘤胃pH升高的环境,因此这3个菌属的生长没有受到抑制。曾钰等[27]也发现,Ruminococcaceae和Christensenellaceae与瘤胃pH值呈显著正相关关系,与本试验结果一致。Lachnospiraceae属于Firmicutes的一种,其与瘤胃内碳水化合物的降解和VFA的产生密切相关[30]。Fraga等[31]研究发现,未分类的毛螺菌科(unclassified Lachnospiraceae)与丁酸之间存在显著正相关关系。本试验中,SBM组Lachnospiraceae NK3A20 group的相对丰度明显高于其他处理组,同时其丁酸含量也是所有处理组最高的,说明Lachnospiraceae确实可以在一定程度上促进丁酸的产生。以上结果表明,不同添加水平的尿素对瘤胃菌群结构和组成的影响存在差异,适宜的尿素添加水平会增加瘤胃优势菌属Prevotella1的相对丰度,促进瘤胃氮代谢及对相关代谢产物的吸收利用;随着尿素剂量的升高瘤胃细菌的结构组成发生改变,而部分细菌对高剂量尿素引起的瘤胃pH值升高具有正相关关系。
综上,在低豆粕(40 g·kg-1)日粮基础上添加10 g·kg-1的尿素可使育肥湖羊瘤胃内功能菌群数量增加,促进瘤胃内相关代谢产物的产生与利用;而当尿素添加量达到30 g·kg-1时,会导致瘤胃pH值和NH3-N浓度升高,进而降低功能菌群数量和改变瘤胃细菌的结构组成。
